头孢曲松钠对慢性神经病理性疼痛的影响及其机制探讨
2015-03-10卢丽莉杨倩仇艳玲易力
卢丽莉,杨倩,仇艳玲,易力
(1石家庄市第三医院,石家庄050011;2石家庄市第四医院; 3河北省优抚医院)
外周神经损伤可导致神经病理性疼痛,包括痛觉过敏、痛性感觉异常、自发性疼痛。谷氨酸是中枢神经系统最主要的兴奋性神经递质,参与脊髓水平伤害性信息的传递及痛觉过敏的形成;因胞外没有谷氨酸代谢酶,胞外谷氨酸的清除主要依靠谷氨酸转运体(GLT)。目前,已克隆出5种高亲和力GLT[1,2],其中GLT-1在病理性疼痛和痛过敏的发生和维持中发挥重要作用[3~6]。Rothstein等[7]报道,β-内酰胺类抗生素中的头孢曲松(Cef)可增加GLT-1表达和谷氨酸摄取,但其是否会对慢性神经病性疼痛过程产生影响尚未报道。2013年10月~2014年3月,我们观察了Cef对大鼠坐骨神经慢性结扎损伤(CCI)慢性神经病理性疼痛的影响,并观察脊髓后角组织中GLT-1表达的变化,为临床上病理性疼痛的防治提供新线索与思路。
1 材料与方法
1.1 分组与造模处理 健康雄性SD大鼠70只,体质量(280±20)g。将动物随机分为7组各10只,A组仅暴露坐骨神经不结扎,B~F组均行右侧CCI[8]制作慢性神经病理性疼痛模型;C、E组分别于术后第1、7天开始于腹腔注射Cef,1次/d,共注射7次;D、F分别与C、E组相同,均同时腹腔注射NS。7组术前第1天,A、B、E、F组术后第1、3、5、7、9、11、14天,C、D组术后第1、3、5、7天,测定热缩足反射潜伏期、机械缩足反射阈值后,取材观察GLT-1表达。
1.2 热缩足反射潜伏期测定 应用BME-410A型热痛刺激仪(光源为12 V/35 W卤素灯)进行。测痛实验台高36 cm,顶部为2 mm厚的石英玻璃板。将有机玻璃板制成的动物笼(220 mm×220 mm× 280 mm,无底,用有机玻璃隔板隔成3个23 mm×11 mm×28 cm的独立空间)置于测痛实验台顶部的石英玻璃板上,将待测动物置于笼内;调节光源与石英玻璃板之间的距离,使落在足底的照射光圈直径5 mm,从开始照射至出现缩足逃避反射的时间(s)即为热刺激缩足潜伏期。重复测量5次,同一部位间隔10 min,不同部位间隔5 min,取平均值。如>30 s无反应,则停止照射,以免导致大鼠足底组织过热损伤。
1.3 机械缩足反射阈值测定 应用von-Frey纤维机械刺激器,包括12种刺激强度(0.09、0.18、0.28、0.52、1.12、3.80、5.50、7.70、10.40、18.20、44.00、 61.00 g)。将透明有机玻璃动物笼置于顶部为铁丝网的36 cm高的测痛实验台上,将待测大鼠置于笼中。实验者手持纤维穿过铁丝网格分别刺激大鼠两侧足底中心部位,刺激强度由小到大,每个强度刺激10次(次与次间隔3~5 s),将出现缩足反应5次以上的强度定为大鼠对机械刺激的反应阈值。刺激阈值刺激阈值>61.00 g均以61.00 g计,<0.09 g均以0.09 g计。
1.4 脊髓后角GLT-1检测 采用Western blot法。在预定时间点,将动物迅速断头处死,取出L4、L5脊髓节段,将所取标本置于4%多聚甲醛固定液中固定24 h备用。取L4、L5脊髓节段,切取右侧脊髓后角;称重后加入10倍体积的预冷裂解液,在冰浴下制成匀浆。4℃ 12 000 g离心 10 min,取上清-70℃保存。采用考马斯亮蓝法测定组织蛋白含量后,电泳、转膜、免疫显色;应用凝胶图像分析系统进行相对定量分析,以各处理组样本与β-actin蛋白的IOD值之比作为蛋白相对表达量。
1.5 统计学方法 采用SPSS11.5统计软件。计量数据用s表示,组间比较应用单因素方差分析,组内比较应用配对t检验。P≤0.05为差异有统计学意义。
2 结果
2.1 各组热缩足反射潜伏期比较 见表1。
表1 各组热缩足反射潜伏期比较(s,s)

表1 各组热缩足反射潜伏期比较(s,s)
注:与A组比较,*P<0.05;与D组比较,△P<0.05;与F组比较,#P<0.05。
组别 术前1 d 术后1 d 术后3 d 术后5 d 术后7 d 术后9 d 术后11 d 术后14 d A组 15.2±1.8 14.0±1.1 15.4±0.8 14.6±1.4 13.5±1.6 13.7±0.8 14.5±1.7 13.9±1.2 B组 14.0±0.9 14.2±0.7 9.5±1.4* 6.6±1.2* 7.5±1.1* 7.4±1.7* 7.2±1.0* 7.7±1.7* C组 14.4±1.2 14.6±1.1 9.2±1.0 9.6±0.5△ 12.3±1.7△ - - -D组 14.1±0.7 14.6±0.4 9.8±0.2 7.1±1.9 6.9±0.7 - - -E组 14.0±1.1 13.7±1.0 9.5±0.6 6.9±1.6 7.7±1.9 7.7±0.5 10.3±0.7# 12.1±1.0# F组 14.3±1.4 14.2±0.8 8.5±0.8 5.8±0.7 7.2±1.3 6.5±1.6 6.7±0.3 6.6±1.1
2.2 各组机械缩足反射阈值比较 各组机械缩足 反射阈值比较,见表2。
表2 各组机械缩足反射阈值比较(g,s)
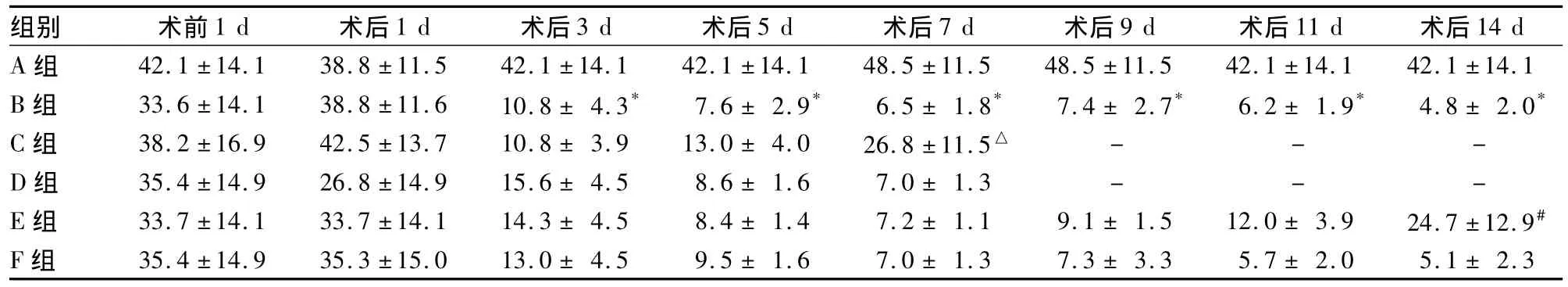
表2 各组机械缩足反射阈值比较(g,s)
注:与A组比较,*P<0.05;与D组比较,△P<0.05;与F组比较,#P<0.05。
组别 术前1 d 术后1 d 术后3 d 术后5 d 术后7 d 术后9 d 术后11 d 术后14 d A组 42.1±14.1 38.8±11.5 42.1±14.1 42.1±14.1 48.5±11.5 48.5±11.5 42.1±14.1 42.1±14.1 B组 33.6±14.1 38.8±11.6 10.8±4.3* 7.6±2.9* 6.5±1.8* 7.4±2.7* 6.2±1.9* 4.8±2.0* C组 38.2±16.9 42.5±13.7 10.8±3.9 13.0±4.0 26.8±11.5△ - - -D组 35.4±14.9 26.8±14.9 15.6±4.5 8.6±1.6 7.0±1.3 - - -E组 33.7±14.1 33.7±14.1 14.3±4.5 8.4±1.4 7.2±1.1 9.1±1.5 12.0±3.9 24.7±12.9# F组 35.4±14.9 35.3±15.0 13.0±4.5 9.5±1.6 7.0±1.3 7.3±3.3 5.7±2.0 5.1±2.3
2.3 各组脊髓后角GLT-1蛋白表达比较 A组可见脊髓后角组织中GLT-1蛋白表达,CCI后脊髓后角GLT-1蛋白表达出现双向性变化;与A组相比较,B组CCI后第1、3、5天脊髓后角组织中GLT-1蛋白表达显著升高,CCI后第7、9、11、14天脊髓后角组织中GLT-1蛋白表达下降,P均<0.05。C组CCI后第7天脊髓后角组织中GLT-1蛋白表达较D组显著升高(P<0.05),E组CCI后第14天脊髓后角组织中GLT-1蛋白表达较F组显著升高(P<0.05)。见表3。
表3 各组脊髓后角GLT-1蛋白表达比较(s)

表3 各组脊髓后角GLT-1蛋白表达比较(s)
注:与A组比较,*P<0.05;与D组比较,△P<0.05;与F组比较,#P<0.05。
组别 术前1 d 术后1 d 术后3 d 术后5 d 术后7 d 术后9 d 术后11 d 术后14 d A组 1.60±0.12 1.50±0.11 1.50±0.21 1.60±0.13 1.60±0.22 1.50±0.15 1.60±0.23 1.60±0.13 B组 1.50±0.21 2.20±0.13* 2.70±0.11* 3.30±0.23* 0.70±0.04* 0.50±0.02* 0.50±0.03* 0.40±0.15* C组 1.70±0.13 2.30±0.12 2.70±0.23 3.30±0.21 2.60±0.08△ - - -D组 1.60±0.14 2.20±0.21 2.60±0.13 3.20±0.17 0.60±0.03 - - -E组 1.50±0.14 2.30±0.19 2.70±0.12 3.20±0.21 0.80±0.04 0.50±0.03 0.70±0.05 3.10±0.18# F组 1.60±0.13 2.30±0.18 2.60±0.14 3.30±0.17 0.70±0.10 0.60±0.05 0.50±0.03 0.40±0.02
3 讨论
CCI模型是目前神经病理性疼痛研究中应用最广泛的模型,制作简便、稳定,能较好地模拟临床神经损伤后的痛觉过敏现象[8]。CCI模型的特点是用铬制羊肠线轻度结扎坐骨神经,使粗的有髓鞘纤维选择性的损伤,但仍保留大部分传递疼痛的C类纤维。模型动物术后第3天开始出现痛觉过敏,第5~7天降到最低,痛觉异常状态可持续2~3个月。本实验观察到,CCI大鼠术后第1天在坐骨神经压迫侧即可见足趾部卷曲、足外翻、跋行,行走时着地时间明显缩短,足部边缘着地,有明显的后肢保护现象出现。术后第3天,坐骨神经压迫侧出现痛觉过敏现象,热缩足反射潜伏期和械缩足反射阈值开始降低,到术后第5~7天达最低值,持续到所测试的第14天。这些变化同文献报道一致[8]。本研究还发现,CCI大鼠CCI侧脊髓后角GLT-1表达出现双向性变化,术后第1、4天表达明显升高,第7、14天表达减少。GLT后期阶段的下调同与CCI大鼠热缩足反射潜伏期和械缩足反射阈值降低相一致,因此推测GLT-1对CCI导致的慢性神经病理性疼痛的产生和维持具有重要作用。
最近研究发现[7],15种β-内酰胺类抗生素(包括青霉素和一些新的衍生物)具有出人意料的新功能,其中Cef可通过血脑屏障进入脑和脊髓。连续腹腔注射Cef 6~7 d后,可以选择性地诱发编码GLT-1谷氨酸转运体的基因转录,增加GLT-1的脑内表达,并增强其功能活性。本实验在CCI术后第1、7腹腔注射Cef,注射7 d后大鼠的热刺激潜伏期和机械缩足潜伏期明显延长,且CCI侧脊髓后角GLT-1表达明显增加。表明Cef可通过激动GLT-1对疼痛起到预防和治疗作用。
CCI导致的神经损伤诱导了脊髓谷氨酸的释放及GLT的过度激活,最初GLT的上调为一种保护性的机制[9],摄取突触间隙的谷氨酸,减少这种过度激活导致的有害影响。尽管GLT的最初上调不能完全阻止神经病理性痛的发展,但是在阻碍慢性病理性疼痛发展方面发挥了重要作用[10]。有研究表明,神经损伤后反馈性GLT上调,Trk受体和MAPK也发挥了积极的作用[11];后期GLT下调,可能是由于失去了初级传入引起的,而且脊髓中的退化性变化也部分导致脊髓胶质细胞型GLT的下调。脊髓GLT表达减少可致脊髓谷氨酸蓄积[12],使谷氨酸受体过度的激活,产生自发性痛和痛觉过敏。本研究应用Cef激动GLT-1表达后,抑制了CCI后期脊髓GLT表达的下降,使脊髓细胞间隙谷氨酸不会造成慢性蓄积,从而减轻了热痛敏和机械痛敏的产生;为临床上预防和治疗慢性神经病理性体提供了新的依据与思路。
[1]Ye Z,Sontheimer H.Modulation of glial glutamate transport through cell interactions with the extracellular matrix[J].Int J Dev Neurosci,2002,20(3-5):209.
[2]O'Shea R.Roles and regulation of glutamate transporters in the central nervous system[J].Clin Exp Pharmacol Physiol,2002 (29):1018-1023.
[3]Sung B,Lim G,Mao J.Altered expression and uptake activity of spinal glutamate transporters following peripheral nerve injury contributes to the pathogenesis of neuropathic pain in rats[J].J Neurosci,2003,23(7):2899-2910.
[4]Minami T,Matsumura S,Okuda-Ashitaka E,et al.Characterization of the glutamatergic system for induction and maintenance of allodynia[J].Brain Res,2001,895(1-2):178-185.
[5]Niederberger E,Schmidtko A,Rothstein JD,et al.Modulation of spinal nociceptive processing through the glutamate transporter GLT-1[J].Neuroscience,2003,116(1):81-87.
[6]Gosselina RD,Damien B,Isabelle D.Upregulation of the GABA transporter GLT-1 in the gracile nucleus in the spared nerve injury model of neuropathic pain[J].Neurosci Lett,2010,480(2):132-137.
[7]Rothstein JD,Patel S,Regan MR,et al.β-lactam antibiotics offer neuroprotection by increasing glutamate transporter expression[J].Nature,2005,433(7021):73-77.
[8]Bennett GJ and Xie YK.A peripheral mononeuropathy in rat thatproduces disorder of pain sensation like those seen in man[J].Pain,1988,33(1):87-107.
[9]Mao QX,Yang TD.Amitriptyline upregulates EAAT1 and EAAT2 in neuropathic pain rats[J].Brain Res Bull,2010,81(4-5):424-427.
[10]Napier IA,Moharnmadi SA,Christie MJ.Glutamate transporter dysfunction associated with nerve injury-induced pain in mice[J].J Neurophysiol,2012,107(2):649-657.
[11]Danbolt NC.Glutamate uptake[J].Prog Neurol,2001,65(1):1-105.
[12]杨娜,隋峰,姜廷良.神经性疾病相关的谷氨酸转运体研究进展[J].中国实验方剂学杂志,2011,17(7):255-258.
