人参皂苷预处理对电离辐射下人造血干细胞的保护作用及其机制探讨
2015-03-10黄颖梁晓燕李骋进胡军康晓莉
黄颖,梁晓燕,李骋进,胡军,康晓莉
(陕西省人民医院,西安710068)
随着放射疗法在肿瘤患者中的大量应用,因放射所致组织细胞损伤备受关注,其中人造血干细胞(HPCs)最易受到辐射影响[1]。研究发现,电离辐射可诱导HPCs产生大量活性氧(ROS),从而引起HPCs氧化应激[2,5],导致细胞内基因发生突变[3],甚至发生癌变[4]。Nrf-2可经过转录翻译出一些抗氧化物质,对抗氧化应激作用[6]。Caspase-3是细胞凋亡通路中级联反应的启动子,被证实参与电离辐射所致细胞凋亡过程[7,8]。人参皂苷作为人参内主要的药理活性成分[9],具有很强的抗炎和抗氧化作用,可明显抑制心肌细胞和神经元细胞在病理条件下发生的凋亡和氧化应激[10,11]。目前,关于人参皂苷对电离辐射下HPCs的保护作用还未见报道。2014年1~11月,我们通过体外分离培养HPCs,观察人参总皂苷对不同强度电离辐射下HPCs是否有一定保护作用,并探讨其作用机制。
1 材料与方法
1.1 材料 细胞培养基、胎牛血清、胰蛋白酶由美国Gibco公司提供;人参皂苷购自吉林省宏久生物技术股份有限公司;CD+34细胞选择试剂盒、MTT试剂盒、AV/PI双染试剂盒、ROS检测试剂盒等购于上海碧云天生物科技有限公司;Caspase-3和Nrf-2的一抗和二抗购于武汉博士德生物科技有限公司。
1.2 方法
1.2.1 HPCs的分离培养 脐带血由陕西省人民医院检验科采集。供者要求:身体健康,发育良好的非高龄产妇;无遗传病史,无血液系统疾病,无寄生虫及地方病;HIV、肝炎、梅毒等检测均为阴性;供者知情同意。每次采集脐血50~120 mL。采用磁珠细胞分选免疫磁性吸附柱分离装置,用CD+34细胞选择试剂盒按说明分离与纯化CD+34细胞,培养21 d。
1.2.2 HPCs电离辐射处理 将细胞以1×103接种于96孔板,随机分为对照组和观察组;对照组不处理,观察组予以5.0 μmol/L人参皂苷0.2 mL/孔预处理24 h。两组用直线加速器行X射线照射,剂量率为2.60 Gy/min,照射时间分别为0、23、46、115 s,辐射剂量分别为0、1、2、5 Gy。然后加入新鲜的培养基,37℃下置入5%CO2培养箱内继续培养。
1.2.3 HPCs活性检测 采用MTT法。按照操作说明书,先将1 mg/mL的MTT加入各组细胞内,37℃下继续培养3 h。倒掉培养液,加入二甲基亚砜,上酶标仪于550 nm波长下测定各组细胞的吸光度,计算细胞存活率。
1.2.4 ROS水平测定 电离辐射后24 h,每个样本收集细胞约5×105;按照说明书向各实验孔内添加50 μmol H2DCFDA,37℃避光染色30 min。收集各孔内细胞,用PBS液清洗后进行重悬,上流式细胞仪检测;调整激发波长至490 nm,发射波长为527 nm,用 CellQuest软件以荧光相对强度表示 ROS水平。
1.2.5 Caspase-3和Nrf-2检测 采用Western blot法。将各组细胞以1×106接种于培养瓶内,按照每200万细胞100 μL裂解液的比例加入裂解液提取细胞。取出所需测定的样品,沸水中煮5 min使蛋白变性;置入0.5 mL的离心管内,加入5×SDS的缓冲液。按照说明书对样品进行电泳、显影,将胶片拍照,用Image Pro Plus对结果进行分析。
1.2.6 统计学方法 采用SPSS20.0统计软件。所得数据以s表示,采用t检验及方差分析。P≤ 0.05为差异有统计学意义。
2 结果
2.1 两组细胞存活率及辐射24 h后ROS活性比较见表1。
表1 两组细胞存活率及辐射24 h后ROS活性比较(s)
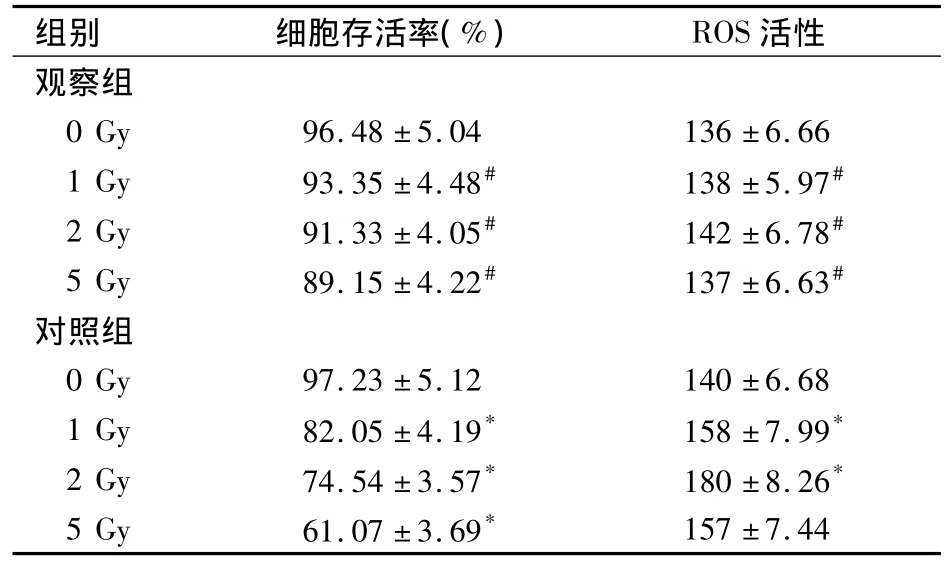
表1 两组细胞存活率及辐射24 h后ROS活性比较(s)
注:与同组0 Gy比较,*P<0.05;与对照组同辐射剂量比较,#P<0.05。
组别 细胞存活率(%) ROS活性157±7.44观察组0 Gy 96.48±5.04 136±6.66 1 Gy 93.35±4.48# 138±5.97# 2 Gy 91.33±4.05# 142±6.78# 5 Gy 89.15±4.22# 137±6.63#对照组0 Gy 97.23±5.12 140±6.68 1 Gy 82.05±4.19* 158±7.99* 2 Gy 74.54±3.57* 180±8.26* 5 Gy 61.07±3.69*
2.2 两组细胞Caspase-3、Nrf-2表达比较 见表2。
表2 两组细胞Caspase-3、Nrf-2表达比较(s)

表2 两组细胞Caspase-3、Nrf-2表达比较(s)
注:与同组0 Gy比较,*P<0.05;与对照组同辐射剂量比较,#P<0.05。
组别Caspase-3 Nrf-2 1.21±0.04观察组0 Gy 1.28±0.04 1.17±0.06 1 Gy 1.53±0.05*# 1.73±0.09*# 2 Gy 1.61±0.05*# 1.94±0.10*# 5 Gy 1.83±0.06*# 2.28±0.12*#对照组0 Gy 1.27±0.04 1.15±0.04 1 Gy 1.84±0.05* 1.24±0.04 2 Gy 1.96±0.06* 1.16±0.03 5 Gy 2.31±0.07*
3 讨论
人的造血组织对电离辐射非常敏感。据报道,1~7 Gy的电离辐射均会诱导HPCs发生不同程度的损伤[12],我们选取1~5 Gy进行研究[13]。研究证实,5.0 μmol/L的人参皂苷抗氧化作用显著[14],所以我们以5.0 μmol/L人参皂苷做为实验剂量。
本研究结果显示,受到电离辐射的HPCs活性明显下降,而且这种下降趋势可被人参皂苷所抑制。我们知道,MTT是通过测定线粒体膜上的琥珀酸脱氢酶的活性来测定细胞活性的[15],从而我们推断,人参总皂苷的这种作用正是通过对线粒体产生保护作用实现的,而线粒体正是 ROS产生的主要场所[16]。我们进一步研究发现,在细胞经辐射继续培养24 h后,大量细胞已经死亡,但整体的ROS水平仍明显高于对照组。其原因可能为残存的细胞为避免发生凋亡继续增殖,而增殖过程中可产生大量的ROS[17]。但是,5 Gy剂量电离辐射下,HPCs的ROS水平已经基本持平,可能与高剂量的电离辐射激活某种抗氧化机制有关[18]。但是,当我们用人参总皂苷处理HPCs后,细胞内ROS水平显著降低,从而减缓细胞凋亡的发生。
Caspase-3为半胱氨酸蛋白酶家族的一个重要成员,在细胞凋亡的信号转导通路中起着至关重要的作用。它是死亡受体介导的细胞凋亡途径中的关键启动子,其活性增强一般说明细胞即将向凋亡进展[20]。本研究显示,电离辐射可诱导 HPCs内Caspase-3表达增强,而人参皂苷可有效抑制Caspase-3表达,这可能是人参皂苷抑制电离辐射诱导HPCs凋亡的一个作用机制。Nrf-2是一种与氧化应激密切相关的转录因子,它可以直接激活细胞内含抗氧化基因的蛋白表达,从而起到对抗细胞氧化的作用[21];另外,Nrf-2还可有效抑制各种病理状态下引起的线粒体功能改变[22]。本结果显示,在电离辐射的作用下,HPCs内的Nrf-2蛋白随着辐射增强呈下降趋势,用人参皂苷处理后其表达增加,提示人参皂苷抗氧化作用可能与促进Nrf-2表达有关。但是,人参皂苷含有Rb3、Rg1、Rf2、Rh2和Rd等多种活性成分,而其激活Nrf-2的表达到底是哪种单体起作用,需要进一步研究。
[1]Floratou K,Giannopoulou E,Antonacopoulou A,et al.Oxidative stress due to radiation inhematopoietic progenitor cells:protection by IGF-1[J].J Radiat Res,2012,53(5):672-685.
[2]Wang Y,Liu L,Pazhanisamy SK,et al.Total body irradiation causes residual bone marrow injury by induction of persistent oxidative stress in murine hematopoietic stem cells[J].Free Radic Biol Med,2010,48(2):348-356.
[3]Tominaga H,Kodama S,Matsuda N,et al.Involvement of reactive oxygen species(ROS)in the induction of genetic instability by radiation[J].J Radiat Res,2004,45(2):181-188.
[4]Huang L,Snyder AR,Morgan WF.Radiation-induced genomic instability and its implications for radiation carcinogenesis[J].Oncogene,2003,22(37):5848-5854.
[5]Bowler DA,Moore SR,Macdonald DA,et al.Bystander-mediated genomic instability after high LET radiation in murine primary haemopoietic stem cells[J].Mutat Res,2006,597(1-2):50-61.
[6]Jain AK,Bloom DA,Jaiswal AK.Nuclear import and export signals in control of Nrf2[J].J Biol Chem,2005,280(32): 29158-29168.
[7]Simon HU,Haj-Yehia A,Levi-Schaffer F.Role of reactive oxygen species(ROS)in apoptosis induction[J].Apoptosis,2000,5 (5):415-418.
[8]Samuni AM,Kasid U,Chuang EY,et al.Effects of hypoxia on radiation-responsive stress-activated protein kinase, p53, and caspase 3 signals in TK6 human lymphoblastoid cells[J].Cancer Res,2005,65(2):579-586.
[9]Qi LW,Wang CZ,Yuan CS.Ginsenosides from American ginseng:chemical and pharmacological diversity[J].Phytochemistry,2011,72(8):689-699.
[10]Liu Q,Kou JP,Yu BY.Ginsenoside Rg1 protects against hydrogen peroxide-induced cell death in PC12 cells via inhibiting NF-kappa B activation[J].Neurochem Int,2011,58(1):119-125.
[11]Wang Y,Li X,Wang X,et al.Ginsenoside Rd attenuates myocardial ischemia/reperfusion injury via Akt/GSK-3beta signaling and inhibition of the mitochondria-dependent apoptotic pathway[J].PLoS One,2013,8(8):e70956.
[12]Mauch P,Constine L,Greenberger J,et al.Hematopoietic stem cell compartment:acute and late effects of radiation therapy and chemotherapy[J].Int J Radiat Oncol Biol Phys,1995,31(5): 1319-1339.
[13]Campbell BA,Voss N,Woods R,et al.Long-term outcomes for patients with limited stage follicular lymphoma:involved regional radiotherapy versus involved node radiotherapy[J].Cancer,2010,116(16):3797-3806.
[14]Ma L,Liu H,Xie Z,et al.Ginsenoside Rb3 protects cardiomyocytes against ischemia-reperfusion injury via the inhibition of JNK-mediated NF-kappaB pathway:a mouse cardiomyocyte model[J].PLoS One,2014,9(8):e103628.
[15]Dreiem A,Gertz CC,Seegal RF.The effects of methylmercury on mitochondrial function and reactive oxygen species formation in rat striatal synaptosomes are age-dependent[J].Toxicol Sci,2005,87 (1):156-162.
[16]Cho YS,Challa S,Moquin D,et al.Phosphorylation-driven assembly of the RIP1-RIP3 complex regulates programmed necrosis and virus-induced inflammation[J].Cell,2009,137(6): 1112-1123.
[17]Hayashi T,Hayashi I,Shinohara T,et al.Radiation-induced apoptosis of stem/progenitor cells in human umbilical cord blood is associated with alterations in reactive oxygen and intracellular pH[J].Mutat Res,2004,556(1-2):83-91.
[18]Summers RW,Maves BV,Reeves RD,et al.Irradiation increases superoxide dismutase in rat intestinal smooth muscle[J].Free Radic Biol Med,1989,6(3):261-270.
[19]Vermes I,Haanen C,Steffens-Nakken H,et al.A novel assay for apoptosis.Flow cytometric detection of phosphatidylserine expression on early apoptotic cells using fluorescein labelled Annexin V[J].J Immunol Methods,1995,184(1):39-51.
[20]Paroni G,Henderson C,Schneider C,et al.Caspase-2-induced apoptosis is dependent on caspase-9,but its processing during UV-or tumor necrosis factor-dependent cell death requires caspase-3[J].J Biol Chem,2001,276(24):21907-21915.
[21]Johnson JA,Johnson DA,Kraft AD,et al.The Nrf2-ARE pathway:an indicator and modulator of oxidative stress in neurodegeneration[J].Ann N Y Acad Sci,2008(1147):61-69.
[22]Ludtmann MH,Angelova PR,Zhang Y,et al.Nrf2 affects the efficiency of mitochondrial fatty acid oxidation[J].Biochem J,2014,457(3):415-424.
