东亚唐棣组织培养体系1)
2015-03-10尹鹏先蔡靖李厚华Melvin姜在民
尹鹏先 蔡靖 李厚华 Melvin T T 姜在民
(西北农林科技大学,杨凌,712100)
东亚唐棣组织培养体系1)
尹鹏先 蔡靖 李厚华 Melvin T T 姜在民
(西北农林科技大学,杨凌,712100)
以东亚唐棣带芽茎段为外植体,研究了不同消毒方法对于无菌体系建立的影响、不同类型的芽对于诱导萌发的影响、不同基本培养基以及激素组合对于增殖与生根的影响。结果表明:较为适合东亚唐棣消毒的方法为75%酒精消毒30 s,0.1% HgCl2消毒8 min,萌发率为16.7%;带有一侧芽的顶芽为较为合适的外植体,萌发率可达87.6%;最适增殖培养基为MS+6-BA 3.0 mg·L-1+NAA 0.1 mg·L-1,增殖系数可达4.8;最适生根培养基为1/4MS+NAA 0.1 mg·L-1。
东亚唐棣;组织培养;扩繁;生根培养
We used the explants from buds to study the influence of different disinfection methods, basal media, phytohormone on shoot proliferation, rooting ofAmelanchierasiatica. The best disinfection method was 75% Ethanol for 30 s and 0.1% HgCl2for 8 min. The explant suitable for bud initiation was top bud with an axillary bud with the initiation rate of 87.6%. Optimal shoot proliferation occurred on MS medium with 3.0 mg·L-1BA and 0.1 mg·L-1NAA. The best rooting was 1/4 MS with 0.1 mg·L-1NAA.
东亚唐棣(Amelanchierasiatica)属于蔷薇科苹果亚科唐棣属,是我国仅产的两种唐棣属植物之一,分布于我国浙江、江西、安徽等地。落叶乔木或灌木,花期4—5月份,花为总状花序,具多数花朵,花白色,花瓣卵状披针形;果期8—9月份,果实球形或扁球形,直径6~8 mm,紫黑色[1]。东亚唐棣树形优美,花朵繁密,果实含钙量高,兼具较高的观赏价值与食用价值,是不可多得的园林绿化树种。我国园林植物资源极为丰富,但包括东亚唐棣在内的大量可供观赏的种类仍然处于野生状态,未被开发利用[2-3]。随着我国对于园林绿化树种种类以及质量的需求与日俱增,东亚唐棣的发展前景十分广阔。
唐棣属植物在中国仅有两个种,为唐棣(Amelanchiersinica)及东亚唐棣[1,4],有关其组织培养体系的研究在国内外均未见到相关报道。Magdalena et al.[5]研究了不同贮藏方式对加拿大唐棣(Amelanchiercanadensis)果实抗氧化活性的影响,Pruski et al.[6]、Baldwin et al.[7]以及杜保国[8]、林宝山[9]对桤叶唐棣(Amelanchieralnifolia)组织培养有过一定的研究。文中以东亚唐棣带芽茎段为外植体,对其组织培养体系的建立进行了研究,以期为东亚唐棣园林绿化的规模化生产和推广应用提供理论支持。
1 材料与方法
试验材料为2012年7月中旬采自西北农林科技大学校园的当年生带芽茎段。
外植体消毒:将采集的枝条用小毛刷刷洗干净,剪成3~5 cm带芽茎段,带芽茎段为随机混合的顶芽、侧芽及带顶芽的侧芽。去除茎段叶片留下叶柄基部3~4 mm,于自来水下冲洗1~2 h。在超净工作台上用75%酒精消毒30 s,无菌水冲洗2次,再分别用0.1% HgCl2消毒4、6、8、10、12 min,无菌水冲洗3次,消毒过程中轻微摇晃,10 d后统计污染率。
芽的诱导萌发与增殖培养:分别取顶芽、侧芽、带顶芽的侧芽消毒后接种于MS+3.0 mg·L-16-BA+0.1 mg·L-1NAA培养基上,每种组合接种40~60瓶,每瓶1个,重复3次。15 d后统计不同类型芽的萌发率,萌发率=萌发数/未污染个数。
在芽的萌发过程中,每隔一周不断切去茎段基部褐化的部位,待芽长至2~3 cm时,将芽转至同一培养基中待其增殖,以获得更多数量的组培苗用于后续试验。
选取生长状况相似的组培苗开展增殖培养试验,采用2因素3水平完全随机设计,探讨6-BA、NAA两种不同激素水平对增殖的影响。试验以MS为基本培养基,6-BA选择1.0、2.0、3.0 mg·L-13个水平,NAA选用0.05、0.10、0.20 mg·L-13个水平,共设置9种组合,每种组合接种10瓶,每瓶3个组培苗,共重复3次。50 d后统计增殖与生长状况。增殖系数=增殖苗数/接种苗数。生长状况划分为3个健康指数:“1”、“2”、“3”,其中“1”表示组培苗生长健壮,茎干粗壮,叶片大而鲜绿,无黄叶及玻璃花苗;“2”表示生长较为健壮,黄叶较少,无玻璃化苗;“3”表示生长一般,叶片小而卷曲,存在部分黄叶,茎干细弱。
生根培养:以生长健壮的2 cm以上的增殖苗为材料,采用2因素3水平完全随机设计,研究基本培养基与激素水平对生根的影响。基本培养基选择MS、1/2MS、1/4MS、1/6MS、1/8MS;激素选择NAA,分为0.1、0.5、1.0 mg·L-13个水平。每个处理接种10瓶,每瓶3个,重复3次。30 d后统计生根率及生长情况。
以上培养条件为:培养温度(25±2)℃,光照强度2 000 lx,光照时间每天12 h。培养基均附加蔗糖30 g·L-1、琼脂6 g·L-1,pH值为5.8。
2 结果与分析
2.1 不同消毒方法对无菌体系建立的影响
消毒方法对于外植体的影响较大,正确选择消毒方法对于无菌体系的建立起着关键的作用。由表1可知,高污染率和低萌发率是东亚唐棣无菌体系建立的重要限制因子,随着0.1% HgCl2处理外植体时间的加长,污染率随之降低,同时褐化死亡率升高。HgCl2处理时间较长,对植物组织的伤害较大,褐化死亡率较高;处理时间较短,污染率较高。综合考虑,选择75%酒精消毒30 s、0.1% HgCl2消毒8 min为较为适宜的消毒方法。
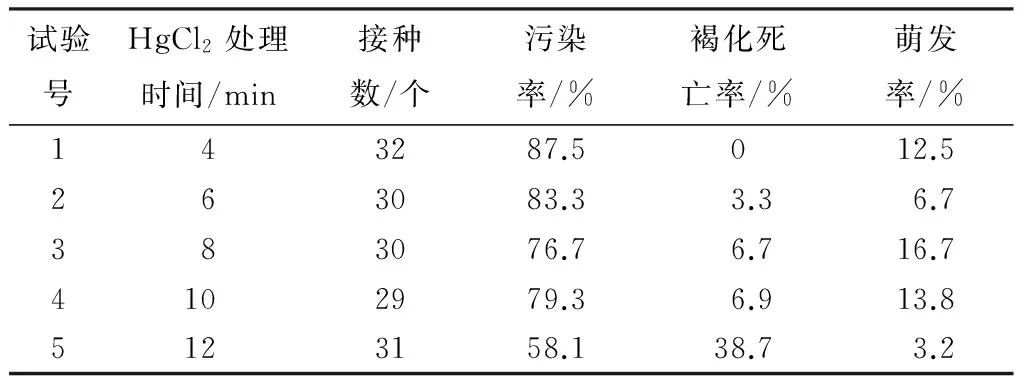
表1 不同消毒方法对无菌体系建立的影响
2.2 不同类型的芽对于诱导萌发的影响
接种10 d后部分芽开始膨大,芽鳞展开,15 d后有新叶展开。不同类型的外植体对于芽的萌发影响较大(表2)(图1A-C)。顶芽虽然最为饱满,但未发现有萌发现象,随着培养时间的增长,顶芽逐渐褐化死亡。侧芽萌发率较低,仅为21.4%,且诱导出的新芽质量相对较弱。带有一个顶芽的侧芽,在培养一段时间后,顶芽不萌发,紧邻顶芽的侧芽开始萌发(图1D-E),且萌发率较高,可达87.5%(表2)。

表2 不同类型的芽对于诱导萌发的影响

A-C.不同类型的芽,分别为顶芽(A)、侧芽(B)、带有一个侧芽的顶芽(C);D-E.侧芽开始有新叶展开;F.组培苗的增殖;G-H.生根培养。
2.3 不同激素组合对于东亚唐棣组培苗增殖的影响
将组培苗接入增殖培养基后约15 d,组培苗基部切口处开始分化出小的芽点。培养50 d后的统计结果表明,增殖苗的数量随着6-BA的增高而增加,随着NAA质量浓度的增加,增殖苗数量表现为先增加后降低的趋势(表3)。不同质量浓度的6-BA与NAA的配比取得效果差异较大,在6-BA 1.0 mg·L-1+NAA 0.20 mg·L-1的培养基上能取得较多的愈伤组织,在6-BA 2.0 mg·L-1+NAA 0.20 mg·L-1培养基上生长的苗增殖情况较差,但最为健壮,且有部分生根。综合考虑,较为适宜的增殖培养基为MS+6-BA3.0 mg·L-1+NAA 0.1 mg·L-1,增殖系数可达4.87(图1F)。
2.4 不同基础培养基及激素组合对于东亚唐棣组培苗生根的影响
生根培养10 d左右,有小根从切口处产生,培养30 d后在1/4MS+0.1 mg·L-1NAA的培养基上生根率最高,可达93.0%(图1G-H),生根数最高,可达3.68条,根长最长,可达3.55 cm;在MS+0.5 mg·L-1NAA的培养基上健康指数最高,可达2.62(表4)。生根率随着无机盐质量浓度的降低呈现出先升高后降低的趋势。
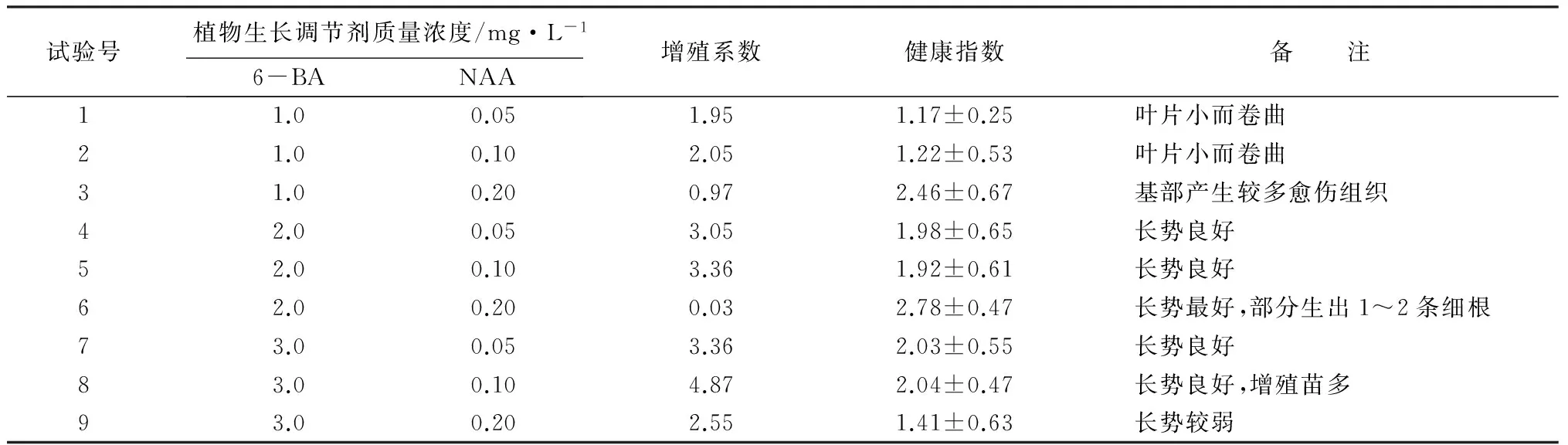
表3 不同激素组合对于东亚唐棣组培苗增殖的影响
注:表中健康指数为平均值±标准差。
表4 不同基础培养基及激素组合对于东亚唐棣组培苗生根的影响

试验号植物生长调节剂质量浓度/mg·L-1基本培养基NAA生根率/%平均生根数/条根长/cm健康指数1MS0.128.90.551.222.43±0.702MS0.53.20.031.672.62±0.533MS1.06.20.181.562.44±0.7241/2MS0.151.71.142.332.00±0.6751/2MS0.535.31.623.152.07±0.6861/2MS1.04.80.742.672.07±0.7071/4MS0.193.03.683.552.31±0.5181/4MS0.566.72.472.882.20±0.6491/4MS1.073.73.713.322.18±0.66101/6MS0.163.33.003.031.54±0.72111/6MS0.555.82.532.351.46±0.66121/6MS1.042.12.342.101.43±0.67131/8MS0.161.52.782.851.48±0.66141/8MS0.547.62.122.211.46±0.74151/8MS1.040.31.352.031.28±0.56
注:表中健康指数为平均值±标准差。
3 结论与讨论
不同类型的芽作为外植体对诱导萌发的影响较大,试验发现,单纯的使用顶芽无法诱导其萌发,外植体在培养一段时间后便褐化死亡,使用侧芽萌发率较低,然而,使用带有一个顶芽的侧芽能取得较高的萌发率。这可能与顶芽的衰老及其细胞的程序性死亡使得植株的顶端优势受到抑制,激素随之分配给侧芽,促进了侧芽的萌发与生长[10-12]。
不同质量浓度的6-BA与NAA的组合对于东亚唐棣组培苗的增殖影响较大,随着6-BA质量浓度的升高,增殖系数加大,随着NAA质量浓度的加大,增殖系数呈现先上升后下降的趋势。在6-BA 3.0 mg·L-1与NAA 0.1 mg·L-1组合的条件下增殖系数较高,综合情况较好,这与Pruski et al.[6]在桤叶唐棣中得出的结论较为相似;在6-BA 1.0 mg·L-1与NAA 0.2 mg·L-1组合的条件下,增殖系数较低,增殖苗基部切口处产生大量愈伤组织;在6-BA 2.0 mg·L-1与NAA 0.2 mg·L-1组合的条件下,健康指数最高,但增殖系数较小。
生根试验结果表明,随着无机盐质量浓度的降低,生根率呈现出先升高后降低的趋势,在1/4MS培养基上取得了较好的生根效果,这与杜保国[8]的研究结果较为相似。出现这种现象的原因可能是因为随着大量元素的减少,植物体需要更多的根系吸收养分,从而提高了生根率;也可能是由于NH4NO3质量浓度逐渐降低,减弱了对植物生根的抑制作用[13],提高了生根率。随着大量元素的继续降低,培养基中的营养物质下降,植物表现出生长不良的趋势,从而降低了生根率。
[1] 中国科学院中国植物志编辑委员会.中国植物志:第36卷[M].北京:科学出版社,1974:403.
[2] 龙韬.我国观赏植物资源研究现状及发展趋势[J].北京农业,2011(6):53-55.
[3] 张佳平,丁彦芬.中国野生观赏植物资源调查、评价及园林应用研究进展[J].中国野生植物资源,2012,31(6):18-23.
[4] 郑万钧.中国树木志:第2卷[M].北京:中国林业出版社,1985:1057.
[5] Magdalena M, Ryszard M. Effect of processing and storage on the antioxidant activity of frozen and pasteurized shadblow serviceberry (Amelanchiercanadensis)[J]. International Journal of Food Properties,2010,6(13):1225-1233.
[6] Pruski K, Nowak J, Grainger G. Micropropagation of four cultivars of saskatoon berry (AmelanchieralnifoliaNutt.)[J]. Plant Cell, Tissue and Organ Culture,1990,21(2):103-109.
[7] Baldwin B D, Bandara M S, Tanino K K. Bud scale maturation in Saskatoon berry (AmelanchieralnifoliaNutt.) plantlets following in vitro hormonal treatments[J]. Acta Horticulture,2000(520):203-208.
[8] 杜保国.桤叶唐棣的组织培养和再生系统的建立[D].杨凌:西北农林科技大学,2005.
[9] 林宝山.尼尔森唐棣的组织培养和快速繁殖[J].植物生理学通讯,2002,38(6):589.
[10] Beck E, Scheibe R. Senescence and ageing in plants and cyanobacteria[J]. Physiologia Plantarum,2003,119(1):1-4.
[11] Xu Wenjie, Kalima-N K M, Cui Kerning. Programmed cell death during terminal bud senescence in a sympodial branching tree,Eucommiaulmoides[J]. Progress In Natural Science,2004,14(8):694-699.
[12] Wang Dayong, Hu Shuang, Li Qing, et al. Photoperiod control of apical bud and leaf senescence in Pumpkin (Cucurbitapepo) strain 185[J]. Acta Bot Sin,2002,44(1):55-62.
[13] Druart P. Optimization of culture media for in vitro rooting ofMalusdomesticaBorkh. cv. Compact Spartan[J]. Biologia Plantarum,1997,39(1):67-77.
Tissue Culture System ofAmelanchierasiatica
Yin Pengxian, Cai Jing, Li Houhua, Melvin T T, Jiang Zaimin(Northwest A&F University, Yangling 712100, P. R. China)//Journal of Northeast Forestry University,2015,43(1):54-56.
Amelanchierasiatica; Tissue culture; Proliferation; Rooting
尹鹏先,男,1990年6月生,西北农林科技大学林学院,硕士研究生。E-mail: yinpengxian@126.com。
姜在民,西北农林科技大学生命学院,副教授。E-mail:jiangzmz@163.com。
2014年5月11日。
Q943.1
1) 林业公益性行业科研专项(201204308)。
责任编辑:任 俐。
