结直肠癌16层螺旋CT灌注成像与肿瘤血管生成相关性分析
2015-03-10尹兰英李庆啸李彩英韩帅张铁亮
尹兰英 李庆啸 李彩英 韩帅 张铁亮
结直肠癌16层螺旋CT灌注成像与肿瘤血管生成相关性分析
尹兰英 李庆啸 李彩英 韩帅 张铁亮
目的 研究结直肠癌MSCT血流灌注成像参数与微血管密度、促血管生成素2(Ang-2)、血管内皮生长因子(VEGF)表达之间的相关性,探讨结直肠癌灌注成像与肿瘤血管生成的关系。方法 对25例结直肠癌患者进行螺旋CT灌注成像检查,螺旋CT灌注的参数包括血流量(BF)、血容量(BV)、平均通过时间(MTT)和表面通透性(PS)。术后采用免疫组化方法测定癌组织的MVD、VEGF和Ang-2的表达,对CT灌注参数与癌组织的MVD、VEGF和Ang-2表达进行相关性分析。结果 结直肠癌中MVD与VEGF表达呈正相关(P<0.05)。直肠癌MSCT血流灌注参数与MVD、VEGF、Ang-2无明显相关性(P>0.05);在VEGF阴性组中,BV值显著高于阳性组(P <0.05)。结论 多层螺旋CT灌注成像与VEGF和Ang-2均能反映结直肠癌的血管生成状况,但它们之间无明显相关性。
结直肠癌;CT灌注成像;微血管密度;促血管生成素;血管内皮生长因子
直肠癌是我国常见的消化道肿瘤,死亡率居第二位。在肿瘤的发生、发展、侵袭和转移过程中,肿瘤新生血管起到了非常重要作用。促血管生成素(angiopoietin,Ang)-2与血管内皮生长因子 (vascular endethelial growth factor,VEGF)协同参与了肿瘤新生血管的调控[1]。MSCT灌注成像技术可用于间接评估肿瘤血供与血管生成情况[2]。本研究拟探讨结直肠癌CT灌注成像与MVD及VEGF、ANG-2之间的相关性。
1 资料与方法
1.1 一般资料 对2009年1月至2012年12月结直肠癌25例患者,其中男13例,女12例;年龄29~80岁,平均年龄59.76岁;术前行MSCT灌注成像,手术病理均为腺癌,肿瘤位于直肠20例,结肠5例;按TNM标准,T2期7例,T3期13例,T4期5例;高分化12例,中低分化13例。扫描和手术前所有患者未做过任何针对肿瘤治疗;无碘对比剂过敏;无严重的心、肺、肝、肾疾病。
1.2 扫描前准备 检查前清洁肠道,检查前1 h饮水充盈膀胱,扫描前10~15 min肌内注射盐酸山莨菪碱10 mg,上检查床后,经肛门注入温水600~800 ml,尽量使肠管扩张,患者有不适时即停止灌注。
1.3 扫描及后处理 采用GE Lightspeed 16层螺旋CT进行平扫,范围自脐水平至耻骨联合下缘,针对直肠肿瘤最大层面行灌注扫描,造影剂:非离子型碘对比剂(碘佛醇40 ml),高压注射器经肘前静脉注射,4 ml/s,注药开始延时10 s行灌注成像,采集4层,扫描间隔0.5 s。扫描完成后将数据传输到GE工作站,选取流入靶动脉及流出靶静脉.通过灌注软件计算出CT灌注图像。选择肿瘤强化最明显的层面作为感兴趣区(region of interest,ROI)。ROI选取尽量大范围,以减少量子噪声及部分容积效应。避开肿瘤的边缘区域以及肿瘤内部肉眼可见的坏死、液化、囊变及血管等,以避免部分容积效应的影响。ROI划定后软件自动生成靶动脉、肿瘤等各个ROI的TDC以及反映肿瘤血流灌注状态的灌注参数值 BF、BV、MTT、PS。所得图像均以彩色显示,以突出病变区域的对比,然后重复测量,取其平均值作为该病例灌注值,最后进行定量,半定量分析和数据统计分析。获取灌注参数数值及灌注图,包括:(1)灌注血容量(blood volume,BV):存在于一定量组织血管结构内的血容量(ml/100 g/min);(2)血流量(blood flow,BF):在单位时间内流经一定量组织血管结构的血流量(ml/100 g);(3)平均通过时间(mean transit time,MTT):指血液流经血管结构时(包括动脉、毛细血管、静脉窦和静脉)所经过的不同路径的平均时间,主要反映对比剂通过毛细血管的时间(s);(4)表面通透性(permeability surface area product,PS):指单位时间一定量组织血管内对比剂由毛细血管内皮扩散到细胞间隙的单向传输速率率(ml/100 g/min)。
1.4 病理学及免疫组织化学染色检查 免疫组织化学标本组织取材尽可能与CT单层动态扫描层面一致。经乙醛固定,常规石蜡包埋备用。染色步骤按SP试剂盒提供的说明书进行。采用免疫组织化学SP法检测对肿瘤组织测定MVD数量及VEGF、Ang-2的表达情况。以肿瘤组织内孤立的棕黄色血管内皮细胞或细胞簇代表一条单独的血管,在低倍镜下挑选微血管密度最高的区域,然后在400倍视野下计数10个视野中被CD34染成棕黄色的血管密度,取其中最大值的平均值作为MVD。VEGF与Ang-2染色按照标准[3]评分,A以着色细胞占视野细胞总数的多少评分。A为阳性细胞数分级,评分0~4级,无染色细胞=0,1%~10%细胞染色=1,11% ~50%细胞染色=2,51% ~80%细胞染色=3,81% ~100%细胞染色=4。B为阳性细胞显色强度,评分0~3级,阴性=0、弱阳性=1、阳性=2、强阳性=3。先在低倍镜下扫视整个切片,选择3个阳性细胞分布较密集的区域,换高倍镜再观察3个视野。IHS=A×B积分数=A×B。A×B=0为(-),A×B=1~4为(+),A ×B=5~8判断为(++),A×B=9~12判断为(+++)。为简化处理,以(-)(+)为阴性表达,(++)(+++)为阳性表达。
1.5 统计学分析 应用SPSS 13.0统计软件,正常对照组与直肠癌CT灌注之间采用t检验;直肠癌CT灌注参数与VEGF、Ang-2表达强度之间关系采用person相关性检验;MVD与 VEGF、Ang-2表达强度之间,VEGF与Ang-2表达强度之间强度分别做Spearman相关性分析。P<0.05为差异有统计学意义。
2 结果
2.1 直肠癌微血管密度与血管生成因子的关系 本组25例结、直肠癌中,VEGF染色阳性15例,阴性10例。ANG-2染色阳性10例,阴性15例。直肠癌MVD数量与VEGF表达呈正相关(r=0.568,P<0.05),且在VEGF阳性表达组中,MVD数目明显高于低表达组(P<0.05);但Ang-2与MVD无明显相关性(P>0.05),Ang-2阳性表达组中MVD与阴性表达组差异无统计学意义(P>0.05);VEGF与Ang-2表达强度不具有相关性(P>0.05),Ang-2略高于阴性组VEGF阳性组Ang-2高于阴性组,但差异无统计学意义(P >0.05)。见表1。
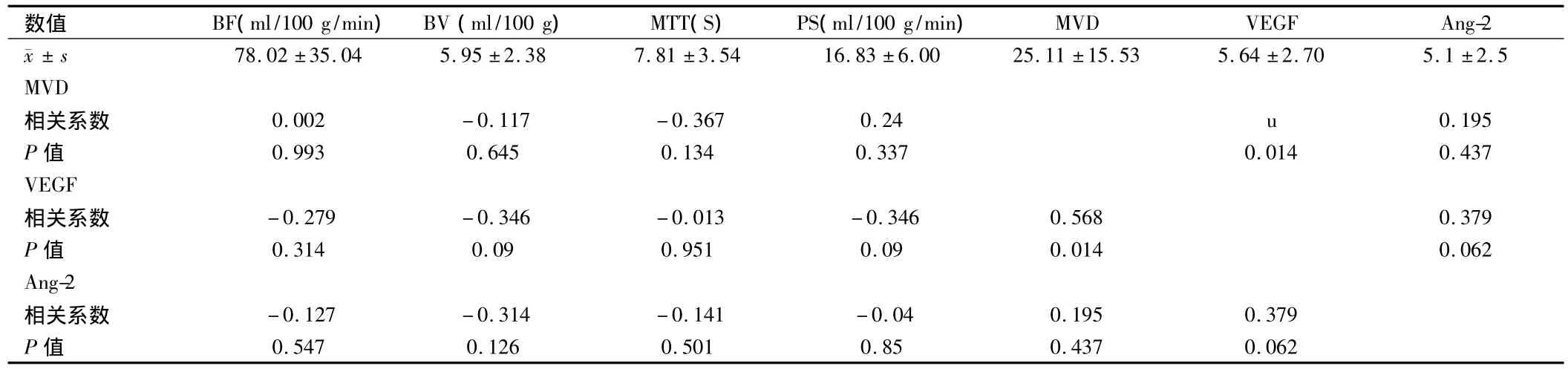
表1 MSCT血流灌注参数与MVD、Ang-2和VEGF之间相关性
2.2 直肠癌灌注参数与肿瘤血管生成的关系 直肠癌灌注参数与MVD、VEGF、Ang-2表达之间均不具有相关性(P>0.05),但VEGF阴性表达组BV值高于阳性表达组(P<0.05),余灌注参数在不同血管生成因子表达强度下差异无统计学意义(P>0.05)。见表2、3。
3 讨论
肿瘤的生长依赖血管生成,新生血管在肿瘤生长或转移过程中起重要作用。肿瘤新生血管的形成为肿瘤生长提供氧和营养物质,同时也为肿瘤细胞的扩散和转移提供了条件[4]。其中VEGF与 Ang是最主要的肿瘤血管生长调节因子[5]。在食管癌、胃癌、子宫内膜癌、肝癌等肿瘤组织中,Ang-2、VEGF表达均明显高于癌旁组织,认为其过度表达促进了肿瘤的血管生成和进展,在肿瘤的侵袭和转移中起到了重要作用。在结直肠癌组织中,Ang-2、VEGF的表达水平与肿瘤分期、浸润程度、淋巴结转移、远处转移、以及生存率密切相关。VEGF促进内皮细胞分化增殖,形成原始血管,是新生血管生成的主要因素[6],本研究结果亦示直肠癌 MVD与 VEGF呈正相关(r=0.568,P<0.05)。VEGF是肿瘤血管生成的主要调控者,在多种人类肿瘤中均过度表达[7]。Ang则促进血管成熟,维持血管稳定,并参与生理或病理情况下的血管新生。Ang主要包括Ang-1及Ang-2,其中Ang-2被认为是Ang-1的天然拮抗剂。Ang-2只在正常成人血管网重塑过程中表达,协助Ang-1维持血管稳定。在正常成人组织中,Ang-2仅表达于血管重建部位,其他正常成熟组织中无表达或仅有微弱表达,Ang-2表达增高被认为是肿瘤侵及血管的早期标志[8]其过度表达导致肿瘤血管生成,肿瘤生长加快[9]。肿瘤的血管生成主要取决于血管生成促进因子和抑制因子的严密调节,VEGF与Ang在血管的发育过程中发挥了互补与协调的作用。本研究中两种血管生成因子无明显相关性(P>0.05),虽然VEGF阳性组Ang-2表达高于阴性组,但差异无统计学意义(P>0.05),表明两种血管生成因子在血管生成中起不同作用,Ang-2与VEGF可不同时表达,但 VEGF能上调 Ang-2的表达,当VEGF存在时,Ang-2拮抗Ang-1有促血管结构稳定的作用,诱导内皮细胞分裂、移位,使新生血管生长;当VEGF缺乏时,Ang-2抑制 Ang-1则诱导血管发生退化,数目减少,内皮细胞发生凋亡[10]。
表2 不同表达强度ANG-2下直肠癌灌注参数、MVD、VEGF值±s

表2 不同表达强度ANG-2下直肠癌灌注参数、MVD、VEGF值±s
MVD VEGF阴性(n=15) 82.98±35.37 6.62±2.29 8.04±4.17 17.07±6.41表达情况 BF(ml/100 g/min) BV(ml/100 g) MTT PS(ml/100 g/min)25.67±14.26 5±2.70阳性(n=10) 70.57±35.00 4.96±2.27 7.47±2.47 16.48±5.63 28.4±17.81 6.6±2.59 t值0.865 1.779 0.388 0.236 -0.305 -1.475 t值0.397 0.088 0.702 0.815 0.77 0.154
表3 不同表达强度VEGF下直肠癌灌注参数、MVD、ANG-2值±s
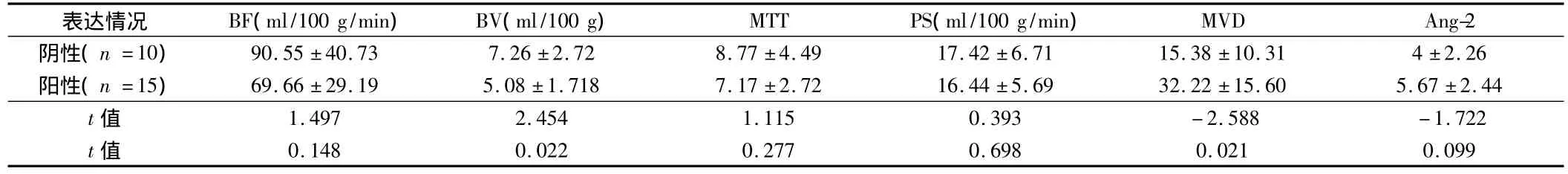
表3 不同表达强度VEGF下直肠癌灌注参数、MVD、ANG-2值±s
MVD Ang-2阴性(n=10) 90.55±40.73 7.26±2.72 8.77±4.49 17.42±6.71表达情况 BF(ml/100 g/min) BV(ml/100 g) MTT PS(ml/100 g/min)15.38±10.31 4±2.26阳性(n=15) 69.66±29.19 5.08±1.718 7.17±2.72 16.44±5.69 32.22±15.60 5.67±2.44 t值1.497 2.454 1.115 0.393 -2.588 -1.722 t值0.148 0.022 0.277 0.698 0.021 0.099
自Miles在1991年首次提出 CT灌注成像(CT perfusion imaging,CTPI)概念以来,CT技术也在飞速发展,目前多层螺旋 CT灌注成像技术现已成为肿瘤诊断及治疗学研究等的热点。CT灌注成像技术被认为可以反应活体肿瘤微血管状况,有学者研究发现直肠肿瘤 BF值 (60.33±29.13)明显高于正常组织(31.02±15.55),而平均通过时间 MTT值(9.51±4.43)却较正常直肠组织(16.98±4.27)明显缩短,认为CT灌注成像能够有效区分肿瘤与正常直肠组织[11]。与 本 组 结 果 BF(78.02 ± 35.04)、MTT(7.81±3.54)相近。也有报道认为直肠癌BF值能够有效评价肿瘤分期及预后[12]。肿瘤CT灌注本质便是研究肿瘤的血流特点,血管成因子是肿瘤新生血管的主要因素[13]。本组研究结果认为直肠癌灌注参数与血管内皮生长因子无明显相关性,与国内外研究结论相同[14,15]。直肠癌灌注参数与 Ang-2之间相关性研究,国内外尚未见报道,本研究示两者亦无明显相关性。提示CT灌注与血管因子反应的是肿瘤血管生成的不同方面。本研究结果示灌注参数与MVD、VEGF均无相关性。但在VEGF阴性表达组中,BV值显著高于阳性组(P<0.05)。本研究结果示VEGF低表达时直肠癌血容量高于高表达组。VEGF表达增高,MVD增高,灌注量反而降低,提示灌注量与MVD之间存在不一致性。彭李青等[16,17]研究认为肿瘤生长方式、组织区压力增高等均可导致血流灌注减低,血流灌注减低又反过来加重组织缺血缺氧。缺血缺氧均是导致VEGF高表达的原因[18]。反复加重的缺血缺氧导致VEGF高表达,VEGF高表达致使微血管增生,间质压力亦随之增高,灌注量却并未增加甚至反而降低,因此BV值降低。并且肿瘤可建立动静脉短路,血流不通过毛细血管;肿瘤的新生血管结构不完整,而灌注反应的是腔化有功能血管血流量[19]。
综上所述,本研究示结直肠癌的灌注参数与VEGF、Ang-2因子均可以反应直肠癌肿瘤血管生成,但两者之间无明显相关性。MVD、VEGF、Ang-2只从手术切除标本上测得,且是一种有创性、不可重复性的检查,计数结果受所使用的标记物、视野的大小的影响。因此临床迫切需要一种能在术前可靠评估肿瘤血管生成的检查方法,CT灌注成像即可以在活体情况下评价肿瘤动态血运状况,又可以反映大体形态变化,综合评价肿瘤情况。因此CT灌注成像技术评价直肠癌微循环状况具有潜在优势,作为一种前瞻、可重复的检查方式,CT灌注可以很好的反应活体直肠癌微血管情况,但灌注参数对血管生成因子的评价和意义尚有待进一步研究。
1 何立丽,张伟京.Ang-2与VEGF的协同作用及其在抗肿瘤血管新生治疗中的应用.中国实验血液学杂志,2007,15:445-448.
2 韩帅,李彩英.直肠癌多层螺旋CT灌注及相关灌注参数的初步研究.放射学实践,2009,24:678-681.
3 Soslow RA,Dannenberg AJ,Rush D,et al.Cox-2 is expressed in human pulmonary,colonic,and mammary tumors.Cancer,2000,89:2637-2645.
4 孙灿辉,李子平.结直肠癌64层螺旋CT灌注成像参数测定的可重复性研究.中国医学影像技术,2007,23:1053-1055.
5 Bellomi M,Petralia G.CT Perfusion for the monitoring of neoadjuvant chemotherapy and radiation therapyin rectal carcinoma:initial experience.Radiology,2007,244:486-493.
6 Hayano K,Shuto K.Quantitative measurement of blood flow using perfusion CT for assessing clinicopathologic features and prognosis in patients with rectal cancer.Dis Colon Rectum,2009,52:1624-1629.
7 Sahani DV,Kalva SP.Assessing tumor perfusion and treatment response in rectal cancer with multisection CT:initial observations.Radiology,2005,234:785-792.
8 刘于宝,梁长虹.多层螺旋CT灌注成像评价直肠癌放化疗疗效的研究.医学影像学杂志,2006,16:254-257.
9 冯仕庭,孙灿辉.结直肠癌64层螺旋CT灌注成像与微血管密度及血管内皮生长因子的相关性.中华胃肠外科杂志,2008,11:537-541.
10 冯仕庭,孙灿辉.64排螺旋CT多层灌注成像对结直肠癌的临床应用.中华胃肠外科杂志,2010,13:137-140.
11 孙灿辉,孟悛非.结直肠癌螺旋CT灌注成像的初步研究.临床放射学杂志,2005,24:506-510.
12 Folkman J.What Is the Evidence That Tumors Are Angiogenesis Dependent.Natl Cancer Inst,1990,82:4-6.
13 Hlatky L,Hahnfeldt P,Folkman J.Clinical application of antiangiogenic therapy:microvessel density,what it does and doesn’t tell us.Natl Cancer Inst,2002,19:883-893.
14 刘浩,程华.结直肠癌中TF和VEGF表达的相关性及其意义.江西医学院学报,2009,49:111-114.
15 Oh H,Takagi H,Suzuma K,et al.Hypoxia and vascular endothelial growth factor selectively up-regulate angiopoietin-2 in bovine microvascular endothelial cells.J Biol Chem,1999,28,274:15732-15739.
16 彭李青,黄菊花.结直肠癌螺旋CT灌注成像与肿瘤血管生成的相关性.中国医学影像技术,2006,22:1051-1054.
17 Han J,Xia C,Gao J,et al.Expression of Vascular Endothelial Growth Factorin Colorectal Cancer andits Clinical Significance.Zhong hua Yi Xue Za Zhi,2002,82:481-483.
18 Goh V,Halligan S,Daley F,et al.Colorectal tumor vascularity:quantitative assessment with multidetector CT--do tumor perfusion measurements reflect angiogenesis.Radiology,2008,249:510-517.
19 Ahmad SA,Liu W,Jung YD,et al.The effects of angiopoietin-1and 2 on tumor growth and angiogenesisin human colon cancer.Cancer Res,2001,61:1255-1259.
R 735.37
A
1002-7386(2015)23-3607-04
10.3969/j.issn.1002-7386.2015.23.030
050000 石家庄市,河北医科大学第二医院影像科
李彩英,050000 石家庄市,河北医科大学第二医院;E-mail:licaiying63@163.com
2015-04-17)
