经皮肝穿刺置入胆管支架对胃癌术后复发致胆管梗阻的治疗价值*
2015-03-10姜中华范志宁蒋莉莉王成虎沈伟明李必瑾汪晓红
姜中华 管 敬 范志宁** 蒋莉莉 王成虎 沈伟明 李必瑾 汪晓红
(盐城市第一人民医院消化内镜中心,盐城 224401)
·临床论著·
经皮肝穿刺置入胆管支架对胃癌术后复发致胆管梗阻的治疗价值*
姜中华 管 敬①范志宁①**蒋莉莉 王成虎 沈伟明 李必瑾 汪晓红②
(盐城市第一人民医院消化内镜中心,盐城 224401)
目的 探讨经皮肝穿刺胆管支架置入术(percutaneous transhepatic biliary stent, PTBS)治疗胃癌术后复发致梗阻性黄疸的疗效,分析影响支架通畅时间的危险因素。 方法 2008年1月~2013年12月对31例胃癌术后复发致胆道梗阻行PTBS,观察手术成功率、临床症状缓解率、并发症发生情况、支架通畅时间和患者生存时间,分析影响支架通畅时间的危险因素。 结果 31例成功行PTBS,27例(87.1%)临床症状缓解,术前总胆红素(150.5±59.8) μmol/L,术后1周下降至(61.8±32.4) μmol/L(t=14.440,P=0.000)。支架中位通畅时间250.9 d(95%CI:205.5~296.4 d),中位生存时间251.9 d(95%CI:222.6~281.2 d),12例(44.4%)支架堵塞,未发生其他严重并发症。支架置入术后1周血清总胆红素水平(β=-1.746,95%CI:0.038~0.808,P=0.026)、术后是否化疗(β=-1.692,95%CI:0.039~0.870,P=0.033)是支架通畅时间的影响因素。 结论 对于胃癌术后复发致胆管恶性梗阻行PTBS安全有效,支架置入术后血清总胆红素水平下降、术后化疗是支架通畅时间的保护因素。
支架; 恶性胆道梗阻; 胃癌; 经皮肝穿刺胆管支架置入术
晚期胃癌转移伴梗阻性黄疸的发生率为1.3%~2.3%[1,2],预后差,治疗方式主要为化疗,因化疗药物有明显肝损害毒副反应,且黄疸是应用化疗药物的禁忌证[3],行胆管引流不仅可以减轻黄疸症状,预防并发症的同时改善患者全身情况为尽早行化疗创造条件。胰腺癌、肝癌等肿瘤引起的梗阻性黄疸主要以经皮肝穿刺或内镜引导下置入自膨式金属支架来缓解梗阻症状[4,5]。因胃癌术后患者胃肠道结构改变行ERCP困难,目前主要行经皮肝穿刺胆管引流。本研究回顾性分析2008年1月~2013年12月31例(盐城市第一人民医院13例,南京医科大学第二附属医院18例)因胃癌术后复发致胆管梗阻行经皮肝穿刺胆管支架引流(percutaneous transhepatic biliary stent,PTBS)的临床资料,旨在探讨PTBS治疗胃癌术后复发致梗阻性黄疸的疗效和影响支架通畅时间的危险因素。
1 临床资料与方法
1.1 一般资料
本组31例,男17例,女14例。年龄(62.1±11.3)岁。17例行胃大部切除+Billroth Ⅱ,14例行全胃切除+Roux-en-Y。根据胃癌TNM分期(AJCC第7版)标准,Ⅲ期16例,Ⅳ期15例。胃癌术后至黄疸时间(25.4±15.8)月。支架置入术前CT均提示胆管扩张,胆总管直径10.0~20.5 mm,平均12.4 mm;肝十二指肠韧带、胰后淋巴结肿大,13例伴肝微小结节转移,无腹水及其他脏器转移。支架置入术前经CT和MRCP检查31例均为肝门部胆管狭窄(Bismuth分型:Ⅰ型8例,Ⅱ型6例,Ⅲa 5例,Ⅲb 4例,Ⅳ型8例)。术前血总胆红素(148.7±58.3)μmol/L,直接胆红素(124.3±53.4)μmol/L。
病例选择标准:有胃癌手术病史,术后黄疸,经CT、 MRCP、血清胆红素水平和(或)胆管造影等诊断为胆管狭窄。除外因输入襻综合征致梗阻性黄疸、广泛肝转移致肝功能衰竭引起黄疸者。
1.2 方法1.2.1 仪器和设备 1000 mA DSA机(西门子公司),21G千叶针、PTBD套管针、扩张球囊QD-16×8,QID球囊加压器(Wilso-Cook公司),直径8~10 mm自膨式钛镍合金支架(南京微创公司和美国COOK公司)。
1.2.2 手术方法 就诊后1周内行PTBS。超声定位穿刺点(右腋中线8~10肋间),拔出针芯插入微导丝置入穿刺套管针,沿导丝置入F4~F8导管后退出微导丝,以扩张导管和斑马导丝结合反复试插通过狭窄段,造影了解狭窄的长度选择合适的支架,换入超硬导丝送入支架推送器,于梗阻部位放置支架。术后常规置外引流管,1周后造影显示支架通畅即可拔除引流管。单纯胆总管梗阻、肝门部左或右肝管梗阻采用单支架置入,肝门部左、右肝管同时梗阻放置双边支架。术后予以抗生素预防感染。
1.3 观察指标
手术成功:经外引流管造影放射性透视示支架横跨于狭窄段。临床缓解[6]:黄疸症状好转,即总胆红素<85.5 μmol/L(或)和2周内下降>1/2术前值。支架堵塞:再发明显黄疸或血清总胆红素水平高于支架置入前水平,同时经CT、MRCP等影像学检查排除肝内肿瘤广泛转移致肝衰竭和其他胆道部位狭窄。支架通畅时间:支架置入始至支架堵塞止,如果病人死亡前支架未堵塞则为截尾数据。
1.4 统计学处理
2 结果
2.1 一般情况
31例支架置入成功,共置入支架39个,23例置入单支架,8例置入双支架,支架直径F7~F8.5,长度8~12 cm。27例临床缓解,临床缓解率87.1%(27/31),4例术后夹闭外引流管试拔管时因黄疸症状加重故一直保留外引流管,此4例不纳入随访研究、支架通畅时间及危险因素分析。在临床症状缓解的27例中,10例(37.0%)术后行化疗,17例因患者意愿、病情恶化、全身情况差等原因未行化疗。
2.2 并发症和疗效
中位随访时间257 d(146~412 d)。3例(11.1%)发生近期(术后≤2周)并发症:2例术后引流管周围胆汁渗出,局部消毒拔除引流管后好转;1例发生直径约1.5 cm肝小脓肿,加强抗生素治疗好转。远期(术后>2周)并发症:12例(44.4%)支架堵塞,其中9例行经皮肝胆管引流(percutaneous transhepaticcholangial drainage,PTCD),3例再次行PTBS,所有患者至死亡未再出现支架堵塞。
纳入随访的27例术后1周血总胆红素(61.8±32.4)μmol/L,较术前(150.5±59.8)μmol/L明显降低(t=14.440,P=0.000)。中位支架通畅时间250.9 d(95%CI:205.5~296.4 d)(图1),中位生存时间251.9 d(95%CI:222.6~281.2 d)(图2)。所有病人死亡原因非胆道梗阻直接导致。
2.3 影响支架通畅的危险因素分析
单因素分析:将临床症状缓解的27例的年龄、性别、胃癌根治术方式、胃癌根治术时有无淋巴结转移等因素进行单因素分析,结果显示:PTBS术前肿瘤分期、支架置入术后有无化疗、术后1周血总胆红素值有统计学差异(表1)。将上述3个因素进行COX模型多因素分析,结果显示:支架置入术后化疗、术后1周血总胆红素水平下降是支架通畅时间的保护因素(表2)。
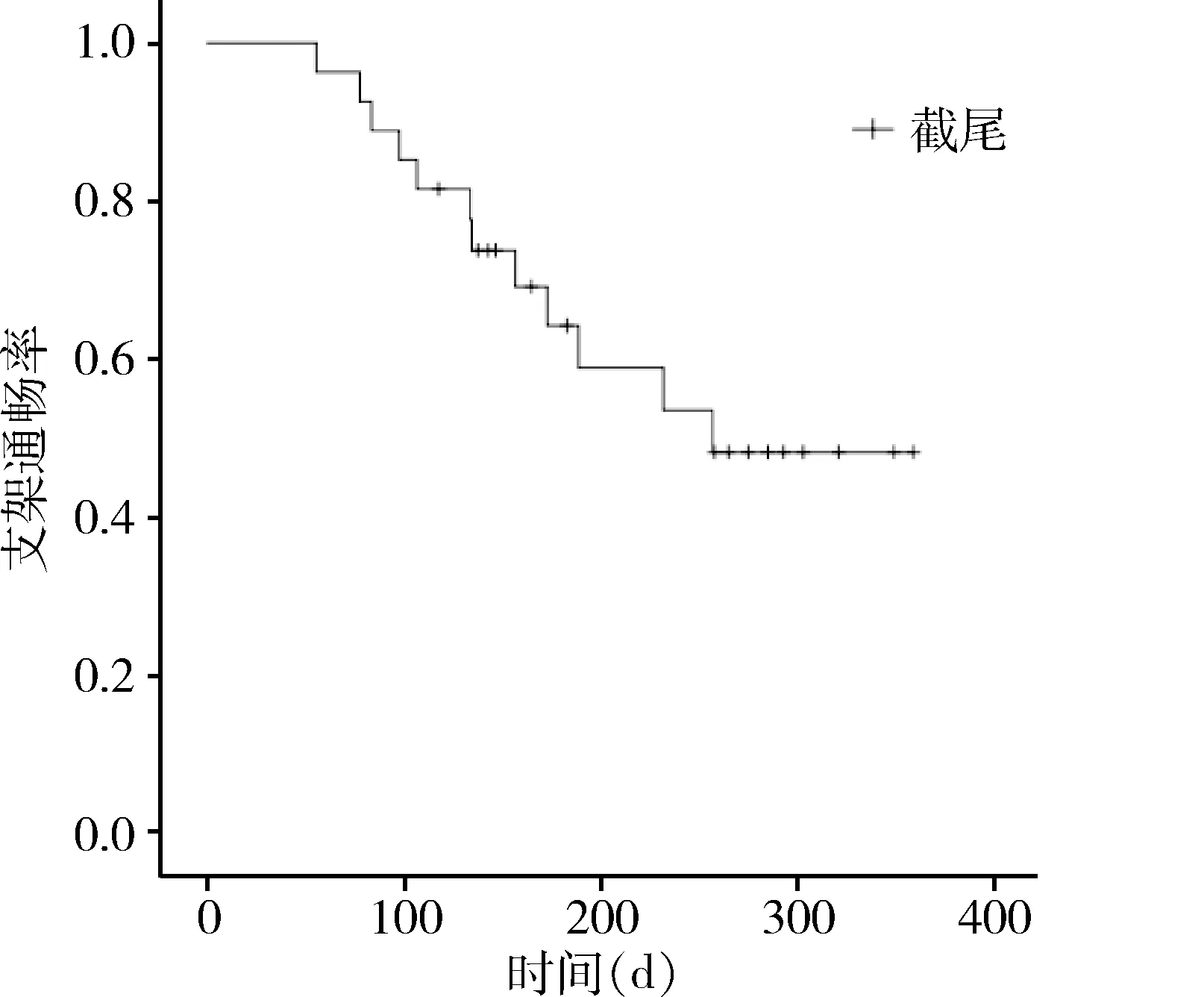
图1 支架通畅时间曲线

图2 生存时间曲线
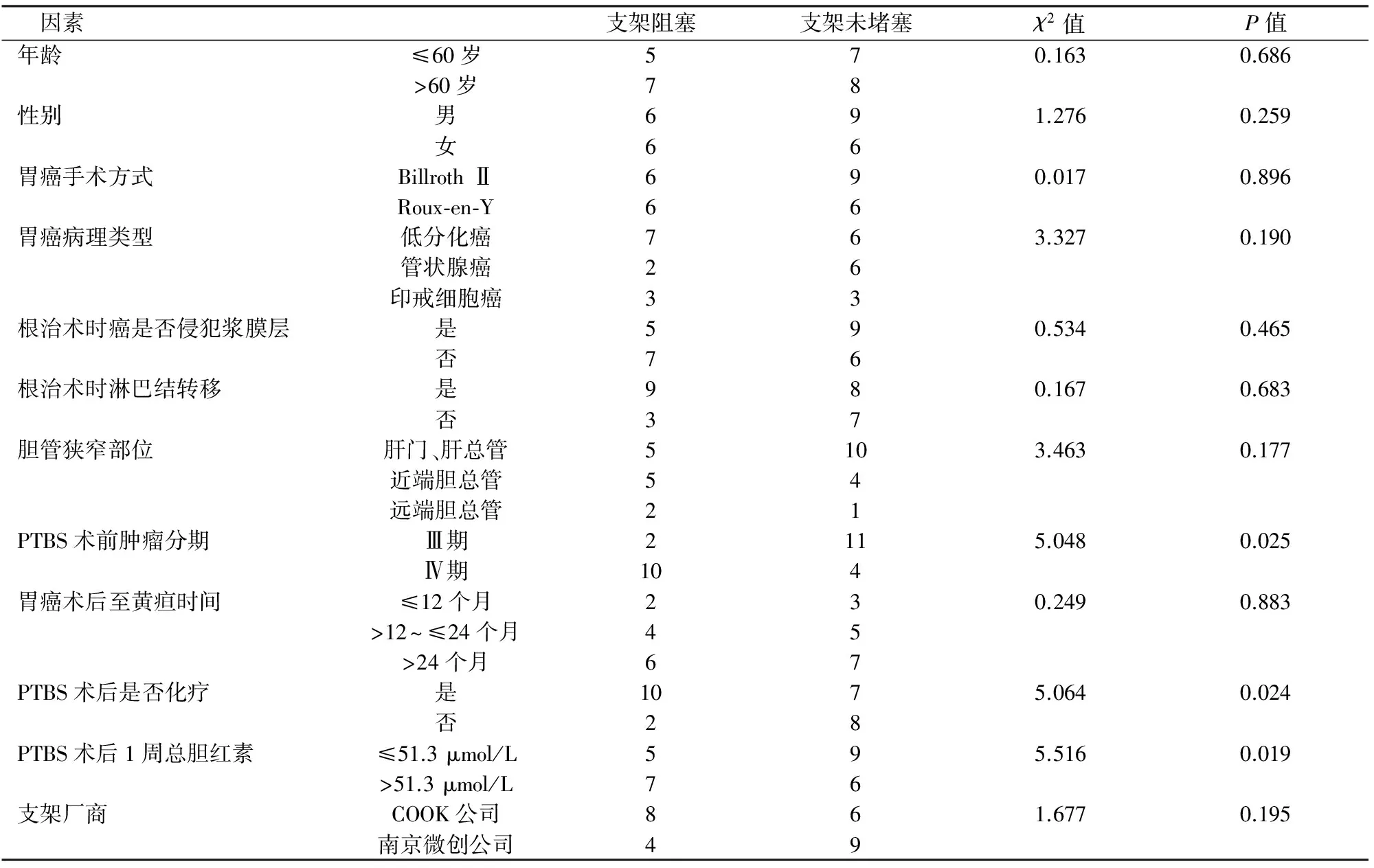
表1 影响胆管支架通畅时间单因素

表2 影响胆管支架通畅时间COX模型多因素分析
3 讨论
胆管恶性梗阻主要引流方式包括胆肠吻合术、内镜引导、超声引导或PTBS等胆管引流方法。对于胃癌复发致胆管梗阻手术不是最佳选择,因为转移的淋巴结多在肝门附近,肝门受肿瘤侵犯后手术风险大,有较高的致残率、病死率[7,8]。对有胃癌手术史的患者行乳头插管非常困难,有较高的失败率、并发症发生率[9],此类患者ERCP引导行胆管引流也不是首选。多数研究采用经皮肝穿刺胆管外引流方法,尽管外引流能明显改善症状,但容易发生引流管脱落、胆漏、水电解质失衡等并发症[10, 11]。PTBS和外引流相比,符合生理特点且能有效避免上述并发症。目前,关于胆胰肿瘤致胆管梗阻行PTBS报道很多,但是对于胃癌术后复发致胆管梗阻行PTBS随访研究和支架通畅时间的影响因素研究很少。
本研究中临床症状缓解率87.1%(27/31),手术成功率100%(31/31),与Migita等[12, 13]报道的结果类似,进一步说明对于胃癌术后复发致胆管梗阻行PTBS引流安全、有效。Gwon等[14]分析54例胃癌转移致胆管梗阻行PTBS,未发现影响支架通畅时间独立危险因素,本研究结果显示支架置入术后血总胆红素水平、术后化疗为影响支架通畅时间的因素。与前报道不同的原因可能是本研究纳入者均有胃癌根治术病史,而Gwon等[14]纳入标准包括未行胃癌根治术患者。Hong等[15]分析50例胃癌术后复发致胆管梗阻者行PTBS,术后血清总胆红素水平是影响支架通畅时间独立因素,与本研究结果一致。
晚期胃癌治疗主要为静脉注射或口服化疗药物等方式,完整的胆管系统是化疗药物代谢排泄器官,所以符合生理特点的胆管引流方式非常重要,同时PTBS可以缓解黄疸症状,为患者接受针对原发肿瘤的治疗赢得时机。本组10例(10/27,37.0%)黄疸症状改善后化疗,未发生与化疗相关严重并发症,多项研究也表明化疗可以明显延长支架通畅时间和患者生存时间[1,14]。本研究COX回归模型多因素分析显示PTBS术后化疗是支架通畅时间的保护因素。
本研究早期并发症发生率11.1%(3/27),胆管支架堵塞发生率44.4%(12/27),高于文献[2, 16, 17]报道并发症发生率7%~30%,可能与样本例数较少有关。本组中位支架通畅时间250.9 d(95%CI:205.5~296.4 d),中位生存时间251.9 d(95%CI:222.6~281.2 d),长于文献[17, 18]报道的中位支架通畅时间(57~201 d),我们考虑有以下原因:①10例支架植入术后行化疗,化疗能延长支架通畅时间和患者生存时间;②本研究胆管堵塞原因主要为淋巴结转移肿大压迫肝总管、近端胆总管,由淋巴结外压所致狭窄对支架治疗效果相对较好;③与前期研究相比,肿瘤原发部位不同、病理类型不同、发展阶段不同可能是研究结果不同主要原因,所以需要大样本研究来分析影响支架通畅时间和患者生存时间的独立危险因素。
综上,胃癌术后复发致梗阻性黄疸行PTBS安全、有效,术后下降的血清总胆红素水平、术后化疗是延长支架通畅时间的保护因素,但胆道引流没有解除胆道梗阻的根本病因,所以待患者全身情况改善后尽早行局部或全身放化疗来延缓肿瘤生长。
1 Makino T, Fujitani K, Tsujinaka T, et al. Role of percutaneous transhepatic biliary drainage in patients with obstructive jaundice caused by local recurrence of gastric cancer. Hepatogastroenterology, 2008,55(81):54-57.
2 Migita K, Watanabe A, Yoshioka T, et al. Clinical outcome of malignant biliary obstruction caused by metastatic gastric cancer. World J Surg, 2009,33(11):2396-2402.
3 Chu KM, Law S, Branicki FJ, et al. Extrahepatic biliary obstruction by metastatic gastric carcinoma. J Clin Gastroenterol, 1998,27(1):63-66.
4 Ho CS, Warkentin AE. Evidence-based decompression in malignant biliary obstruction. Korean J Radiol, 2012,13 (Suppl 1):S56-S61.
5 勾承月,秦鸣放,王 庆,等.胆道支架介入治疗恶性胆道梗阻136例临床分析.中国微创外科杂志, 2010,10(5):412-414.
6 Hong HP, Kim SK, Seo TS. Percutaneous metallic stents in patients with obstructive jaundice due to hepatocellular carcinoma. J Vasc Interv Radiol, 2008,19(5):748-754.
7 Lopera JE, Brazzini A, Gonzales A, et al. Gastroduodenal stent placement: current status. Radiographics, 2004,24(6):1561-1573.
8 朱安东, 陈德兴, 周金铭. 腹腔镜下胆总管空肠Roux-en-Y吻合术在胆系手术中的应用. 中国微创外科杂志, 2010,10(2):120-122.
9 Swarnkar K, Stamatakis JD, Young WT. Diagnostic and therapeutic endoscopic retrograde cholangiopancreaticography after Billroth Ⅱ gastrectomy-safe provision in a district general hospital. Ann R Coll Surg Engl, 2005,87(4):274-276.
10 Seif HM, Zidan M, Helmy A. One-stage percutaneous triple procedure for treatment of endoscopically unmanageable patients with malignant biliary obstruction and marked ascites. Arab J Gastroenterol, 2013,14(4):148-153.
11 Krokidis M, Hatzidakis A. Percutaneous minimally invasive treatment of malignant biliary strictures: current status. Cardiovasc Intervent Radiol, 2014,37(2):316-323.
12 Migita K, Watanabe A, Yoshioka T, et al. Clinical outcome of malignant biliary obstruction caused by metastatic gastric cancer. World J Surg, 2009,33(11):2396-2402.
13 Lawson AJ, Beningfield SJ, Krige JE, et al. Percutaneous transhepatic self-expanding metal stents for palliation of malignant biliary obstruction. S Afr J Surg, 2012,50(3):54, 56, 58.
14 Gwon DI, Ko GY, Sung KB, et al. Clinical outcomes after percutaneous biliary interventions in patients with malignant biliary obstruction caused by metastatic gastric cancer. Acta Radiol, 2012,53(4):422-429.
15 Hong HP, Seo TS, Cha IH, et al. Percutaneous placement of self-expandable metallic stents in patients with obstructive jaundice secondary to metastatic gastric cancer after gastrectomy. Korean J Radiol, 2013,14(5):789-796.
16 Kida M, Miyazawa S, Iwai T, et al. Recent advances of biliary stent management. Korean J Radiol, 2012,13 (Suppl 1):S62-S66.
17 van Delden OM, Lameris JS. Percutaneous drainage and stenting for palliation of malignant bile duct obstruction. Eur Radiol, 2008,18(3):448-456.
18 Fujita T, Tanabe M, Takahashi S, et al. Percutaneous transhepatic hybrid biliary endoprostheses using both plastic and metallic stents for palliative treatment of malignant common bile duct obstruction. Eur J Cancer Care (Engl), 2013,22(6):782-788.
(修回日期:2014-10-23)
(责任编辑:李贺琼)
Value of Percutaneous Transhepatic Insertion of Biliary Stents in Patients with Obstructive Jaundice Secondary to Metastatic Gastric Cancer After Gastrectomy
JiangZhonghua*,GuanJing,FanZhining,etal.
*DepartmentofDigestiveEndoscopyCenter,FirstPeople’sHospitalofYancheng,Yancheng224401,China
Correspondingauthor:FanZhining,E-mail:fanzhining@hotmail.com
Objective To evaluate the curative effects of percutaneous transhepatic biliary stenting (PTBS) for obstructive jaundice secondary to metastatic gastric carcinoma after gastrectomy and analyze risk factors for stent patency time. Methods A total of 31 patients who underwent PTBS for obstructive jaundice secondary to metastatic gastric cancer after gastrectomy were recruited. The technical and clinical success rates, complications, stent patency, overall survival, and factors associated with stent patency were evaluated. Results Technical success was achieved in all the patients, with a clinical symptom relief rate of 87.1% (27/31). The mean total bilirubin levels decreased from (150.5±59.8) μmol/L before PTBS to (61.8±32.4) μmol/L at first week after stent insertion (t=14.440,P=0.000). The median stent patency time was 250.9 d (95%CI: 205.5-296.4 d), while the median survival time was 251.9 d (95%CI: 222.6-281.2 d). The obstruction rate of stent was 44.4% (12/27), and there were no other serious complications. The total serum bilirubin levels (β=-1.746, 95%CI: 0.038-0.808,P=0.026) and chemotherapy after stenting (β=-1.692, 95%CI: 0.039-0.870,P=0.033) were predictors for stent patency. Conclusions PTBS is an effective and safe method for obstructive jaundice secondary to metastatic gastric cancer after gastrectomy. The declined serum total bilirubin level and chemotherapy after stenting are protective factors for patency.
Stent; Malignant biliary obstruction; Gastric carcinoma; Percutaneous transhepatic insertion of biliary stenting
高等学校博士学科点专项科研基金(项目编号:20123234110003)
R657.4
A
1009-6604(2015)05-0410-04
10.3969/j.issn.1009-6604.2015.05.008
2014-05-23)
** 通讯作者,E-mail:fanzhining@hotmail.com
① (南京医科大学第二附属医院消化医学中心,南京 210029)
② (徐州矿务集团总医院消化内镜中心,徐州 221006)
