不同中式烹饪热加工方式对鲜食及加工紫薯花色苷含量影响分析
2015-03-09齐敏玉李书艺何静仁
齐敏玉,郭 莹,李书艺,何静仁
(武汉轻工大学食品科学与工程学院,武汉 430023)
紫薯又称紫甘薯,既可鲜食食用,也可作为原料加工成多种面制品,其块根肉质呈紫红色,除常见营养物质外,同时还富含花色甘类物质,其中以酰化的芍药素、矢车菊素为主[1,2]。紫薯花色苷具有良好的保健功效,如抗氧化[3,4]、抗癌[5]等。由《中国居民膳食指南》可知,谷类薯类及杂豆的推荐摄入量为250~400 g/d;美国居民花色苷日摄入量为12.5 mg/d[6]。因此,鲜紫薯作为一种绿色保健食物不仅可以满足人们谷物类日常摄入量,还可满足花色苷的日常摄入需求达到保健的效果。然而,在日常膳食中,紫薯通常经过油炸、蒸、煮等多种加工处理后食用,在此过程中,花色苷出现了不同程度的损失,降低了鲜紫薯本身的营养价值。本文研究不同中式烹饪热加工方式对紫薯花色苷含量的影响,可有效地为紫薯膳食营养提供科学依据。
近年来有不少专家学者对不同加工方法引起新鲜原料营养成分流失情况进行了研究,如王璐[7]等研究了不同烹调方式对蔬菜植物化学物及维生素C 的影响;郎静[8]等探讨了不同烹调方式对食物中花色苷稳定性的影响;陈蔚辉[9]等研究了不同烹饪方法对番薯营养成分的影响。然而,关于紫薯花色苷在不同中式烹饪热加工条件下的含量变化则报导较少。本文设计了低温油炸、蒸、煮、微波、烤等5 种家庭常见的加工方法对紫薯花色苷含量的影响,选出紫薯较为健康的家庭食用方式,为探讨我国居民花色苷食用方法与健康效应的研究奠定基础。同时采用HPLC-PDA-ESI-MSn探讨鲜食/加工紫薯花色苷的结构及差异性,为紫薯花色苷日后的差异性评价及营养研究奠定基础。
1 材料与方法
1.1 样品、试剂与设备
紫薯原料:美国黑薯(湖北郧府薯业有限公司提供,其公司生产紫薯全粉的原料);鲜食紫薯:云南紫薯(本地超市购入);盐酸、乙醇、氯化钾、醋酸、醋酸钠等(分析纯,国药集团);乙腈、甲酸等(色谱纯,美国TEDIA)。
pH1.0 缓冲液(HCl-KCl,取0.2mol/L KCl 溶液25mL、0.2mol/L HCl 溶液67mL 定容至100mL);pH4.5缓冲液 (CH3COOH-CH3COONa,取CH3COONa 1.8g、CH3COOH 0.98mL 定容至100mL)。
超高效液相色谱—质谱联用仪(ACCELA LTQ-XL,美国Thermo Fisher 公司);紫外可见分光光度计(Evolution 220,美国Thermo Fisher 公司);旋转蒸发器(Hei-VAP Advantage,德国Heidolph 公司);电烤箱(MG38MD-ADRF,美的公司);微波炉(MF-2480MGS(N),海尔公司)。
1.2 样品处理
美国黒薯与云南紫薯分别洗去表面泥沙,取可食部分,切成大小近似块儿状,每10g (m2)为1 份,6 份为1 组,其中1 份不做加工处理为对照样品,其它5 份分别用5 种中式烹饪热加工方式进行处理,平行做3 组。低温油炸:取1 份样品于低温真空油炸装置中98℃下油炸15min;微波:取1 份样品于微波炉中微波1 min,功率为1 000W;蒸:取1 份样品置于蒸锅中篦子中央利用水蒸气加热蒸15 min;煮:取1 份样品置于锅中加适量的水煮15 min;烤:取1 份样品置与烤箱中央280℃条件下烤制15 min。为避免样品冻存/磨粉导致结构/含量上的变化,加工完成后,取出样品冷却至室温称重(m3),马上进行总花色苷含量测定及损失率计算。
1.3 分析方法与结果计算
1.3.1 紫薯花色苷的提取、含量测定及结构鉴定
每份样品加入(1∶20,m∶v)60%乙醇—盐酸溶液(pH=3),60℃水浴下提取120min,4 000 r/min 离心20 min,收集上清液。重复2 次,合并上清液,于37℃条件下旋转蒸发并定容。定容后的物质分别用pH1.0 缓冲液、pH4.5 缓冲液稀释,在510nm 和700nm 处测得吸光度差值,利用公式(1)[10,11]计算总花色苷含量,并用公式(2)计算紫薯花色苷在不同中式烹饪热加工条件下的损失率。
分别取适量相同浓度下美国黒薯与云南紫薯的花色苷提取液(pH=3),测定可见区最大吸收波长(300~700 nm 下紫外可见全扫描)。
分别取适量相同浓度下美国黒薯与云南紫薯的花色苷提取液(pH=3),采用高效液相色谱—二极管阵列检测器—电喷雾电离—质谱联用技术(HPLC-PDA-ESIMSn)进行紫薯花色苷结构分析。使用Thermo Fisher 反相C18色谱柱(1.9 μm,100 ×2.1 mm),在25 ℃柱温、10 μL 进样量、270℃毛细管温度、26V 毛细管电压、20 L/minN2流速、100~2 000 (m/z)正离子扫描范围条件下进行液质分析,液相检测波长由全扫描结果确定,液相流动相配比及洗脱梯度见附表。
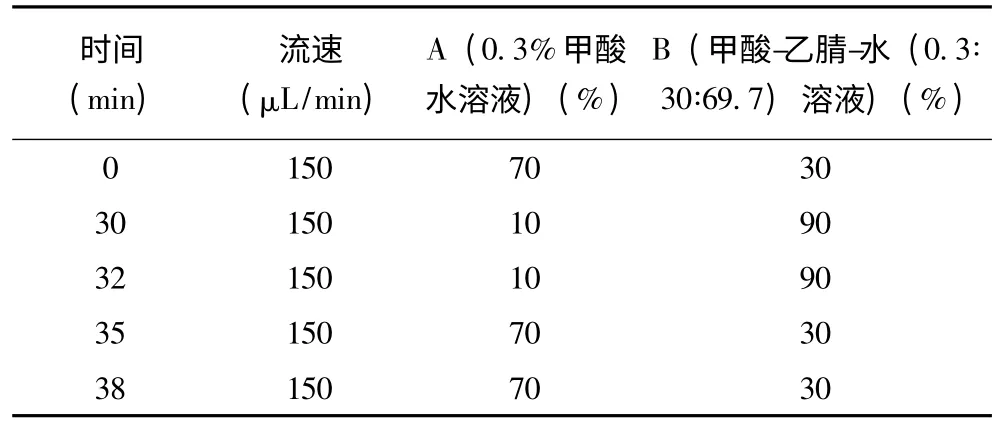
附表 液相检测条件
1.3.2 计算分析
分别计算原料与不同中式烹饪热加工后的紫薯总花色苷含量,结果以mg/100 g 鲜重表示,采用Origin 软件作图分析。以加工物质含量折算到新鲜物质含量的变化率,即损失率,来反映紫薯花色苷在不同热加工条件下的营养损失状况。计算公式如(1)式:
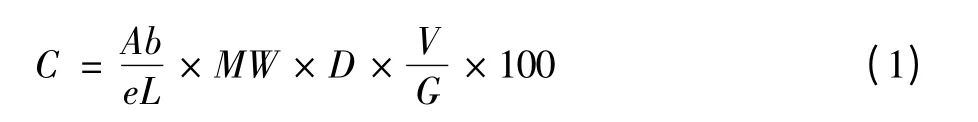
(1)式中:C-总花色苷含量(mg/100g);Ab=(A510nm- A700nm)pH1.0- (A510nm- A700nm)pH4.5;e-cy-3-glu(矢车菊-3-葡萄糖苷)的摩尔消光系数(26900);L—比色皿宽度(1cm);MW-cy-3-glu (矢车菊-3-葡萄糖苷)的相对分子品质(449.2);D—稀释倍数;V—提取液体积(mL);G—样品质量(g)。
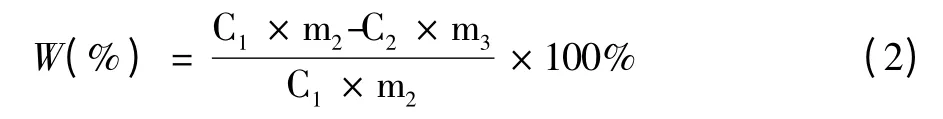
(2)式中:W—损失率;m2—加工物料加工前质量(g);m3—加工物料加工后质量(g);C1—新鲜物料中总花色苷含量(mg/100g);C2—加工物料加工后总花色苷含量(mg/100g)。
2 结果与分析
2.1 紫薯花色苷的紫外可见全扫光谱特征
美国黒薯与云南紫薯的全扫描图谱见图1,二者在330nm 和526nm 处均有最大吸收峰。其中526nm 处的吸收峰,其吸收峰宽,是典型的花色苷类物质可见区的最大吸收峰,说明该色素提取液中主要含花色苷类色素。此外,光谱图还在330 nm 附近有强吸收,330nm 处为有机酸的吸收峰,因此可判断该物质中含有机酸酰基化结构。由光谱图可大致得出紫薯色素中的花色苷可能为复杂的非酰化与酰化花色苷的混合物。具体结构将通过HPLC-PDA-ESI-MSn探讨。
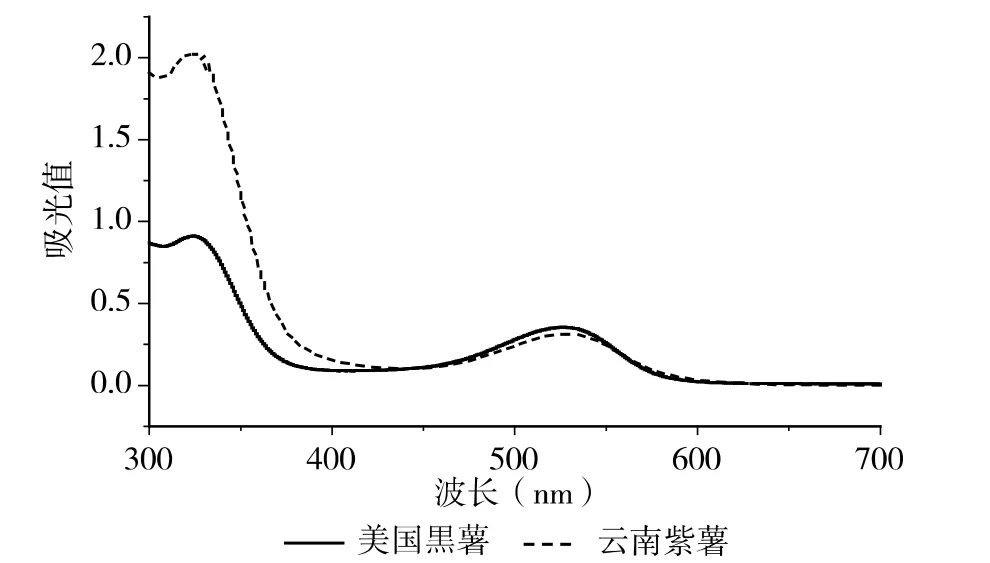
图1 紫薯花色苷的紫外可见全扫光谱图
2.2 鲜食/加工用紫薯色素中花色苷组分的鉴定结果
紫薯花色苷结构的具体分析以加工用的美国黑薯色素HPLC-MS 图谱为例(图2)。
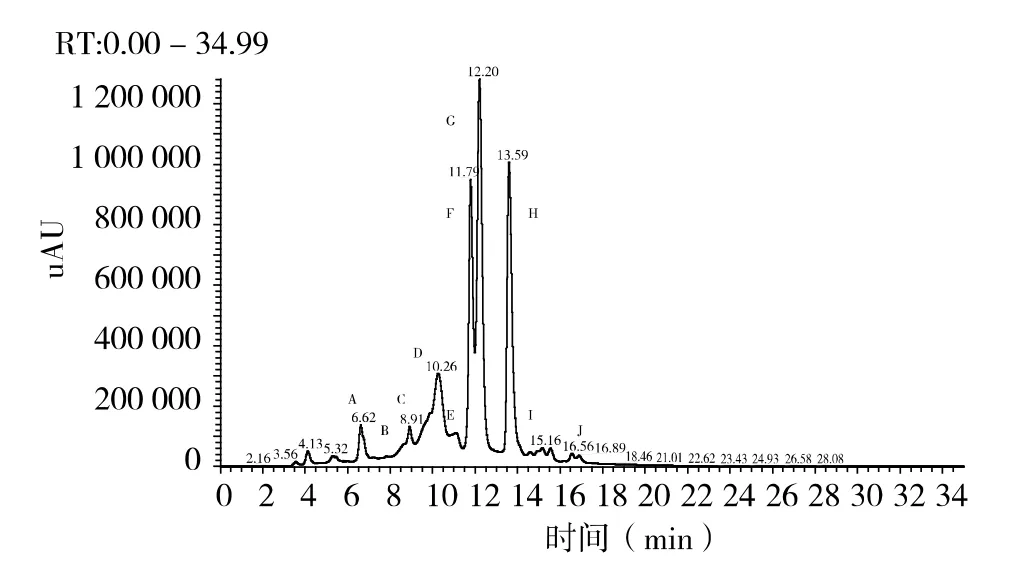
图2 美国黒薯HPLC 图谱
本文根据各花色苷在HPLC 图谱中的保留时间、分配规律[12]、二极管阵列检测器(PDA)吸收光谱;在MS 图谱中的分子离子一级及二级质谱[13-15]分析美国黑薯色素提取液中花色苷组分的种类和组成。
峰G (Rt=12.20 min),分子离子一级质谱只得到质荷比为m/z 1069 的一个分子离子峰,无法判断具体结构信息,因此对该峰进行二级质谱检测。二级质谱获得3 个碎片离子,分别为m/z 907、m/z 463 和m/z 301。其中碎片离子m/z 907 是m/z 1069 失去一分子葡萄糖[M-162]+得到的;碎片离子m/z 463 是m/z 907 失去一分子槐糖、一分子咖啡酸和一分子羟基苯甲酸[M-2 ×162-162-120]+得到的;通过进一步观察碎片离子m/z 301 的3 级质谱信息(MS3为287-14)确认碎片离子m/z 301 是芍药素。因此峰G 可能是芍药素-3-(6’咖啡酰-6’’对羟基苯甲酰槐糖苷)-5-葡糖苷。
由试验结果看出,加工用的美国黒薯共鉴定出9 种花色苷、鲜食用的云南紫薯鉴定出17 种花色苷,二者均为复杂的花色苷类混合物。云南紫薯与美国黑薯就其花色苷结构而言具有一定差异性;就花色苷的苷元来看,美国黒薯和云南紫薯均含有矢车菊素与芍药素,且多数为芍药素类,这与李杰[16]的报导一致;就非酰化情况而言,云南紫薯鉴定出两种非酰化花色苷,均为葡糖苷与槐糖苷结合的双糖苷化合物,而美国黒薯没有;从酰化情况看,二者均含有单酰化和双酰化结构,其中最主要的酰化芳香酸/脂肪酸为咖啡酸、阿魏酸和羟基苯甲酸,二者的区别在于云南紫薯所带酰基种类及数量均多余美国黒薯,如云南紫薯部分花色苷单体带有没食子酰和香豆酰,而美国黒薯没有,单酰化中,云南紫薯含有的对羟基苯甲酰和阿魏酰的数量高于美国黒薯。这些紫薯花色苷化学结构上的差异性可能与作物的遗传基因和生长环境有关。
2.3 鲜食/加工紫薯在5 种中式烹饪热加工方式下的损失率
试验结果显示,无论鲜食用的云南紫薯还是加工用的美国黒薯,与新鲜原料相比,5 种中式烹饪热加工均导致紫薯花色甘的损失,其损失率变化从低到高依次是微波<蒸<煮<低温油炸<烤。其中微波紫薯的损失最小,在13%~14%之间;蒸紫薯的损失其次,在16%左右;煮紫薯的损失略多,在26%~32%之间;其次为低温油炸,损失率在40%~64%;损失率最多的为烤紫薯,在62%~66%之间,这与陈蔚辉[9]的报导一致(图3)。而郎静[8]和王璐[7]的研究则认为通过加工后的紫薯其花色苷含量反而比未加工的新鲜紫薯高,这可能与加工时间长短有关。因此紫薯在不同加工条件下的花色苷含量变化这一问题还有待于更加完善的科学探讨。
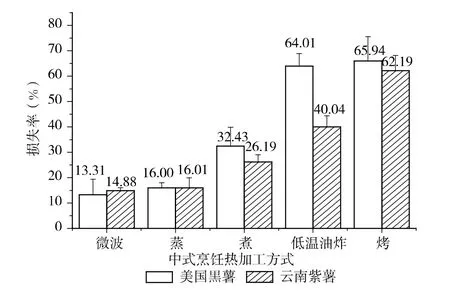
图3 5 种中式烹饪热加工方式下紫薯花色苷的损失率
花色苷是一类水溶性色素,化学性质较活泼,其光、热稳定性较差。中国传统加工食用方式均以加热做为基础,而高温加热会导致花色苷结构上的变化,从而引起含量上的变化。本试验采用的油炸为低温油炸,油温较平常偏低,可经过油炸处理的紫薯水分几乎全部损失,大部分花色苷随水析出流失,导致损失率偏高,同时油炸食品也不利于健康。烤紫薯的加热温度达到250~300℃,是其它加工方式的2~3 倍,由于花色苷对热不稳定极易发生热降解,开环生成无色查尔酮或α-二酮,导致花色苷含量的降低。煮紫薯在煮制的过程中花色苷随水大量溶出流失(煮制后锅中水为深绿色),导致花色苷含量的降低。蒸与微波这两种加热过程中紫薯流失水分少,紫薯花色苷的溶出与流失较缓,故微波和蒸制对水溶性花色甘损失相对较小。二者比较时,微波的损失率更小,这可能与二者的加热原理有关。因此,仅从花色苷损失率角度考虑,日常家庭食用紫薯时推荐以微波加工(加工时间最短且损失率最小)的方式食用。
3 结果与讨论
鲜食/加工用紫薯色素中花色苷组成和种类非常丰富。本文通过超高效液相色谱—二极管数组检测串联离子阱质谱仪鉴定了美国黒薯和云南紫薯中花色苷的结构特征,结果显示,二者均为芍药素类和矢车菊素类的混合物,云南紫薯中鉴定出17 种花色苷,包括2 种非酰化花色苷及14 种酰化花色苷及1 种降解产物;美国黑薯中鉴定出9 种花色苷,均为酰基化花色苷。
鲜食/加工用紫薯在5 种常见的中式烹饪热加工条件下的总花色苷损失率的变化趋势均为微波<蒸<煮<低温油炸<烤,因此从花色苷损失率角度出发,微波是其加工最佳食用方式。
[1]孙建霞,等.花色苷的资源分布以及定性定量分析方法研究进展[J].食品科学,2009,30(5),263-268.
[2]刘应杰,等.紫薯中6,7-二甲氧基香豆素和5-羟甲基糠醛的分离鉴定[J].西南师范大学学报,2013,38(1):85-89.
[3]蔡花真,王霞.紫甘薯花色苷组分抑制小鼠肝、肾、心、脾脂质过氧化的研究[J].食品工业,2009,31(4):6-8.
[4]冯萍,汪小华.紫苷薯花青素对动脉粥样硬化危险因素影响的研究进展[J].中国食物与营养,2013,19(1):61-64.
[5]于斌,等.黑米花色苷抑制人乳腺癌细胞促血管生成因子表达的机制[J].营养学报,2010,32(6):545-550.
[6]Wu X,et al.Concentraions of anthocyanins in common foods in the United States and estimation of normal consumption[J].J Agric Food Chem,2006,54:4069-4075.
[7]王璐,等.不同烹调方式对蔬菜植物化学物及VC 的影响[J].食品工业科技,2014,35(1):338-341.
[8]郎静,凌文华.不同烹调方式对食物中花色苷稳定性的影响[J].营养学报,2010,32(6):598-602,607.
[9]陈蔚辉,黄玲玲.不同烹饪方法对番薯营养成分的影响[J].食品科技,2013,38(1):88-91.
[10]Lee,J.Durst,R.W.Wrolstad,R.E.Determination of total monomeric anthocyanin pigment content of fruit juices,beverages,natural colorants,and wines by the pH differential method:collaborative study [J].Journal of AOAC International,2005,88,1269-1278.
[11]Xiaoyan Zhao,et al.Composition and Thermal Stability of Anthocyanins from Chinese Purple Corn [J].Journal of Agricultural and Food Chemical,2008,56,10761-10766.
[12]Truong V D,et al.Characterization of anthocyanins and anthocyanidins in purple-fleshed sweet petatoes by HPLCDAD/ESI-MS/MS [J].Joumal of Agricultural and Food Chemistry,2010,58:404-410.
[13]江连洲,等.HPLC-MS 法鉴定不同品种紫甘薯中花色苷组成[J].中国食品学报,2011,11(5):176-181.
[14]Lee J H,et al.Characterisation of anthocyanins in the black soybean (Glycine max L.)by HPLC-DAD-ESI/MS analysis[J].Food Chemistry,2009,112:226-231.
[15]邝敏杰,等.紫菜薹花色苷组分鉴定及其稳定性和抗氧化性[J].中国农业科学,2014,47(20):4067-4077.
[16]李杰.紫甘薯花色素苷的提取、组分分析及热稳定性研究[D].武汉:华中农业大学,2012.
