菜籽多肽稳定性及RP-HPLC 分离制备高抗氧化活性(ORAC)组分研究
2015-03-09王玉梅谢慧慧陈静宜王立峰
王玉梅,张 晶,谢慧慧,陈静宜,王立峰
(南京财经大学食品科学与工程学院/江苏省现代粮食流通与安全协同创新中心,南京 210023)
为研究加工过程中的一些环境因素是否对菜籽抗氧化肽的特性造成影响,本研究以自制的菜籽抗氧化肽为研究对象,在不同温度、酸碱度、消化方式以及保护剂的条件下,通过菜籽抗氧化肽的肽含量变化以及抗氧化能力指数(oxygen radical absortion capacity,ORAC)的变化来验证其稳定性,提出抗氧化肽的环境稳定性条件,并进一步对此抗氧化肽通过制备液相分离纯化出抗氧化性更强的小分子抗氧化肽。
1 材料与方法
1.1 原料与试剂
菜籽多肽原料:实验室自制。Lowry 蛋白浓度测定试剂盒:北京索莱宝科技有限公司;荧光物质(Fluorescein sodium salt,FL)、自由基产生剂AAPH (2,2'-azobis-2-amidinopropane-dihydrochloride)、抗氧化标准物质Trolox (6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid),购自于Sigma 公司;其他试剂均为分析纯。
1.2 仪器与设备
HH-4 数显恒温水浴锅(国华电器有限公司);PHS-3C 雷磁pH 计(上海精密科学仪器有限公司);FreeZone 2.5L 台式冷冻干燥机(美国LABCONCO 公司);U-3900 紫外可见分光光度计(日本HITACHI 公司);SpectraMax M2e 酶标仪(美国Molecular Devices 公司)。
1.3 试验方法
1.3.1 指数测定 肽含量的测定按照蛋白浓度的方法[1,2];抗氧化指数(ORAC)的测定[3,4]。
1.3.2 温度对菜籽多肽稳定性的影响 取制备好的菜籽多肽用蒸馏水配成浓度为0.5 mg/mL 的溶液,取5 mL于试管中,分别放置于20、40、60、80、100 ℃的水浴中,每隔一定时间取样,冷却后测定其肽含量和ORAC 值。
1.3.3 pH 对菜籽多肽热稳定性的影响 将菜籽多肽配成浓度为0.5 mg/mL 的溶液,用0.5 mol/L 的HCI 和NaOH 调pH 分别为2、4、6、8、10、12,于25、60、70℃水浴中恒温放置30 min 后取出测定肽含量和ORAC 值。
1.3.4 人工模拟消化系统对菜籽多肽的稳定性研究
(1)人工胃液中的试验
将pH 7.6、0.05 mol/L 的磷酸缓冲液用HCI 调pH至2,按照胃蛋白酶与肽的质量比为1∶10、1∶20、1∶40加入多肽和胃蛋白酶,确保溶液中多肽浓度为0.5 mg/mL,37 ℃水浴消化1h 和2h 后取样,取样后用10%Na2CO3溶液调pH 为7.0,测定其肽含量和ORAC 值[5]。
(2)人工肠液中的试验
在pH7.6、0.05 mol/L 的磷酸缓冲液中按照胃蛋白酶与肽的质量比为1∶10、1∶20、1∶40 加入多肽和胃蛋白酶,确保溶液中多肽浓度为0.5 mg/mL,置于37 ℃水浴中消化,分别在2、4、8 h 时取样测定其肽含量和ORAC 值。
1.3.5 保护剂对菜籽多肽的热稳定性研究 选取丙三醇、蔗糖、葡萄糖、D-果糖、α-乳糖五种保护剂,分别加0.5 g 上述保护剂到浓度为0.5 mg/mL 菜籽多肽溶液中,涡旋混匀后,60 ℃水浴中30 min 后取样,冷却后测定肽含量和ORAC 值[6]。
1.3.6 RP-HPLC 分离菜籽多肽及纯度分析 取菜籽多肽配制成30 mg/mL 的溶液,0.22 μm 滤膜过滤后使用RP-HPLC 系统进行分离。自动收集各个组分,旋转蒸发后冷冻干燥,并测定各个组分的抗氧化性并将抗氧化性最高组分进行液相分析[7,8]。
2 结果与分析
2.1 温度对菜籽多肽稳定性的影响
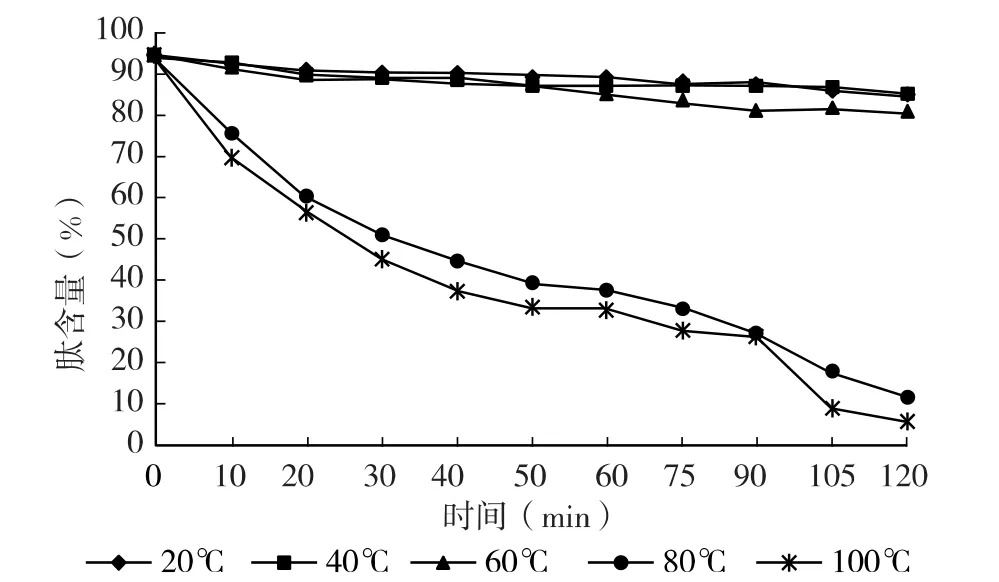
图1 热处理对菜籽肽液的肽含量的影响
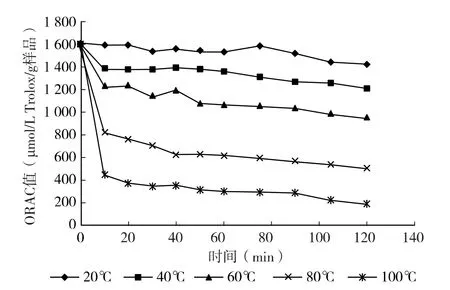
图2 热处理对菜籽肽液抗氧化性的影响
从图1、图2 中可以看出,随着加热温度的升高和时间的延长,肽含量和ORAC 值均减小。在20、40、60 ℃水浴中加热2 h 过程中总体肽含量都在80%以上,ORAC 值均在1 000 μmol/L TE/ (g 样品)左右;随着温度逐渐升高,肽含量与ORAC 值迅速降低;80℃加热20 min 后,肽含量和ORAC 值分别降到60%与503.68 μmol/L TE/ (g 样品);100 ℃时,加热20 min 后肽含量降为55%左右,ORAC 值为193.47 μmol/L TE/ (g 样品)。总体说来,温度80、100 ℃加热处理2h 后大部分的菜籽抗氧化肽失活,温度小于60 ℃时菜籽多肽较稳定。
2.2 pH 对菜籽多肽热稳定性的影响
当菜籽肽液的pH 值在2.0~12.0 范围内变化时,肽液分别于25、60、70 ℃处理30 min 的变化,图3、4显示pH 值对菜籽肽的热稳定性具有明显影响。当pH 6.0~8.0 时,肽液的热稳定性较好。pH 为8.0 时,经25、60、70 ℃处理30 min 后的肽含量分别为70.13%、79.77%、64.47%,ORAC 值分别为 1 434.37、1 425.29、1 074.9 μmol/L TE/ (g 样品);当pH 为6.0时,经此3 个温度处理30 min 后的肽含量为77.61%、71.62%、68.30%,ORAC 值为1 511.6、1 293.82、1 180.89 μM TE/ (g 样品)。pH 过大或过小均对菜籽多肽的稳定性有较大影响,因此需避免过酸或过碱的情况,pH 值应控制在6.0~8.0 之间。
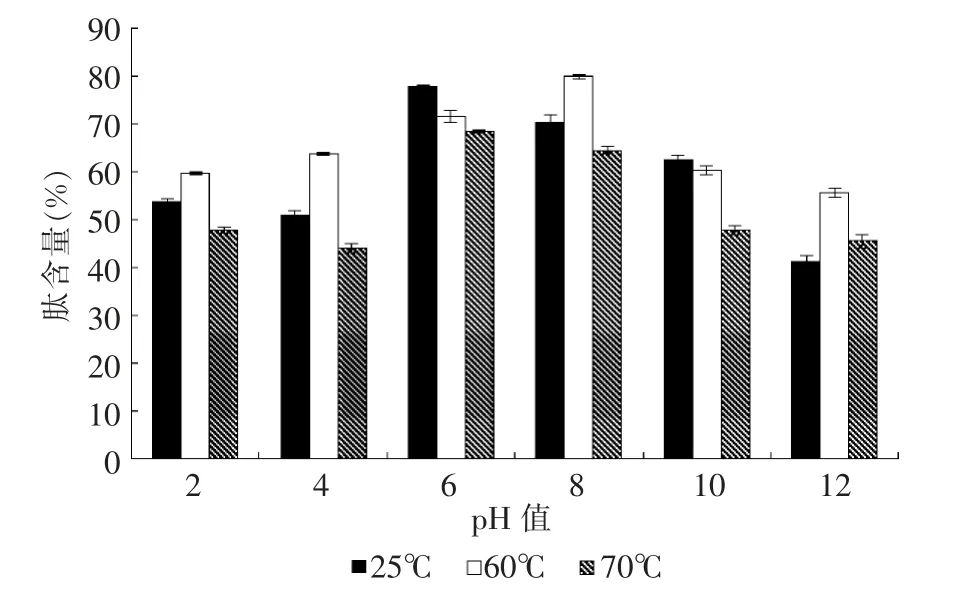
图3 不同pH 值对菜籽肽液肽含量的影响
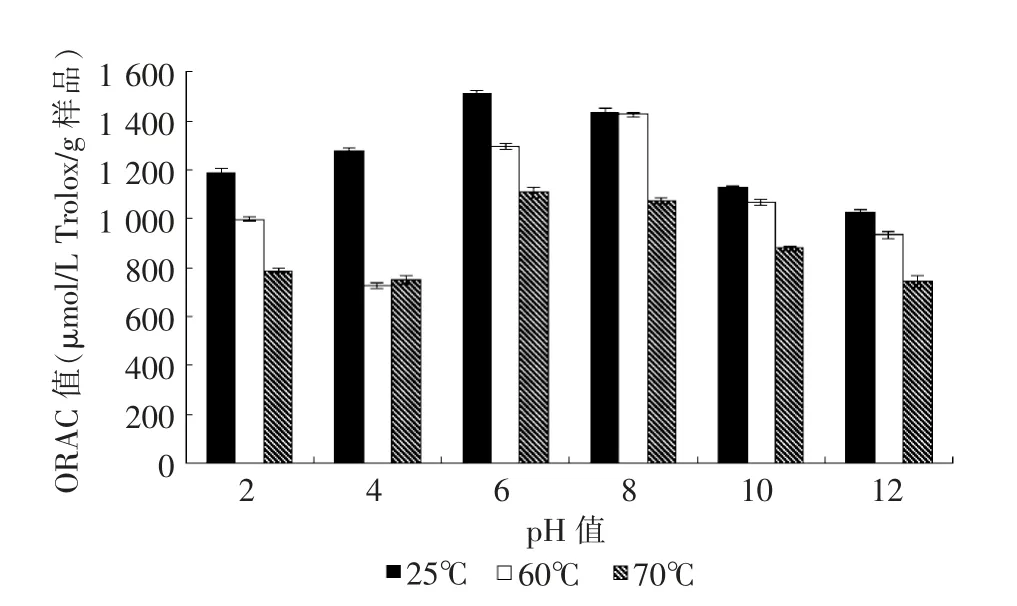
图4 不同pH 值对菜籽肽液的抗氧化性的影响
2.3 菜籽抗氧化肽在人工胃液中的消化试验
由表1 可知,在人工模拟的胃液试验中,随着消化时间增加,肽含量和ORAC 值在逐渐减小;另一方面,随着胃蛋白酶浓度增加,这2 个指标值也在减小。pH 2.0 时,胃蛋白酶与菜籽多肽质量比为1∶10 的条件下消化2 h 后,多肽含量降为39.02,ORAC 值降为605.95 μmol/L TE/ (g 样品)。
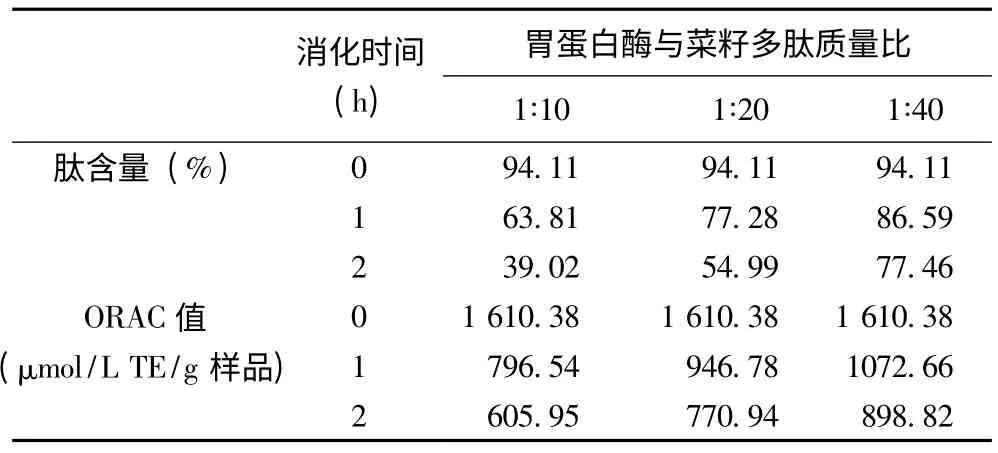
表1 胃蛋白酶消化过程中菜籽抗氧化肽的稳定性研究
2.4 菜籽抗氧化肽在人工肠液中的消化试验
由表2 可知,人工模拟肠液消化试验过程中,随着处理时间的延长以及胰蛋白酶浓度增加,菜籽抗氧化肽液的肽含量和ORAC 值逐渐减小。pH 值为7.6,胰蛋白酶与菜籽多肽质量比为1∶10 时消化8 h 后的肽含量和ORAC 分别降值降为37.59%和242.75 μmol/L TE/ (g样品)。

表2 胰蛋白酶消化过程中菜籽抗氧化肽稳定性的影响
2.5 保护剂及浓度的选择
选取了5 种保护剂来提高菜籽多肽在热处理过程中的稳定性,60 ℃水浴中加热30 min 后肽含量和ORAC值的变化如表3 所示。
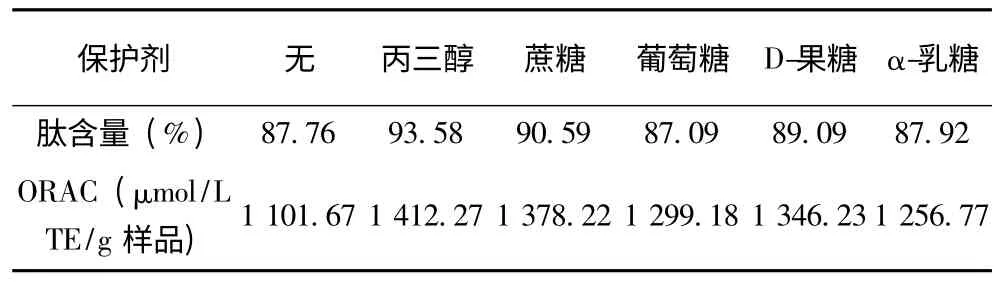
表3 保护剂对菜籽抗氧化肽热稳定性的影响
没有添加保护剂时,菜籽多肽在60 ℃中加热30 min 后,肽含量为87.76%,其ORAC 值为1 101.67 μmol/L TE/ (g 样品)。加入不同保护剂后,加热过程中肽含量和ORAC 值都有提高。其中丙三醇的保护效果最好,加热后肽含量为93.58%,ORAC 值为1 412.27 μmol/L TE/ (g 样品)。其次是蔗糖与D-果糖,加入蔗糖后溶液加热后的肽含量为90.59%,ORAC 值为1 378.22 μmol/L TE/ (g 样品),加入D-果糖后溶液加热后的肽含量为89.09%,ORAC 值为1 346.23 μmol/L TE/ (g 样品)。葡萄糖与α-乳糖的加入并没有起到明显的作用。
2.6 利用RP-HPLC 进一步分离纯化菜籽肽
本研究利用RP-HPLC 进一步对菜籽抗氧化肽进行分离纯化,收集到6 个主要组分(图5),分别测定这6个组分的ORAC 值,组分5 的ORAC 值最高为1 744.29 μmol/L TE/ (g 样品)。使用分析型RP-HPLC 对组分5进行分析,主要有1 个峰(图6)。
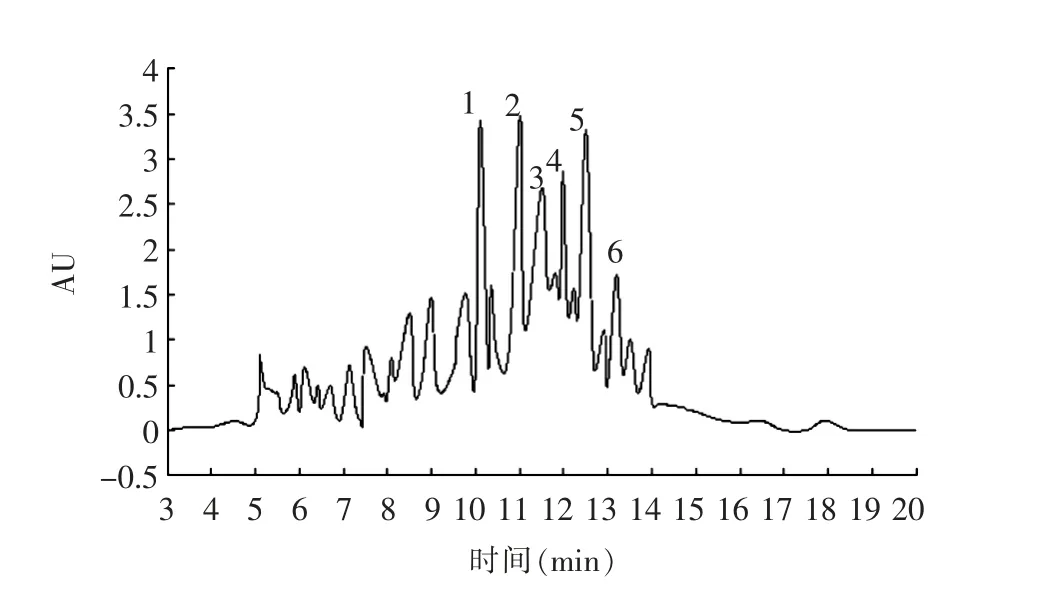
图5 半制备RP-HPLC 分离菜籽抗氧化肽
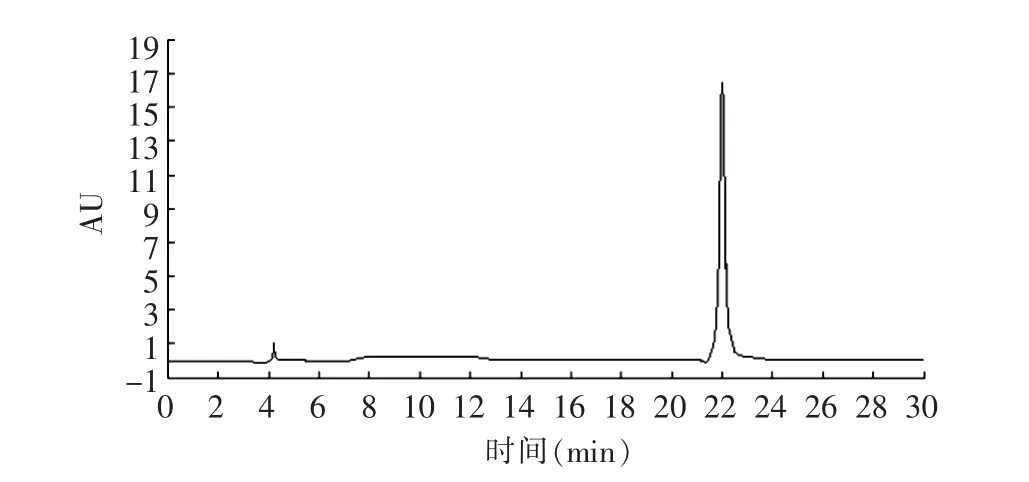
图6 分析型RP-HPLC 分离菜籽肽组分5 的洗脱曲线
3 结论
本试验研究了不同温度、酸碱度、消化方式以及保护剂对菜籽多肽稳定性的影响。温度小于60 ℃时菜籽多肽较稳定,温度为80、100 ℃加热处理2 h 后大部分的菜籽多肽失活。pH 值对菜籽多肽的热稳定性具有明显影响,pH 值为6.0~8.0 时较稳定,在过酸或过碱的条件下都不稳定。在人工消化实验中,随着酶浓度和反应时间的增加菜籽多肽的稳定性降低,且人工胃液对菜籽多肽稳定性的影响比肠液的影响大。丙三醇、蔗糖和D-果糖均对多肽的稳定性有保护作用。通过半制备RP-HPLC 的分离纯化,可以收集得到具有更强氧化性的菜籽肽(组分5),其ORAC 值为1 744.29 μmol/L TE/(g 样品)。
[1]Lowry O H,et al.Protein measurement with the Folin phenol reagent [J].J Biol Chem,1951:193(1):265-275.
[2]Cooper T G.The tools of biochemistry.New york:John wiley& Sons Inc,1977:53-55.
[3]You S J,Udenigwe C C,Aluko R E,et al.Multifunctional peptides from egg white lysozyme [J].Food Research International,2010,43(3):848-855.
[4]Prior R L,Wu X,Schaich K.Standardized methods for thedetermination of antioxidant capacity and phenolics in foods and dietary supplements [J].Journal of Agricultural and Food Chemistry,2005,53(10):4290-4302.
[5]刘长江,王雪,曹向宇,等.麦麸多肽稳定性的研究[J].食品科技,2009,34(9):164-167.
[6]皮钰珍,刘长江,岳喜庆,等.鹿胎盘多肽稳定性的研究[J].食品研究与开发,2007,28(1):33-36.
[7]朱晓囡,苏志国.反相液相色谱在蛋白质及多肽分离分析中的应用[J].分析化学,2004,32(2):248-254.
[8]Huang Y L,Han Y L.The analysis of RP-HPLC in the chemical synthesis of Thymosin al [J].The Research Brief of Chemical Analysis,2004,7 (32):927-929.
