胶原多肽对亚急性酒精中毒大鼠的保护作用研究
2015-03-09于永超杨勤兵
林 兵,于永超,陈 禹,石 劢,杨勤兵
(1中日友好医院营养科,北京 100029;2北京清华长庚医院临床营养科/清华大学医学中心,北京 102218)
亚急性酒精中毒的病程介于急慢性酒精中毒之间,是慢性酒精中毒的早期损伤,主要表现为肝功能损伤、营养素代谢紊乱和神经系统损伤等方面。生物活性肽对于酒精中毒的保护作用已有报道,如玉米寡肽[1]、谷胱甘肽[2]等。本研究采用的胶原多肽(Collagen Peptides,CPs)是一种来源于深海鱼皮的寡肽混合物,易吸收、水溶性好、肠胃刺激小、价格便宜。已有研究显示,CPs 具有多种生物活性,包括延缓细胞老化、降血压、抑制学习记忆功能下降、抗衰老等[3],而对于酒精中毒领域没有相关的报道。本研究以胶原多肽作为干预物,观察其对连续4w 摄入酒精大鼠的一般状况、肝功能、脂质代谢、蛋白质代谢、氧化应激水平、乙醇代谢酶等的影响,首次评价其对亚急性酒精中毒大鼠的作用,为胶原多肽的应用提供新的方向。
1 材料与方法
1.1 胶原多肽
胶原多肽为淡黄色粉末状,相对分子质量在100—860Da,以深海鱼的鱼皮为主要原料,采用复合偶联酶解技术生产的小分子多肽混合物,由北京中食海氏生物技术有限公司提供。
1.2 实验动物
SPF 级SD 大鼠,雌性,8—10w 龄,体重220—250g,由北京大学医学部实验动物中心提供,许可证号:SYXK (京)2011—0039,饲养环境温度21—23℃,湿度50%—60%RH。
1.3 主要试剂和仪器
HITACHI 7180 全自动生化分析仪 (日本);肝ADH、组织蛋白(pro)、血清SOD、MDA 检测试剂盒,均由南京建成生物工程研究所提供;UV7512GD 型紫外可见分光光度计,上海欣益仪器仪表有限公司;乙醇和叔丁醇为分析纯。
1.4 实验方法
大鼠按体重随机分为正常对照组、模型对照组和CPs 高中低干预组,模型对照组12 只,其余每组10 只。乙醇稀释为50%体积分数的酒精,灌胃剂量为15mL/kg,对照组蒸馏水灌胃15mL/kg。高中低干预组在酒精灌胃1h 后分别给予CPs 0.225、0.45 以及0.9g/kg·BW,对照组给予等剂量蒸馏水,每周称重调整灌胃量。
记录大鼠一般生活状况和进食量,第29d 处死大鼠,股动脉取血,分离血清,检测ALT、AST、ALB、TB、TC、TG、SOD 和MDA 水平,取部分肝组织检查ADH 和组织pro 水平。
1.5 统计学处理
所有结果以均数± 标准差表示,数据分析采用SPSS15.0 统计软件进行单因素方差分析,以LSD 法行两两比较,确定P<0.05 时差异有统计学意义。
2 结果与分析
实验结束时共48 只大鼠完成实验,期间模型对照组和低剂量组各1 只大鼠因灌胃误呛入肺而导致死亡,低剂量组和高剂量组各有1 只因不能长期耐受酒精而死亡(长期精神萎靡,解剖肺部无明显渗出),其余48 只大鼠均存活。
2.1 大鼠体重变化
摄入酒精后模型对照组大鼠较正常对照组大鼠精神状态差、食欲差、大便多溏泻、反应迟钝、而且活动减少,体重增长缓慢(P<0.05),干预组大鼠的症状比模型对照组轻,体重较模型对照组有升高的趋势,但是不能逆转体重的减轻,差异无统计学意义(表1)。
表1 大鼠体重变化(±s,g)
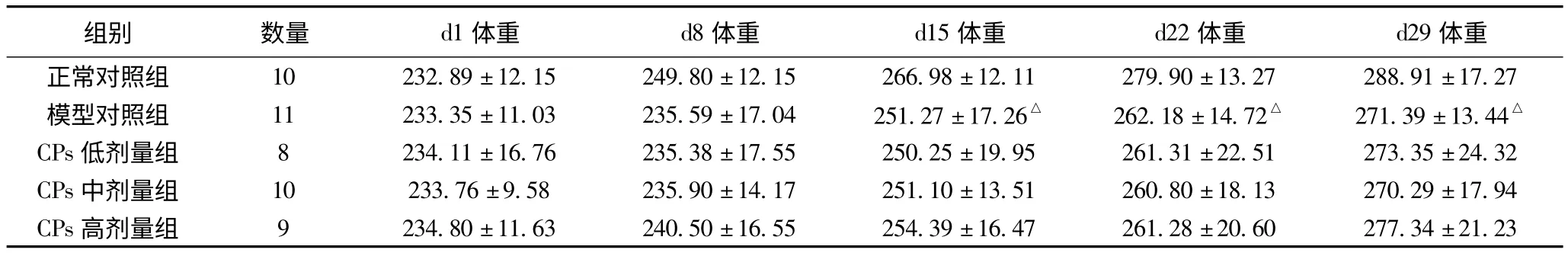
表1 大鼠体重变化(±s,g)
注:与正常对照组相比,△P<0.05
2.2 血清肝功能指标
与正常对照组相比,模型对照组大鼠血清中ALT、AST 显著升高(P<0.05)。与模型对照组相比,高剂量组大鼠的ALT 水平明显下降(P<0.05),并且各剂量组大鼠血清的AST 水平明显下降(P<0.05)(表2)。
表2 大鼠血清中ALT、AST 水平(±s)

表2 大鼠血清中ALT、AST 水平(±s)
注:与正常对照组相比,△P<0.05;与模型对照组相比,* P<0.05
2.3 血清抗氧化指标
模型对照组大鼠的SOD 水平明显降低,而血清MDA水平明显升高(P<0.05)。与模型对照组相比,各剂量组大鼠SOD 活性有升高的趋势,低剂量组SOD 水平明显升高(P<0.05),其余各组差异无显著性;低剂量组和中剂量组的MDA 水平比模型对照组低,差异有统计学意义(表3)。
表3 大鼠血清中SOD、MDA 水平(±s)

表3 大鼠血清中SOD、MDA 水平(±s)
注:与正常对照组相比,△P<0.05;与模型对照组相比,* P<0.05
2.4 脂类与蛋白代谢变化
模型对照组的TG 和TC 含量较正常对照组明显升高,而低剂量组和高剂量组大鼠血清TG 含量比模型对照低,差异有显著性;高剂量组TC 含量比模型对照组低,差异有显著性。模型对照组的TP 和ALB 与正常对照组相比无明显差异,但是A/G 比的差异有显著性,各剂量干预组并不能减小这种差异,反而有扩大的趋势(表4)。
2.5 大鼠肝脏ADH 水平
模型对照和干预组组的ADH 活性比正常对照组高,但各组间差异无显著性(正常对照组与模型对照组间P=0.087)(表5)。
表4 大鼠血清中TG、TC、TP、ALB、GLB 水平及A/G 比(±s)

表4 大鼠血清中TG、TC、TP、ALB、GLB 水平及A/G 比(±s)
注:与正常对照组相比,△P<0.05;与模型对照组相比,* P<0.05
表5 大鼠肝脏ADH 水平(±s)
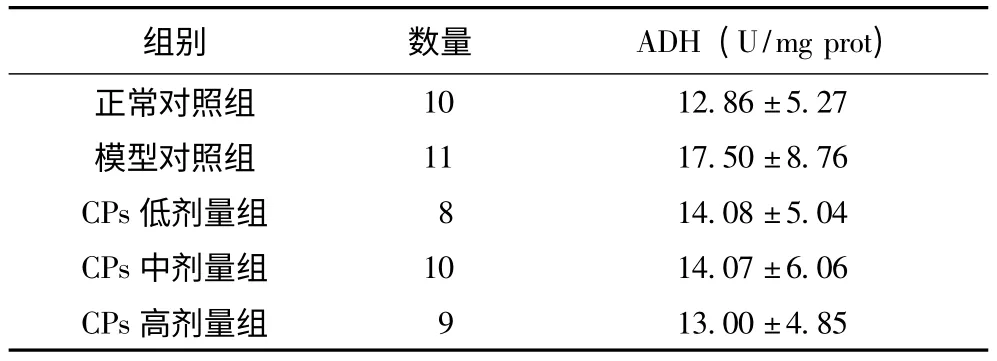
表5 大鼠肝脏ADH 水平(±s)
3 讨论
本研究采用酒精灌胃造成大鼠亚急性酒精中毒模型,研究CPs 对于酒精诱导大鼠早期损伤的保护作用。肝脏为酒精代谢的主要器官,肝损伤是酒精中毒最常见的靶器官,结果显示,与正常对照组相比,模型组大鼠一般状况较差,体重增长缓慢,血清ALT、AST 比空白对照高,差异均有统计学意义。ALT 和AST 是肝细胞中的正常代谢酶,当肝细胞出现损伤时,这两种转氨酶进入血清便增多。通过测定血清转氨酶的活性,即可作为肝细胞损伤的评价指标,大鼠转氨酶的升高表明连续4w 饮酒造成了大鼠肝损伤,CPs 干预可以逆转其中的某些变化,干预组大鼠血清ALT 和AST 水平较模型组降低,提示CPs 具有减轻酒精诱导的肝损伤的作用。进一步分析结果发现,血清ALT 的显著变化常见于各种急性病毒性肝炎、药物引起急性肝细胞损伤。相反,在酒精性肝炎中,AST 一般增高至正常值的2—10 倍,而ALT变化幅度较小[4]。结果显示,模型组AST 升高的幅度(约2 倍)明显高于ALT (约1/4),这可能与酒精性肝炎的发生有关,肝脏炎症反应是酒精性肝病的重要病理学改变[5],提示CPs 可能具有减轻炎症反应的作用。
目前,关于酒精中毒的致病机制仍有待确定,而氧化应激和脂质过氧化是普遍认可的病因之一[6]。机体大量摄入乙醇后,抗氧化物质消耗增加,而且酒精中毒使得抗氧化酶活性受到抑制,机体处于氧化应激状态,早期的主要变化是其主要代谢场所——肝细胞发生膜脂质过氧化反应。其中,血清MDA 含量反应了机体脂质过氧化的程度。本实验结果显示,连续4w 摄入酒精后大鼠的SOD 活性下降,血清中MDA 水平升高。某些剂量CPs 干预使得大鼠SOD 活性升高,MDA 水平下降,表明CPs 可以在一定程度上矫正机体的氧化应激状态,减轻脂质过氧化损害,这也与CPs 之前的研究结果相符[7]。
长期饮酒会造成机体营养素代谢紊乱,脂类代谢异常尤其常见。摄入酒精后大鼠血清TG 和TC 含量明显升高(P<0.05),酒精引起机体脂类代谢紊乱在以往的研究中已有报道[4],而以往研究也发现,胶原多肽具有改善脂类代谢的作用[8,9]。结果表明,低剂量和高剂量CPs 干预后大鼠血清TG 含量明显降低,高剂量组大鼠TC 含量明显下降,这表明CPs 具有一定的降血脂作用,这可能是减轻酒精中毒损害的重要机制。
酒精对于机体各组织器官的损伤与时间、剂量相关,呈现出蓄积作用,本实验设计为诱导酒精中毒早期损伤,以肝损伤、脂代谢异常、氧化应激失衡等为主要表现,时间为4w,没有观察到中晚期酒精中毒如严重的代谢紊乱、肝硬化、乙醇代谢酶活性改变等表现。白蛋白由肝细胞合成,血清白蛋白浓度是肝脏的合成功能的评价指标,各种慢性肝病常可见低白蛋白血症[4]。4w酒精灌胃没有造成大鼠血清白蛋白水平的变化,这表明肝合成功能并没有受到影响。模型组A/G 比高于正常对照组(P<0.05),各剂量干预组并不能减小这种差异,具体的原因尚不清楚,可能与酒精致免疫系统的异常有关。ADH 是乙醇代谢的特异性酶,在慢性酒精中毒的过程中具有重要的作用,有研究者指出,随着乙醇的持续摄入,ADH 的活性会随之升高[10],因此降低ADH的活性是减轻酒精中毒损害的重要机制,本研究模型对照组大鼠肝脏内的ADH 活性较正常对照组有一定的升高(t 检验P=0.087),而CPs 干预后ADH 的活性有一定程度的下降,但是差异无显著性。
综上所述,CPs 对于酒精诱导的大鼠早期损伤具有保护作用,包括减轻肝脏损伤、提高机体抗氧化水平、改善脂类代谢等,其对于ADH、蛋白质代谢的影响仍需进一步的研究证实。
[1]Zhang F,Zhang J,Li Y.Corn oligopeptides protect against early alcoholic liver injury in rats [J].Food Chem Toxicol,2012,50(6):2149-2154.
[2]刘箐,周国平.甲钴胺联合还原型谷胱甘肽治疗慢性酒精中毒性周围神经病疗效观察[J].脑与神经疾病杂志,2012,20(2):149-151.
[3]Pei XR,et al.Marine collagen peptide isolated from Chum Salmon skin facilitates learning and memory in aged C57BL/6J mice [J].Food Chemistry,2010,118:333-340.
[4]S.K.Das,et al.Biomarkers of alcoholism:an updated review [J].The Scandinavian Journal of Clinical & Laboratory Investigation,2008,68(2):81-92.
[5]Lawrence S,Friedman MD,Emmet B,et al.Handbook of liver disease [M].2 edtion.Churchill Livingstone,2004.
[6]Albano E.Oxidative mechanisms in the pathogenesis of alcoholic liver disease [J].Molecular Aspects of Medicine,2008,29:9-16.
[7]Das SK,Vasudevan DM.Alcohol-induced oxidative stress[J].Life Sciences,2007,81(3):177-187.
[8]王军波,等.海洋胶原肤的分子组成及其降血脂和抗氧化作用研究[J].中华预防医学杂志,2008,4:226-230.
[9]Saito M,Kiyose C,Higuchi T,et al.Effect of collagen hydrolysates from salmon and trout skins on the lipid profile in rats [J].J Agric Food Chem,2009,57:10477-10482.
[10]Wang GX,Wang BY,Liu,CR.The relationship between activities of hepatic and gastric alcohol dehydrogenase and occurrence of chronic alcoholic liver disease [J].Hepatobiliary Pancreat Dis Int,2002,1(3):406-410.
