维药恰玛古中硫代葡萄糖苷的提取工艺研究Δ
2015-03-09安熙强程江南赵婷婷新疆维吾尔自治区药物研究所乌鲁木齐830004新疆维吾尔自治区第二济困医院乌鲁木齐8300
张 涛,安熙强,黄 莉,胡 旭,程江南,赵婷婷,马 媛,张 娟(.新疆维吾尔自治区药物研究所,乌鲁木齐 830004;.新疆维吾尔自治区第二济困医院,乌鲁木齐 8300)
恰玛古,拉丁文名Brassica rapaL.,为十字花科芸薹属芜菁亚种,二年生草本植物,常用种子和根入药。恰玛古是受新疆维吾尔族喜爱的并有较长应用历史的传统药用植物[1-3],收载于《中华人民共和国卫生部药品标准-维吾尔药分册》中[4]。其主产于中国新疆天山西南、塔里木西北地区,其中新疆阿克苏柯坪县作为该物种的主产地,已获得国家地理标志认证。
硫代葡萄糖苷是广泛存在于十字花科植物中的含硫次级代谢产物,到目前已发现有近120种。硫代葡萄糖苷在芥子酶或胃肠道中细菌酶的催化作用下,会发生降解并生成多种降解产物。研究发现硫代葡萄糖苷的降解产物异硫代氰酸盐具有抗肿瘤作用[5-7]。根据文献报道,十字花科芸薹属植物根系中的硫代葡萄糖苷以芳香族为主,主要是苯甲基硫代葡萄糖苷、p-羟基苯甲基硫代葡萄糖苷和2-苯乙基硫代葡萄糖苷[8]。因此,本研究选择苯甲基硫代葡萄糖苷为对照品,以硫代葡萄糖苷提取量和干膏得率为综合评价指标,通过单因素试验筛选提取方法(乙醇体积分数、料液比、提取时间、提取次数),利用正交试验考察乙醇体积分数、料液比、提取时间对恰玛古中硫代葡萄糖苷提取工艺的影响,并采用经方法学验证后的紫外分光光度法测定硫代葡萄糖苷含量,为恰玛古中硫代葡萄糖苷的充分利用提供参考。
1 材料
1.1 仪器
UV765 型紫外分光光度计(上海精科有限公司);ML204型电子天平、AB135-S型电子天平(瑞士Mettler Toledo公司)。
1.2 药品、药材与试剂
苯甲基硫代葡萄糖苷对照品(美国Chroma Dex 公司,批号:00007300-704,纯度:99.3%);恰玛古(新疆柯坪县圣泉实业有限公司,批号:141028,经新疆维吾尔自治区药物研究所杨伟俊研究员鉴定为十字花科芸薹属芜菁亚种恰玛古的肉质根);水为双蒸水,试剂均为分析纯。
2 方法与结果
2.1 硫代葡萄糖苷含量测定[9-10]
2.1.1 对照品溶液的制备 精密称取苯甲基硫代葡萄糖苷对照品35.50 mg,置于25 ml量瓶中,加水溶解并定容至刻度,摇匀,即得质量浓度为1.41 mg/ml的苯甲基硫代葡萄糖苷对照品溶液。
2.1.2 供试品溶液的制备 精密称取恰玛古药材粗粉5 g 至烧瓶中,加8倍量85%乙醇回流提取2次,每次1 h,过滤,合并滤液至100 ml量瓶中,用85%乙醇定容至刻度,摇匀,即得。
2.1.3 检测波长的选择 精密吸取对照品溶液和供试品溶液2 ml,分别置于10 ml量瓶中,加入0.1%羧甲基纤维素钠4 ml,摇匀后再加入0.71 g/L氯化钯2 ml,摇匀,室温显色1 h。对照管以相应试剂为空白。于400~700 nm 波长扫描,结果显示,二者均在520 nm波长处有最大吸收。
2.1.4 标准曲线的制备 精密吸取对照品溶液1、2、3、4、5、6 ml置于10 ml量瓶中,按“2.1.3”项下方法测定吸光度(A),以A为纵坐标、对照品溶液质量浓度(c)为横坐标,得回归方程A=1.019 8c-0.049 9(r=0.999 9,n=6),表明苯甲基硫代葡萄糖苷线性范围为0.141~0.846 mg/ml。
2.1.5 重复性试验 精密称取恰玛古药材粗粉5 g,共6份,按照“2.1.2”项下方法制备供试品溶液,按“2.1.3”项下方法测定A,计算吸光度的RSD为0.94%(n=6),表明本法重复性良好。
2.1.6 精密度试验 精密吸取对照品溶液3 ml,共5 份,按“2.1.3”项下方法测定A,计算吸光度的RSD 为0.27%(n=5),表明仪器精密度良好。
2.1.7 稳定性试验 精密吸取供试品溶液2 ml,分别于1、2、3、4、5、6 h 按“2.1.3”项下方法测定A,计算硫代葡萄糖苷含量的RSD为2.78%(n=6)。结果表明,供试品溶液在6 h内可保持相对稳定,但在4 h 后测定值明显降低。因此,测定恰玛古中的硫代葡萄糖苷含量时,要求在4 h 以内完成,以保证试验结果的准确。
2.1.8 加样回收率试验 精密称取已知含量的恰玛古药材粗粉9份,平均分为3组,按高、中、低3个水平依次精确地加入一定量苯甲基硫代葡萄糖苷对照品溶液,然后按“2.1.2”项下方法制备供试品溶液,按“2.1.3”项下方法测定A,计算平均加样回收率为98.96%,RSD为1.20%(n=3)。
2.2 综合评分计算
以硫代葡萄糖苷提取量和干膏得率进行综合评分,硫代葡萄糖苷提取量(mg/g)=提取液中硫代葡萄糖苷质量浓度×定容体积/原药材的质量;干膏得率(%)=干膏质量/原药材的质量×100%,综合评分=(硫代葡萄糖苷提取量/硫代葡萄糖苷提取量最大值)×80+(干膏得率/干膏得率最大值)×20。
2.3 单因素试验考察
根据硫代葡萄糖苷的理化性质,以及醇提工艺的主要影响因素,选取乙醇体积分数(%)、料液比、提取时间(h)、提取次数作为考察因素。
2.3.1 乙醇体积分数 精密称取恰玛古药材粗粉25 g,共5份,分别加入8倍量95%、85%、75%、65%、55%的乙醇溶液加热回流提取2 次,每次1 h,按“2.1.2”项下方法制备供试品溶液,依法测定。计算得各提取液中硫代葡萄糖苷提取量分别为7.26、6.48、6.17、5.87、5.47 mg/g,干膏得率分别为25.17%、23.36%、23.19%、18.49%、18.25%。综合评分结果见图1。
由图1 可见,随着乙醇体积分数的降低,综合评分逐渐降低,表明95%乙醇的提取效果最好。故选择95%、85%和75%乙醇进一步进行正交试验。
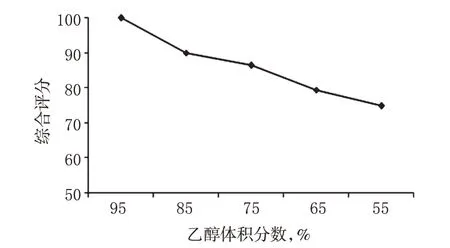
图1 乙醇体积分数对综合评分的影响Fig 1 The effects of ethanol volume fraction on the comprehensive score
2.3.2 料液比 精密称取恰玛古药材粗粉25 g,共5 份,分别加入6、8、10、12、14 倍量95%乙醇加热回流提取2 次,每次1 h,按“2.1.2”项下方法制备供试品溶液,依法测定。计算得各提取液中硫代葡萄糖苷提取量分别为6.65、7.31、7.34、7.59、7.65 mg/g,干膏得率分别为19.88%、24.77%、25.81%、27.48%、27.82%。综合评分结果见图2。
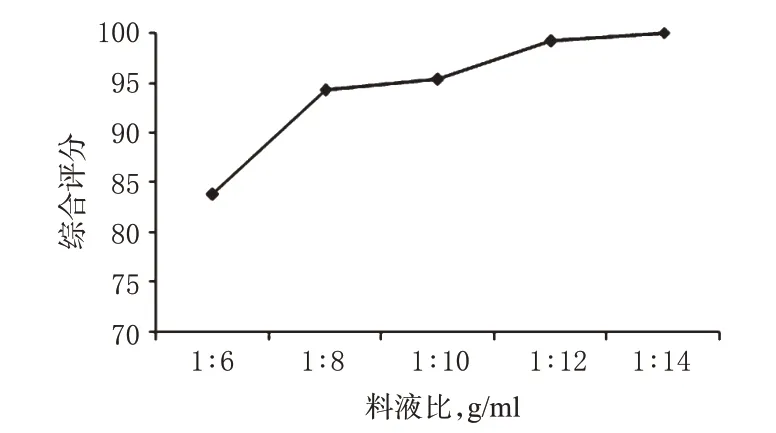
图2 料液比对综合评分的影响Fig 2 The effects of material-liquid ratio on the comprehensive score
由图2 可见,料液比大于1 ∶8 后,综合评分趋于稳定。故选择8倍量、10倍量和12倍量乙醇进一步进行正交试验。
2.3.3 提取时间 精密称取恰玛古药材粗粉25 g,共5 份,分别加入8倍量95%的乙醇溶液加热回流提取2次,每次0.5、1、1.5、2、2.5 h,按“2.1.2”项下方法制备供试品溶液,依法测定。计算得各提取液中硫代葡萄糖苷提取量分别为7.09、7.42、7.32、6.31、5.55 mg/g,干膏得率分别为24.36%、25.14%、25.13%、25.15%、25.20%。综合评分结果见图3。

图3 提取时间对综合评分的影响Fig 3 The effects of extraction time on the comprehensive score
由图3 可见,当提取时间大于1.5 h 后,综合评分逐渐降低。故选择0.5、1、1.5 h进一步进行正交试验。
2.3.4 提取次数 精密称取恰玛古药材粗粉25 g,共4份,分别加入8倍量95%的乙醇溶液加热回流提取1、2、3、4次,按“2.1.2”项下方法制备供试品溶液,依法测定。计算得各提取液中硫代葡萄糖苷提取量分别为5.56、7.42、7.50、7.60 mg/g,干膏得率分别为19.25%、24.99%、24.90%、24.79%。综合评分结果见图4。
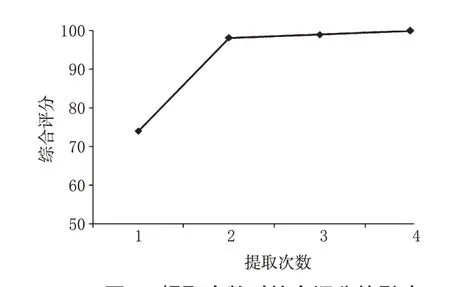
图4 提取次数对综合评分的影响Fig 4 The effects of extraction times on the comprehensive score
由图4 可见,当提取次数大于2 次后,综合评分为98 以上。为了充分提取药材中的有效成分,又考虑到工业成本,最终确定提取次数为2次。
2.4 正交试验优选提取工艺条件
在单因素试验基础上,固定提取次数为2 次,同时选择乙醇体积分数、提取时间、料液比为考察因素,以硫代葡萄糖苷提取量和干膏得率的综合评分为指标,按L9(34)正交表进行试验。精密称取恰玛古药材粗粉25 g,共9 份,按“2.1.2”项下方法制备供试品溶液。因素与水平见表1,正交试验安排及结果见表2,方差分析结果见表3。
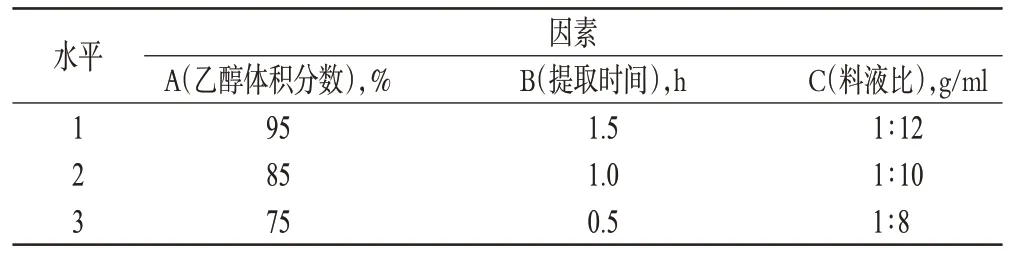
表1 因素与水平Tab 1 Factors and levels
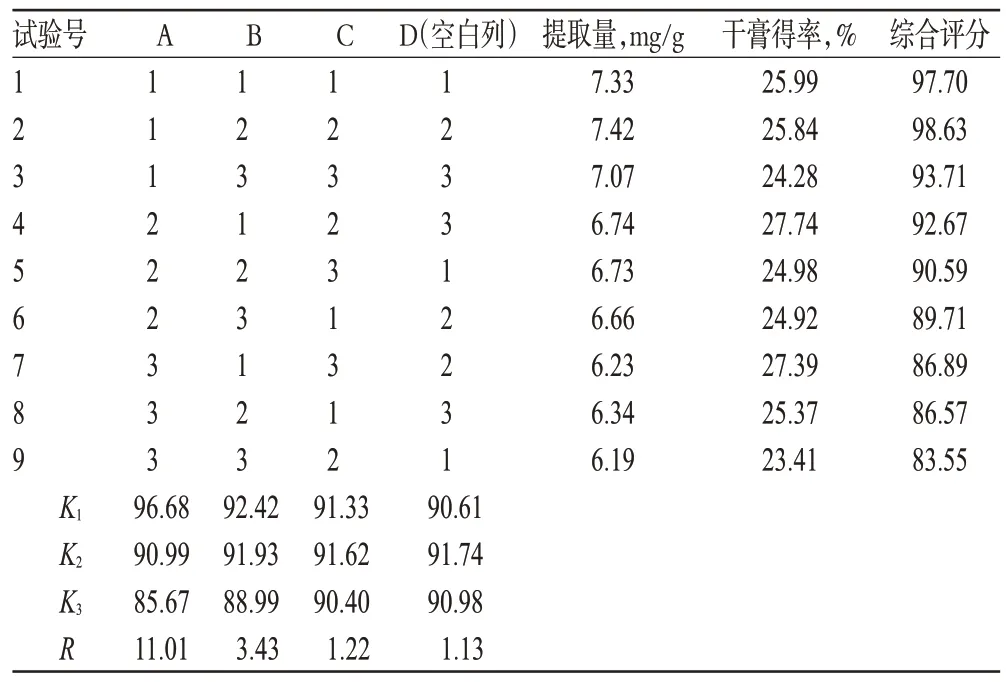
表2 正交试验安排及结果Tab 2 Orthogonal test arragement and its results
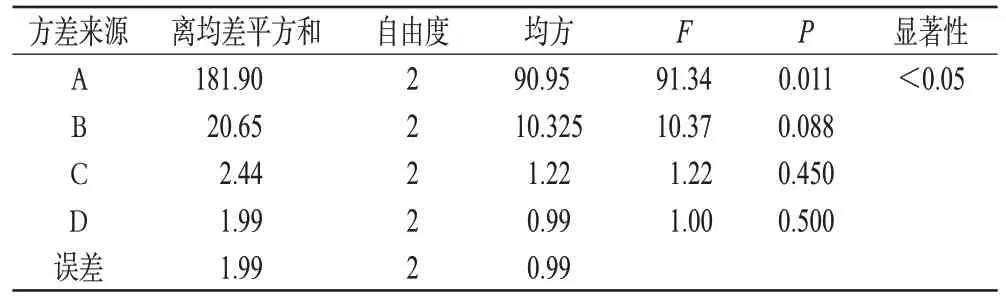
表3 方差分析结果Tab 3 Results of variance analysis
由直观分析可知,各因素对恰玛古硫代葡萄糖苷提取工艺的影响大小顺序为A(乙醇体积分数)>B(提取时间)>C(料液比),以乙醇体积分数对恰玛古中硫代葡萄糖苷提取效果的影响最大(P<0.05)。经方差分析可知,提取时间、料液比对提取效果无显著性影响。因此,为降低成本、节省工时,结合单因素试验结果综合考虑,确定最优工艺为A1B2C3,即乙醇体积分数95%,提取时间1.0 h,料液比1∶8。
2.5 正交验证试验
据正交试验优选的提取工艺条件,进行3 次验证试验,结果见表4。
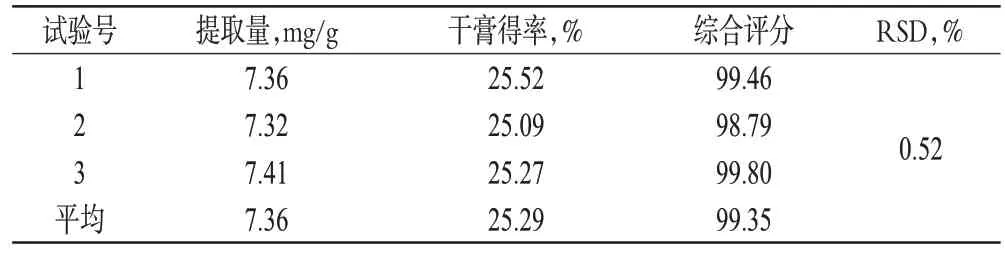
表4 验证试验结果Tab 4 Results of verification test
由表4可知,所优选出的提取工艺合理、稳定。
3 讨论
目前,恰玛古中硫代葡萄糖苷提取工艺主要选择高温水煎煮[11],而在此条件下,硫代葡萄糖苷极易发生降解,引起成分变化[12];并且之前有关工艺研究仅以硫代葡萄糖苷提取量为指标,未考虑提取条件对干膏得率的影响。因此,本研究在前期研究的基础上,首先采用乙醇为提取溶剂,可以避免硫代葡萄糖苷在水提取过程中的降解损失问题;其次,本研究以恰玛古中硫代葡萄糖苷提取量和干膏得率的综合评分为指标,指标更全面、合理。
恰玛古是新疆特色药用植物资源,具有丰富的营养成分、显著的保健作用、独特的临床效果和重要的经济价值,应用前景广阔[1-2]。当然,通过本工艺得到的是硫代葡萄糖苷粗提取物,故更进一步的研究是对硫代葡萄糖苷进行精制,或是对硫代葡萄糖苷及其他试验条件等进行筛选,以进一步优化提取条件、提高提取效率,为开发以恰玛古中硫代葡萄糖苷为药用成分的系列产品提供优质原料。
[1]王丽萍,王航宇,谭勇,等.维药恰玛古的研究进展[J].农垦医学,2012,34(6):525.
[2]李巧娟,肖春霞,张洪亮.维药恰玛古的研究现状[J].新疆中医药,2010,28(6):81.
[3]孙艳,安熙强,马媛,等.恰玛古蜜膏对小鼠免疫功能的影响[J].中国医药导报,2010,7(6):20.
[4]卫生部药典委员会.中华人民共和国卫生部药品标准:维吾尔药分册[S].乌鲁木齐:新疆科技卫生出版社,1999:36.
[5]季宇彬,武晓丹,邹翔.硫代葡萄糖苷的研究[J].哈尔滨商业大学学报:自然科学版,2005,21(5):550.
[6]罗丽娜.硫代葡萄糖苷水解产物抗肿瘤作用的研究[D].武汉:华中科技大学,2007:44.
[7]杨洪升,王长宝,王长平,等.光果葶苈中硫代葡萄糖苷的提取工艺研究[J].黑龙江医药科学,2014,37(4):39.
[8]李锋,张春雷.芸薹属植物的生防作用[J].中国油料作物学报,2006,28(1):97.
[9]王宁惠.油菜籽(饼粕)中硫代葡萄糖苷总量速测方法-氯化钯法[J].青海农林科技,2009,12(3):58.
[10]黄继英,王绥璋,李素梅.氯化钯-分光光度法测定油菜籽硫苷含量的研究[J].西北农林科技大学学报:自然科学版,1995,23(6):104.
[11]王菁,白晓光,海力茜·陶尔大洪.新疆芜菁中硫代葡萄糖苷提取工艺条件的优化[J].西北药学杂志,2013,28(3):237.
[12]修丽丽,钮昆亮.十字花科植物中的硫代葡萄糖苷及其降解产物[J].浙江科技学院学报,2004,16(3):187.
