白藜芦醇-泊洛沙姆188固体分散体的制备及其性能研究
2015-03-09任红暖王晓丽陈肖如陈丽萍周婷婷高振珅宋兴良临沂大学药学院山东临沂276005临沂大学现代中药研究所山东临沂276005临沂大学化学化工学院山东临沂276005山东省资源与环境分析化学重点实验室山东临沂276005
任红暖,王晓丽,陈肖如,陈丽萍,周婷婷,高振珅,2#,宋兴良(.临沂大学药学院,山东 临沂 276005;2.临沂大学现代中药研究所,山东临沂 276005;3.临沂大学化学化工学院,山东临沂 276005;4.山东省资源与环境分析化学重点实验室,山东临沂 276005)
白藜芦醇(RES)是一种非黄酮类多酚化合物,具有抗氧化、抗炎、抗癌、心血管保护、神经系统保护以及延长低等生物寿命等多种生理活性[1]。RES 在水中的溶解度低,常用乙醇、二甲基亚砜等溶剂溶解,但使用这些溶剂制备的RES 溶液对体外培养的细胞和对体内细胞都会产生不利的影响。由于RES 溶解度低、生物利用度低、水溶液稳定性差,限制了其在制药领域中的应用[2]。目前,已有研究报道,将其制成纳米粒、包合物、改性葡聚糖结合物等来提高其溶解度、稳定性[2-4]。泊洛沙姆188(P188)是一种非离子型高分子表面活性剂,在药物制剂中主要用作乳化剂和增溶剂,也是常用的载体材料之一。笔者拟以P188为载体材料,制备白藜芦醇-P188固体分散体(RES-P188-SD),从而提高RES 的溶解度,改善RES 的溶出性能和抑菌性,达到增强药效的目的,以期为RES新制剂的开发及应用提供参考。
1 材料
1.1 仪器
TU-1810 紫外-可见分光光度计(北京普析通用仪器有限责任公司);S3400 扫描电镜(日本日立公司);ZRS-8G 释放仪(天津鑫洲科技有限公司);DZF-6021真空干燥箱(上海一恒科技有限公司);SW-CJ-2FD 净化工作台(上海龙跃仪器设备有限公司);XFS-280A高压蒸汽灭菌锅(上海新丰医疗器械有限公司);SPX-400B 生化培养箱(上海博讯实业有限公司)。
1.2 药品与试剂
RES 原料药(南京泽朗医药科技有限公司,批号:20141010,纯度:>98%);RES 对照品(中国食品药品检定研究院,批号:111535-200502,纯度:≥98%);P188(德国Basf 公司,批号:WPMG557C);其余试剂均为分析纯。
1.3 菌种
大肠埃希菌ATCC 29523、金黄色葡萄球菌ATCC 29213由临沂大学现代中药研究所提供。
2 方法与结果
2.1 RES分析方法的建立
2.1.1 测定波长选择 取RES 对照品适量,用无水乙醇溶解并制备成适宜质量浓度的RES 对照品溶液;按处方比例称取空白辅料,用无水乙醇制备成适宜质量浓度的辅料对照溶液,0.45 μm 微孔滤膜滤过,在200~500 nm 波长范围内紫外扫描。结果,RES对照品溶液在305 nm波长处有最大吸收,且辅料在此处无干扰,故选择305 nm为测定波长。
2.1.2 标准曲线的制备 精密称定干燥至恒质量的RES对照品0.01 g,置于100 ml 棕色量瓶中,用无水乙醇溶解并定容至刻度,制备成质量浓度为0.1 mg/ml的RES对照品贮备液。分别量取RES对照品贮备液0.2、0.4、0.6、0.8、1.0 ml于10 ml棕色量瓶中,用无水乙醇稀释并定容至刻度,制备成质量浓度为0.002、0.004、0.006、0.008、0.010 mg/ml 的RES 对照品系列溶液。分别在305 nm 波长处测定吸光度(A),以A为纵坐标、质量浓度(c,mg/ml)为横坐标绘制标准曲线,得标准曲线方程为A=0.118 6c-0.017 7(r=0.999 7,n=5)。结果显示,RES 检测质量浓度线性范围为0.002~0.010 mg/ml。
2.1.3 精密度试验 量取质量浓度为0.006 mg/ml RES的对照品溶液,在305 nm波长处测定A,同日内连续测定5次,考察日内精密度;每日测定1 次,连续测定5 d,考察日间精密度。结果,日内和日间精密度的RSD分别为0.14%、0.75%(n=5),表明该方法精密度良好。
2.1.4 方法回收率试验 量取对照品贮备液6、8、10 ml,各取3份,共9份,分别置于100 ml量瓶中,按照处方比例精密称取辅料并分别加入量瓶中,加入5 ml pH为6.8的磷酸盐缓冲液,再用无水乙醇定容至刻度,摇匀后,0.45 μm微孔滤膜滤过,即得相应质量浓度的对照品溶液。于305 nm 波长处测定A,计算方法回收率。结果,平均回收率为100.5%(RSD=0.57%,n=9),表明该方法准确度较好。
2.2 RES-P188-SD的制备
称取RES 原料药1 g 于蒸发皿中,加无水乙醇适量,使其充分溶解。称取处方量的P188 于蒸发皿中,用乙醇溶解并与RES原料药混合均匀,于恒温水浴中挥干乙醇,置于60 ℃干燥箱中干燥,粉碎,过80目筛,即得。
2.3 RES和P188物理混合物的制备
按照最佳方案的药物与载体的质量比,分别精密称取RES原料药、P188于研钵中,混匀,过80目筛,即得。
2.4 溶解度的测定[5]
取过量的RES 原料药和RES-P188-SD 分别置于25 ml 具塞三角烧瓶中(避光),分别加入5 ml 蒸馏水,在温度为(25±1)℃下恒温振荡24 h,制成过饱和溶液。待达到溶解平衡后,取上清液用0.45 μm 的微孔滤膜滤过,取续滤液,用适量蒸馏水稀释后,采用紫外吸收法在305 nm波长处测定A,分别计算RES和RES-P188-SD在水中的溶解度。
2.5 溶出度测定
参照2010年版《中国药典》(二部)附录ⅩC项下溶出度测定第一法(篮法)测定溶出度[6]。将RES原料药、RES与P188的物理混合物和RES-P188-SD(相当于RES 原料药15 mg)分别均匀分散于温度为(37±0.5)℃、体积为900 ml、pH 6.8 的磷酸盐缓冲液中,设置转速为100 r/min,分别在5、10、15、30、60、90、120 min时通过玻璃管过滤器(0.45 μm微孔滤膜)定位定时吸取10 ml 溶出液(同时补充同温新鲜缓冲溶液10 ml),滤过。取续滤液5 ml,置于10 ml棕色量瓶中,放至室温,适当稀释后,于305 nm波长处测定A,计算累积溶出度。
2.6 单因素试验考察
2.6.1 熔融温度的考察 预试验中按照RES原料药与P188的质量比为1 ∶2制备RES-P188-SD,蒸发溶剂的温度分别设定在60、70、80、90 ℃。结果RES 收率(收率=收得量/投料量×100%)分别为92.15%、89.50%、89.19%、89.82%。60 ℃时熔融时间较长,70 ℃时熔融速度较快,而80 ℃和90 ℃时熔融迅速,随温度的升高,熔融用时缩短,收率也有所降低。
2.6.2 药载比的考察 分别以RES原料药与P188的质量比为1 ∶1、1 ∶3、1 ∶5、1 ∶7、1 ∶9,在70 ℃下熔融,制备RES-P188-SD,观察其性状并测定收率。结果显示,RES-P188-SD 干燥后呈暗黄胶态,表面泛油光;随着P188 质量的增加,固体分散体干燥的时间越短,干燥的效果越好(不同比例下RES收率分别为68.87%、71.11%、82.80%、88.23%、88.59%)。
2.6.3 筛网目数的考察 分别以RES原料药与P188的质量比为1 ∶1,在70 ℃下熔融,分别过18 目、40 目、80 目筛,制备RES-P188-SD,测定收率。结果显示,收率分别为75.80%、74.23%、73.01%。
2.7 正交试验设计
为获得较优的试验条件,根据预试验及单因素试验结果,以药物RES 与载体P188 质量比(A)、熔融温度(B)、筛孔目数(C)为考察因素,按L9(34)正交表进行试验,以RES-P188-SD的溶解度(x)和收率(y)为考察指标,以两者的综合评分(Z)进行结果分析,优选最优制备工艺。评分总分为100分,x、y分别为50分(Z=xi/xmax×50+yi/ymax×50)。因素与水平见表1,正交试验结果见表2,方差分析结果见表3。
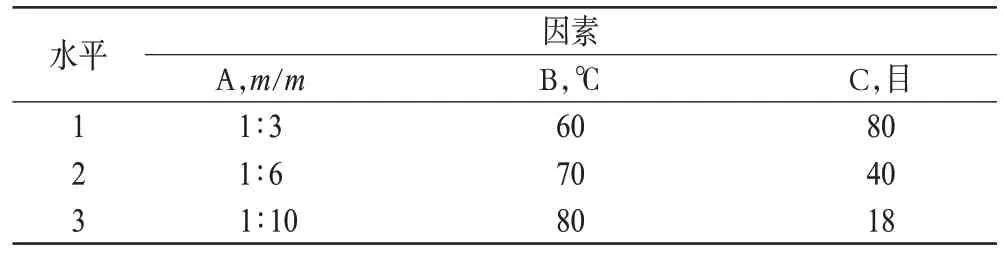
表1 因素与水平Tab 1 Factors and levels
通过直观分析和方差分析可知A3>A2>A1,B2>B3>B1,C1>C3>C2,各因素对试验结果影响的大小顺序为C>A>B。由此可以得最优工艺条件为A3B2C1,即药物与载体质量比为1∶10、熔融温度为70 ℃、筛孔目数为80目。

表2 正交试验结果Tab 2 Results of orthogonal test
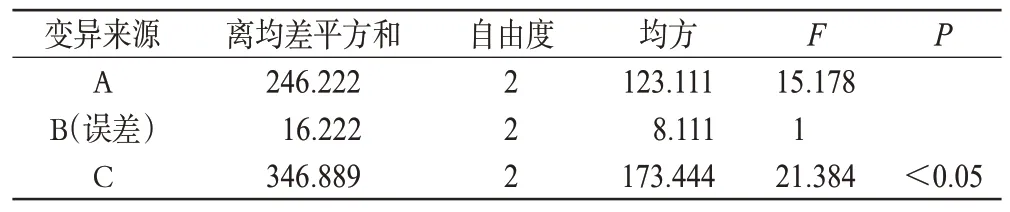
表3 方差分析结果Tab 3 Results of variance analysis
2.8 验证试验
按最优工艺条件制备3 批RES-P188-SD样品。结果,3批RES-P188-SD 的溶解度分别为0.51、0.52、0.50 mg/ml,平均溶解度为0.51 mg/ml(RSD=1.96%,n=3);收率分别为91%、90%、91%,平均收率为91%(RSD=0.64%,n=3);15 min 累积溶出度分别为83%、84%、83%,平均累积溶出度为83%(RSD=0.69%,n=3),表明优化的处方和工艺合理、稳定。
2.9 扫描电镜分析物相表面特征
真空镀金70 s,用扫描电镜观察RES 原料药、载体材料P188、RES 与P188 的物理混合物以及RES-P188-SD 的表面和晶体结构。结果,RES 原料药与RES-P188-SD 的表面结构完全不同,RES 以大小不一的结晶体存在,P188 以非晶形存在;RES 与P188 的物理混合物为晶体和非晶体的混合物;而RES-P188-SD 中已经没有晶体存在,即表明RES 以非晶形态均匀分散在载体P188 中,形成了RES-P188-SD。电镜扫描图见图1。
2.10 抑菌试验[7]
2.10.1 菌悬液的制备 将各试验菌种(大肠埃希菌、金黄色葡萄球菌)活化后,用生理盐水制备菌悬液,并用麦氏比浊管比浊,制成浓度为108CFU/ml的菌悬液,备用。
2.10.2 药物分组 将“2.2”项下所制备的RES-P188-SD 用蒸馏水稀释至质量浓度为0.20 mg/ml,作为试验组;用蒸馏水制备RES原料药饱和水溶液,取上清液适量(相当于质量浓度为0.03 mg/ml),作为对照组。121 ℃高压灭菌20 min,置4 ℃冰箱中贮藏,备用。

图1 扫描电镜图A.RES原料药;B.P188;C.RES与P188物理混合物;D.RES-P188-SDFig 1 Scanning electron microscopy figuresA.crude resveratrol;B.poloxamer 188;C.physical mixture of resveratrol and poloxamer 188;D.resveratrol-poloxamer 188-solid dispersion
2.10.3 抑菌试验 采用管碟法将灭菌后的营养琼脂培养基加热融化,冷却至55 ℃左右,制备平板。取“2.10.1”项下制备的菌悬液0.3 ml,按“2.10.2”项下分组,用L型玻璃棒均匀涂在平板上,均匀放置3 个牛津杯,每个加入药物溶液0.2 ml,置37 ℃培养箱中培养18~24 h 后,测量抑菌圈直径。根据抑菌圈直径(mm)确定敏感性:抑菌圈直径小于10 mm 为耐药,10~15 mm 为中度敏感,15 mm 以上为高度敏感[8]。结果显示,RES饱和水溶液对金黄色葡萄球菌表现出耐药(抑菌圈直径为3 mm),对大肠埃希菌无抑制作用;RES-P188-SD 水溶液对金黄色葡萄球菌呈高度敏感(抑菌圈直径为17 mm),对大肠埃希菌呈中度敏感(抑菌圈直径为11 mm)。
3 讨论
本试验以P188 为载体,采用溶剂熔融法制备了RES-P188-SD。与RES原料药相比,RES-P188-SD溶解度提高了近17 倍(RES 原料药溶解度为0.03 mg/ml)。在pH 6.8 磷酸盐缓冲液中,RES 15 min累积溶出度仅为12%,物理混合物达39%,而RES-P188-SD 则达83%以上。可见,制成RES-P188-SD后显著提高了RES的溶解度和溶出速率。焦艳等[9]曾以聚乙烯吡咯烷酮为载体制备RES 固体分散体,其溶解度为0.23 mg/ml,人工胃液中2 h累积溶出度为88%。可见,P188和聚乙烯吡咯烷酮均对RES的溶解度和溶出度有所改善,但P188的改善作用更加明显。同时抑菌性试验结果表明,RES-P188-SD具有抑菌活性。
[1]Atanacković M,Gojković-Bukarica L,Cvejić J.Improving the low solubility of resveratrol[J].BMC Pharmacology and Toxicology,2012,13(1):1.
[2]Francioso A,Mastromarino P,Restignoli R.Improved stability of trans-resveratrol in aqueous solutions by carboxymethylated(1,3/1,6)-β-d-glucan[J].Agric Food Chem,2014,62(7):1 520.
[3]胡荣,罗先钦,秦伟瀚,等.正交试验优选白藜芦醇微囊处方[J].中国药房,2013,24(47):4 449.
[4]王慧竹,陈帅,薛健飞.正交试验法优化白藜芦醇包合物的制备工艺[J].吉林化工学院学报,2014,31(1):26.
[5]晋晨晨,李瑾,马澜,等.葛根素及其纳米混悬剂平衡溶解度测定[J].亚太传统医药,2014,10(11):42.
[6]国家药典委员会.中华人民共和国药典:二部[S].2010年版.北京:中国医药科技出版社,2010:附录86-87.
[7]张新娟,左国营,张云玲,等.20 种滇东南中草药体外抗菌活性筛选[J].解放军药学学报,2012,28(6):481.
[8]夏美玲,吕丽艳,刘野,等.5种中草药体外抑菌实验的研究[J].齐齐哈尔医学院学报,2009,30(24):3 024.
[9]焦艳,任红暖,袁堂娟,等.白藜芦醇固体分散体的制备及其性质研究[J].中药材,2014,37(3):517.
