阿苯达唑纳米混悬液的冻干工艺优化
2015-03-09任洁如马运芳王建华新疆医科大学基础医学院乌鲁木齐830054新疆医科大学第一附属医院乌鲁木齐830054
任洁如,马运芳,王建华#a,陈 迹#b(1.新疆医科大学基础医学院,乌鲁木齐 830054;.新疆医科大学第一附属医院,乌鲁木齐 830054)
阿苯达唑(Albendazole)是一种广谱抗寄生虫药,被世界卫生组织(WHO)推荐为抗包虫病的主要药物之一,近年来越来越多地使用于临床,其疗效得到了较为广泛的认可[1]。但是阿苯达唑的水溶性差,肠道吸收率、体内血药浓度、生物利用度均较低,因此严重制约了阿苯达唑的推广应用[2]。本课题组前期通过液相沉淀法制备了阿苯达唑纳米混悬液,但纳米混悬液长期贮存稳定性不佳,即药物长期在液体环境中可发生沉降、聚集、降解、变性等各种不稳定现象。为提高其贮存稳定性,笔者采用冷冻干燥技术对纳米混悬液进行干燥制得阿苯达唑纳米微粉,显著提高了其常温放置稳定性。但在冻干过程中,预冻温度、冻干保护剂的种类与质量分数会对其稳定性产生影响。为此,本研究主要以阿苯达唑纳米微粉的粒径、Zeta电位为评价指标对上述因素进行考察,旨在确定最佳冻干工艺。
1 材料
1.1 仪器
LG10-2.4A 高速离心机(北京医用离心机厂);TGL-16B离心机(上海安亭科学仪器厂);JY92-ⅡDN 超声波细胞粉碎机(宁波新芝科技股份有限公司);ZEN3690 激光粒度分布仪(英国Malvern公司);FD5-6P冷冻干燥机(美国SIM公司)。
1.2 药品与试剂
阿苯达唑原料药(广西桂林南药股份有限公司,批号:M-D60605,纯度:>99%);冰醋酸(台山市新宁制药有限公司,批号:20120209);聚丙烯酸钠(美国Sigma-Aidrich公司,批号:20060810);泊洛沙姆188(P188,南京威尔化工公司,批号:20060401);聚山梨酯80(天津市福晨化学试剂厂,批号:20090207);葡萄糖(天津市盛奥化学试剂有限公司,批号:20100407);麦芽糖(上海蓝季科技发展有限公司,批号:20120812);蔗糖、乳糖(天津市天新精细化工开发中心,批号:20031022、20030612);海藻糖(国药集团化学试剂有限公司,批号:F20061214);甘露醇(天津永晟精细化工有限公司,批号:20000318);木糖醇、山梨醇(天津市光复精细化工研究所,批号:20090318、20090605);甘氨酸(美国Amresco公司,批号:20101206458),以上试药均为分析纯;水为去离子水。
2 方法与结果
2.1 阿苯达唑纳米混悬液的制备[3]
采用液相沉淀法,称取处方量的阿苯达唑原料药粉,用冰醋酸将其完全溶解,制得阿苯达唑的冰醋酸溶液。同时制备含有聚丙烯酸钠和P188的混合溶液,在超声和搅拌的条件下,将此混合溶液快速加入阿苯达唑的冰醋酸溶液中,得到阿苯达唑纳米混悬液。
2.2 冻干工艺制备阿苯达唑纳米微粉
将“2.1”项下制得的阿苯达唑纳米混悬液,在离心半径5 cm(下同)、10 000 r/min的条件下离心,取出离心产品,加入冻干保护剂,于低温冰箱中预冻后冷冻干燥;待其完全干燥后得阿苯达唑纳米微粉,置于干燥器中避光保存。
2.3 粒径与Zeta电位的测定
精密称取阿苯达唑纳米微粉2 mg 于10 ml 量瓶中,加入10 μl 的10%聚山梨酯80 溶液复溶,超声5 min 后用蒸馏水定容至刻度,续超声30 min。取5 ml 分散溶液于超声波细胞粉碎机上强超声5 min,采用ZEN3690激光粒度分布仪测定强超声后阿苯达唑纳米微粉的粒径和Zeta电位。
测定复溶后的阿苯达唑纳米微粉粒径,粒径较小者为佳。带负电荷的微粒易被肝细胞摄取。通常Zeta电位绝对值越高,其粒子间的静电斥力越大,体系越不容易发生聚集,物理稳定性越好,越易被肝细胞摄取而靶向于肝部。Zeta电位绝对值超过30 mV 被认为是静电稳定的纳米混悬液,但过大会有细胞毒性[4-6]。
2.4 外观评价
观察阿苯达唑纳米微粉的外观,以表面松散多孔、色泽一致为佳。
2.5 统计学处理
利用SPSS 17.0 统计软件对数据进行处理。数据用均数±标准差()表示,采用单因素方差分析。检验标准α=0.05,P<0.05为差异有统计学意义。
2.6 冻干工艺优化
2.6.1 预冻温度 为防止真空升华时产生喷瓶或鼓泡等现象,预冻温度必须过冷。文献[7]报道至少要确保在体系共熔点温度以下,产品才能完全冻结实。故本试验分别考察-20、-35、-80 ℃下预冻12 h,解析干燥和升华干燥条件相同,不同预冻温度对阿苯达唑纳米微粉的影响,结果见表1。
表1 不同预冻温度对阿苯达唑纳米微粉的影响(,n=3)Tab 1 Effects of different pre-freezing temperatures on albendazole nanometer powder(,n=3)

表1 不同预冻温度对阿苯达唑纳米微粉的影响(,n=3)Tab 1 Effects of different pre-freezing temperatures on albendazole nanometer powder(,n=3)
由表1 可知,在-20、-35、-80 ℃预冻制得的样品各评价指标差异均无统计学意义(P>0.05),均能得到较好预冻效果。从节能的角度考虑,选择预冻温度为-20 ℃。
2.6.2 单一冻干保护剂 精密称取10份阿苯达唑混悬液离心后的沉淀,于沉淀中分别加入9种常用的冻干保护剂(葡萄糖、蔗糖、乳糖、麦芽糖、海藻糖、木糖醇、甘露醇、山梨醇、甘氨酸),固定其质量分数为4%,另取1份为不加冻干保护剂的空白对照,解析干燥和升华干燥条件相同,以粒径、Zeta电位、外观为指标,考察不同种类冻干保护剂对阿苯达唑纳米微粉的影响,结果见表2(“+++”表示表面松散多孔,为均匀乳白色且色泽均一;“++”表示表面松散多孔,色泽不均一,乳白色表面有少量黄色斑块;“+”表示表面较松散,色泽不一,乳白色表面有大量黄色斑块)。
表2 不同冻干保护剂对阿苯达唑纳米微粉的影响(,n=3)Tab 2 Effects of different cryoprotectants on albendazole nanometer powder(,n=3)

表2 不同冻干保护剂对阿苯达唑纳米微粉的影响(,n=3)Tab 2 Effects of different cryoprotectants on albendazole nanometer powder(,n=3)
由表2 可知,冻干保护剂对冻干产品均有较好的保护作用,在相同实验条件下,分别加入葡萄糖和甘露醇后的冻干品粒径较小且Zeta电位绝对值较高。甘露醇作为单一冻干保护剂,可以使冻干产品获得较好的外观,表面松散多孔。加入葡萄糖冻干后的产品却不具备良好的外观,表面有少量黄色斑块。而且一般不单独使用单糖作为冻干保护剂,将其与其他冻干保护剂联用效果更好。因此,笔者考虑将葡萄糖和甘露醇联用并考察两者的配比,以期实现满意的冻干效果。
2.6.3 两种冻干保护剂的配比 精密称取阿苯达唑纳米混悬液离心后的沉淀,固定冻干保护剂质量分数为4%,预冻温度为-20 ℃,解析干燥和升华干燥条件相同,以粒径和Zeta电位为指标,分别考察葡萄糖-甘露醇按不同配比(1 ∶9、2 ∶8、3 ∶7、4 ∶6、5 ∶5、6 ∶4、7 ∶3、8 ∶2、9 ∶1)组合后对阿苯达唑纳米微粉的影响,结果见表3。
表3 葡萄糖与甘露醇不同配比对阿苯达唑纳米微粉的影响(,n=3)Tab 3 Effects of different ratios of glucose to mannitol on albendazole nanometer powder(,n=3)
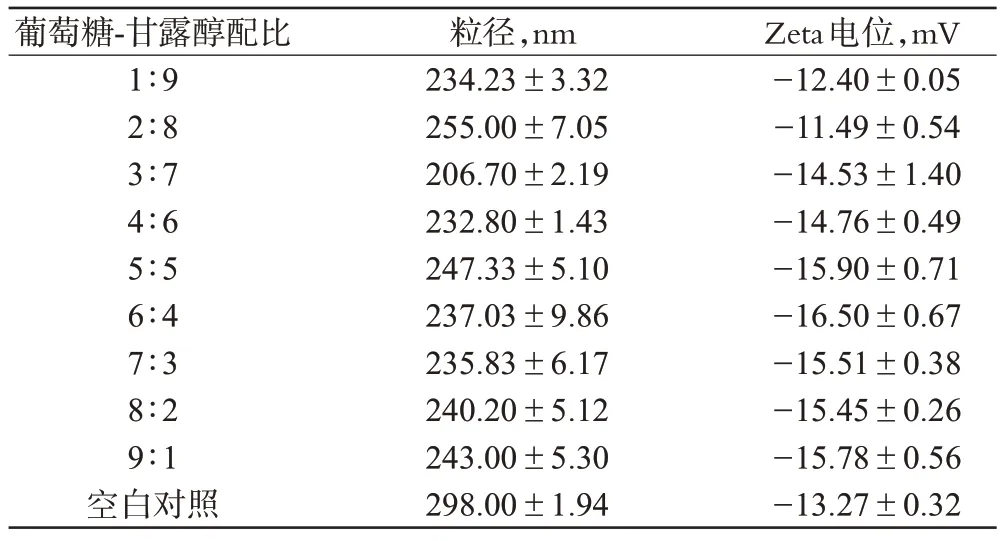
表3 葡萄糖与甘露醇不同配比对阿苯达唑纳米微粉的影响(,n=3)Tab 3 Effects of different ratios of glucose to mannitol on albendazole nanometer powder(,n=3)
由表3 可知,葡萄糖-甘露醇配比为3 ∶7 时所制冻干产品的粒径最小。因此,最后确定以葡萄糖-甘露醇配比为3 ∶7 作为冻干保护剂的最佳配比。
2.6.4 冻干保护剂质量分数 精密称取阿苯达唑纳米混悬液离心后的沉淀,以葡萄糖-甘露醇(3 ∶7)为冻干保护剂,预冻温度为-20 ℃,解析干燥和升华干燥条件相同,分别考察不同质量分数(0、2%、4%、8%、12%、16%)冻干保护剂对阿苯达唑纳米微粉冻干的影响,结果见表4。
表4 不同质量分数冻干保护剂对阿苯达唑纳米微粉的影响(,n=3)Tab 4 Effects of different mass concentrations of cryoprotectants on albendazole nanometer powder(,n=3)

表4 不同质量分数冻干保护剂对阿苯达唑纳米微粉的影响(,n=3)Tab 4 Effects of different mass concentrations of cryoprotectants on albendazole nanometer powder(,n=3)
由表4可知,当冻干保护剂质量分数为4%时,冻干产品粒径、Zeta电位为最佳,复溶性较好,因此确定冻干保护剂质量分数为4%。
2.7 验证试验
最终筛选出最佳冻干处方:预冻温度为-20 ℃,冻干保护剂为葡萄糖-甘露醇(3 ∶7),其质量分数为4%。取阿苯达唑纳米混悬液,按最佳处方平行冻干5 份阿苯达唑纳米微粉,测定其粒径、Zeta电位。结果,所制阿苯达唑纳米微粉的粒径均较小,平均粒径为(208.03±2.13)nm,RSD 为1.02%(n=5);平均Zeta电位为(-15.53±0.18)mV,RSD为1.13%(n=5)。
3 讨论
冷冻干燥,是指先将湿物料的水分在低温下冻结成固态的冰,然后在真空条件下,使冰升华为水蒸气,再用真空系统的捕水器将水蒸气冷凝,从而获得干燥制品的技术[8]。具体分为3 个过程:预冻、升华干燥和解析干燥[9]。因为仪器设备原因,本实验尚不能调节解析干燥和升华干燥的条件,故本次实验仅对预冻温度进行了考察。纳米混悬液属于热力学不稳定体系,冻干制剂特有的疏松多孔结构可以使药物重新吸水而恢复活性,而且冻干制剂含水量低,易长期稳定保存[10]。冷冻干燥是一个复杂的物理化学变化过程[11],冻干保护剂的选择或浓度控制不当会使冻干产品外观致密、不易复溶[12]。故本实验从预冻温度和冻干保护剂的角度对冻干工艺进行了考察,以便更好地提高其贮存稳定性。
本文研究了阿苯达唑纳米混悬液的冻干工艺,结果表明,未加冻干保护剂的冻干粉粒径较大,且冻干过程中易于沸腾和鼓泡,较不稳定。而本实验选用的冻干保护剂溶解度大、浓度较低,溶解后呈均一溶液状态(粒子直径<1 nm),在ZEN3690 激光粒度分布仪上无法测出粒径,对纳米微粉的粒径测量影响较小。笔者经单因素考察后制备的阿苯达唑纳米微粉不易鼓泡,冻干产品的外观相对松散。通过冻干工艺优化,制得的纳米微粉平均粒径为200 nm左右,Zeta电位等指标较优,工艺简单易行、重现性好;且本品在水中较易分散,再分散性较好,达到了冻干实验的目的。因此为了提高实验效率,没有再选用正交实验等方法。纳米微粉不仅有效提高了阿苯达唑纳米混悬液的稳定性,而且提高了阿苯达唑在水中的溶解度,对阿苯达唑纳米微粉的进一步动物体内实验研究,提供了理论依据。本品有望制成一种新型的阿苯达唑纳米制剂。
[1]魏丽红,张永军,陈卫军,等.阿苯达唑自微乳化释药系统大鼠体内药代动力学的研究[J].农垦医学,2011,33(2):125.
[2]张光宇,晏语,倪进,等.阿苯达唑-壳聚糖微球的制备及其质量指标的考察[J].抗感染药学,2012,9(2):108.
[3]陈迹,马运芳,王建华.阿苯达唑纳米微粉制备工艺研究[J].新疆医科大学学报,2014,37(1):40.
[4]陈玉祥.纳米药物评价技术与方法[M].北京:化学工业出版社,2012:59.
[5]徐红,高萌,张成鸿,等.青藤碱聚乳酸羟基乙酸共聚物-水溶性维生素E 纳米粒的质量评价[J].中国药房,2015,26(7):982.
[6]陈莉,汤忞,陆伟根.纳米混悬剂粒径稳定性及其控制策略[J].世界临床药物,2010,31(4):247.
[7]贾莉,赵辉,刘沛沛.阿霉素脂质体的冻干工艺考察[J].北方药学,2013,10(8):63.
[8]耿锟锟,熊非,朱家壁,等.用于药物制剂的冷冻干燥技术及相关影响因素[J].药学进展,2011,35(3):104.
[9]杨应国,胡小华,庞明.干燥技术在制备纳米粉体中的应用[J].安徽化工,2005,2(34):28.
[10]姚静,张自强.药物冻干制剂技术的设计及应用[M].北京:中国医药科技出版社,2007:2.
[11]武华丽,胡一桥.冷冻干燥制剂的稳定性研究进展[J].中国药学杂志,2001,36(7):436.
[12]Matthew JB,Zhang T,Tanja W,et al.Identification of ancient remains through genomic sequencing[J].Genome Res,2008,18(8):1 347.
