猪源抗体基因的克隆及其在大肠杆菌中的表达
2015-03-09王香玲田华彬姜福成张雪云郭佃磊
王香玲,柴 政,田华彬,符 芳,姜福成,郑 楠,张雪云,郭佃磊,李 曦*
(1.中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室/猪传染病研究室,黑龙江 哈尔滨 150001;2.哈尔滨师范大学 生命科学与技术学院,黑龙江 哈尔滨 150025)
鼠源单克隆抗体(MAb)以及嵌合抗体在人体内会引起人抗鼠抗体反应(HAMA)。重组抗体的操作通过基因融合、突变以及重组基因的表达发展了大量可用于研究、诊断和治疗的基因工程抗体,同时通过基因操作方法可以获得常规MAb 制备技术所不能得到的抗体形式,使之更加适合治疗和诊断。截止到2004 年,经美国FDA 批准的人用重组抗体已有10 多种,目前正在处于研发阶段的重组抗体还有100 多种。基因组学以及蛋白质组学的快速发展,为抗体工程的发展奠定了坚实的基础[1]。
近几年来,研究从单个B 细胞中扩增抗体基因的方法受到关注,这一方法可以获得许多特异性的人源MAb。已有研究证实,利用RT-PCR 可以扩增出单个B 细胞中的重排的重链可变区(VH)和轻链可变区(VL)[2-4],从而制备特异性的重组MAb。本研究根据猪源抗体编码序列设计引物并通过原核表达制备了一种猪源重组抗体,为猪病的防制奠定一定的基础。
1 材料和方法
1.1 质粒及菌株 含有猪源抗体轻链和重链恒定区编码序列的重组质粒pET-pAb-L 和pET-pAb-H 由本实验室构建;pET-28a 载体由本实验室保存;pMD18-T 载体和大肠杆菌(E.coli)DH5α 均购自TaKaRa 公司。
1.2 主要试剂 pfu DNA 聚合酶、FITC 标记的山羊抗猪IgG(IgG-FITC)购自Thermo Fisher 公司;质粒提取试剂盒和凝胶回收试剂盒购自康宁生命科学(吴江)有限公司;反转录酶(M-MLV)、Rnase inhibitor、dNTP、PrimerStar DNA 聚合酶和限制性内切酶均购自TaKaRa 公司;猪淋巴细胞分离液购自天津市灏阳生物制品科技有限责任公司。
1.3 IgG+B 淋巴细胞的筛选 利用猪外周血淋巴细胞分离液分离猪血中的淋巴细胞,计数,将细胞稀释至1×106个/100 μL,在200 μL 细胞中加入2 μL羊抗猪IgG-FTIC,混匀,室温避光孵育20 min,1 000 r/min 离心5 min,PBS 洗涤3 次,经200 μL PBS 重悬细胞,采用流式细胞术进行IgG+B 淋巴细胞分选。
1.4 猪源抗体VH 和VL 基因的扩增
1.4.1 抗体可变区引物设计 抗体可变区是由相对保守的骨架区(FR)和高变区又称互补决定区(CDR)两部分组成(图1)。根据登录的编码猪抗体可变区的序列(U15430 和AF334742),利用Primer5 软件设计引物用于扩增VH 和VL(表1)。可变区扩增采用套式PCR。
利用融合PCR 将抗体各片段连接起来,构成VH+CH+linker+VL+CL 序列。各引物序列见表2。

图1 抗体可变区结构示意图Fig.1 Schematic diagram of antibody variable region
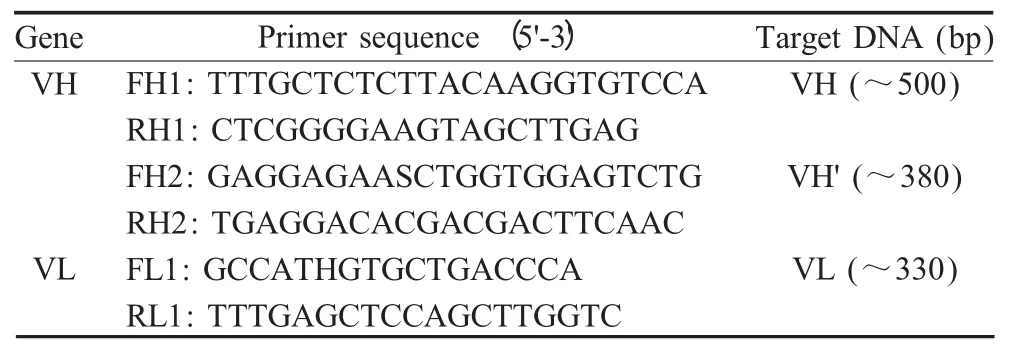
表1 扩增抗体可变区的引物Table 1 Primers for antibody variable region

表2 连接重链和轻链的引物Table 2 Primers for connecting heavy chain and light chain
1.4.2 猪源抗体可变区编码基因的扩增 通过RNA提取试剂盒提取分选的IgG+B 淋巴细胞总RNA,进行反转录制备cDNA,并以其为模板,利用FH1/RH1 引物进行套式PCR 的重链第一轮扩增。PCR 程序:94 ℃5 min;95 ℃45 s、58 ℃50 s、72 ℃55 s,30 个循环;72 ℃10 min。以第一轮产物为模板,利用FH2/RH2 引物进行第二轮扩增,反应程序同上。
利用FL1/RL1 引物,以反转录相同的cDNA 为模板,进行轻链第一轮扩增。反应程序:94 ℃5 min;98 ℃15 s、55 ℃15 s、72 ℃45 s,30 个循环;72 ℃10 min。以扩增产物为模板,利用同样的引物进行第二轮扩增。
将扩增的片段克隆于pMD18-T 载体中进行测序鉴定,利用IMGT-V/QUEST 以及NCBI 对测序的抗体可变区进行分析。
1.5 H-linker-L 全长基因的扩增及重组质粒的构建以构建的含有VH 的VH-6、VH-10 和重链恒定区(CH)的重组质粒为模板,利用HV-f/HV-r 和HC-f/HC-r 两对引物进行PCR 扩增。反应程序:94 ℃5 min;98 ℃15 s、55 ℃15 s、72 ℃45 s,30 个循环;72 ℃10 min。以扩增产物为模板,利用HV-f/HC-r 引物扩增重链全长基因,并进行测序鉴定,分别命名为H-6 和H-10。
以VL 的VL-6 和VL-12 与轻链恒定区(CL)为模板进行重叠延伸PCR(SOE-PCR),序列分别命名为L-6 和L-12。具体PCR 程序参照以上步骤。
利用HV-f/Linker-HC-r、Linker-LV-f/LC-r 和HV-f/LC-r 3 对引物,通过SOE-PCR 进行H 链和L 链的连接。反应程序同上。分别将H-6 和L-6 串联,H-10 和L-12 串联,命名为H-linker-L-6 和H-linker-L-10。并将H-linker-L-6 和H-linker-L-10 序列分别克隆于pET-28a 载体中,构建重组质粒pET-H-linker-L,并进行测序鉴定。
1.6 猪源重组抗体的原核表达及初步鉴定 将pET-H-linker-L 转化BL21 感受态细胞中,通过IPTG进行诱导表达。利用MERCK 蛋白纯化手册方法纯化重组蛋白。将纯化的重组蛋白经SDS-PAGE 检测后,转膜,经5 %脱脂乳封闭,与兔抗猪IgG-HRP(1:10 000)室温孵育1 h,PBST 洗涤3 次后,利用增强型DAB 显色液显色,进行western blot 鉴定。
2 结果
2.1 IgG+B 淋巴细胞的分选 采集猪外周血,经淋巴细胞分离液分离淋巴细胞。利用羊抗猪IgGFITC 标记分离的猪淋巴细胞,通过流式细胞仪分选靶B 淋巴细胞。其中,Q4 为抗猪IgG 标记区域,收集Q4 区域的细胞,即为IgG+B 淋巴细胞(图2)。
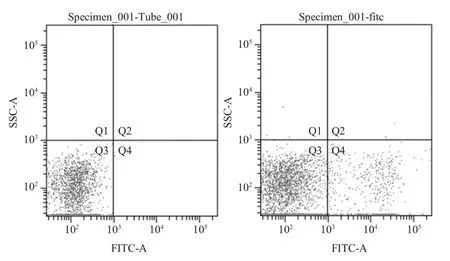
图2 FITC 标记淋巴细胞分选Fig.2 Separation and collection of the FITC labeled lymphocytes
2.2 抗体可变区基因的扩增 以提取分选的IgG+B淋巴细胞总RNA 制备的cDNA 为模板,采用特异性引物对猪源抗体可变区基因进行PCR 扩增,结果显示,扩增片段分别约为380 bp 和330 bp,与预期相符(图3)。

图3 抗体VH 和VL PCR 结果Fig.3 PCR result of antibody VH and VL
2.3 抗体基因序列分析 将扩增片段测序后,分别选择VH-6 和VH-10,VL-6 和VL-12 各两条序列进行分析。将所得的序列与NCBI 数据库进行同源性比较,结果表明,所扩增的基因分别属于猪抗体的VH 和VL,VH-6、VH-10、VL-6 和VL-12 全长分别为381 bp、345 bp、333 bp 和336 bp。利用IMGT/V-QUEST 抗体分析软件分析,结果如表3 所示。
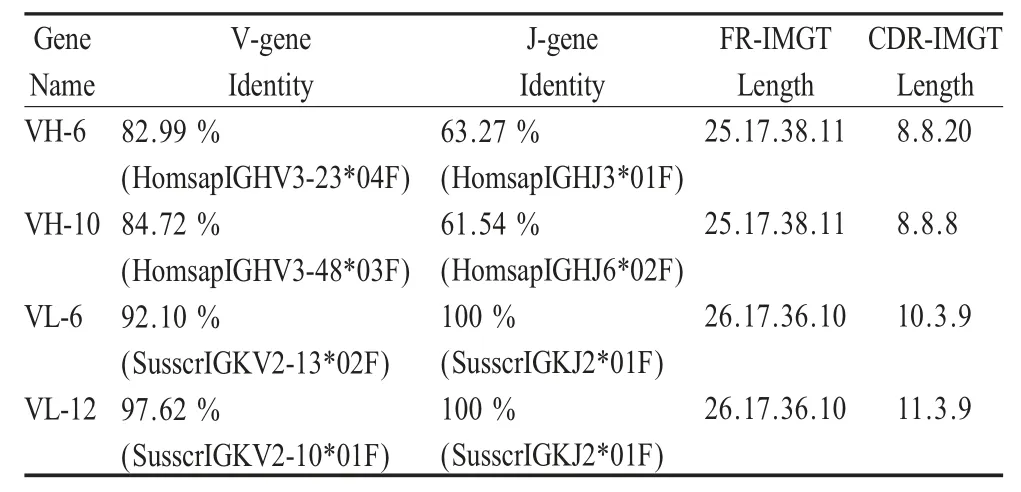
表3 序列分析结果Table 3 The sequence alignment by IMGT/V-QUEST
2.4 H-linker-L 全长基因的扩增 以构建的含有VH 和VL 以及CH 和CL 编码序列的重组质粒为模板,利用SOE-PCR 将VH 和CH、VL 和CL 进行连接,结果显示,扩增得到约为1 300 bp 和700 bp 的目的片段(图4)。以构建的含有H 链和L 链编码序列的重组质粒为模板,利用特异性引物,将H 链和L 链进行连接,扩增到约为2 000 bp 的目的片段(图4)。
2.5 猪源重组抗体的原核表达、纯化及鉴定 将构建的重组质粒pET-H-linker-L 转化BL21 感受态细胞,重组菌经诱导表达后进行SDS-PAGE 检测,结果表明,目的蛋白主要以包涵体的形式表达,由于重组抗体的轻链和重链是通过Linker[(Gly)4Ser]3共价链连接,其分子量约为80 ku。重组蛋白经纯化后,利用兔抗猪IgG-HRP 二抗进行鉴定,结果显示,兔抗猪二抗可以同时识别对照猪IgG 的重链和诱导表达产物,表明表达的目的蛋白为猪源抗体(图5)。
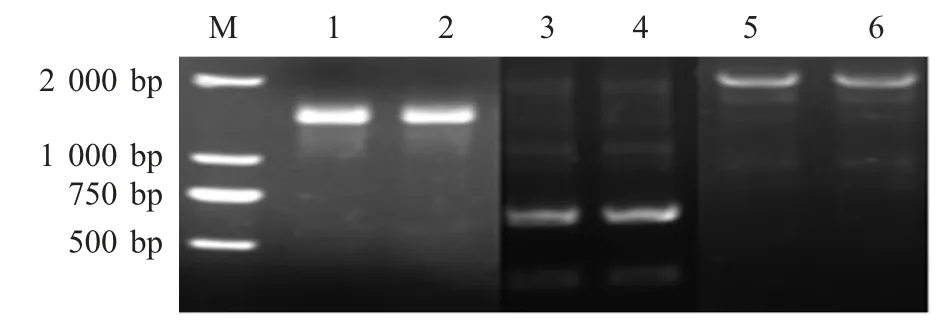
图4 H 链、L 链以及H-linker-L 全长基因的SOE-PCR 结果Fig.4 The amplification of full-length sequence of the H,L and H-Linker-L chain

图5 Western blot 鉴定原核表达抗体与兔抗猪IgG 二抗反应结果Fig.5 The result of western blot identification of prokaryotic expression of antibodies with rabbit
3 讨论
目前,国内外制备人源抗体的方法有许多种,主要为人类抗体片段噬菌体展示文库的建立[5-7]。另外一些方法是从人体内选择自然产生的抗体。科学家们也试图创建产生人源抗体的杂交瘤细胞或者是人源Epstein-Barr 病毒感染的永生化的抗原特异的抗体分泌细胞。近几年来,国外一些科学家致力于研究从人外周血分离的单个B 细胞中克隆抗体的基因,进而表达出人源抗体。这种方法具有高效快速的优点,而且需要的细胞量也非常少[8-10]。
本研究利用流式细胞术分选出外周血淋巴细胞中IgG+B 淋巴细胞,并利用RT-PCR 技术扩增靶B淋巴细胞中的抗体可变区序列,进而将扩增的可变区与猪源抗体恒定区序列连接,构成重组抗体。经原核表达纯化后,western blot 鉴定结果表明构建的重组抗体为猪源重组抗体。另外,利用本研究设计的引物扩增猪源抗原特异性B 细胞内的抗体基因,进而表达出猪源的可以特异结合抗原的重组抗体,为猪病的防制奠定一定的基础。
[1]Jin A,Ozawa T,Tajiri K,et al.A rapid and efficient single-cell manipulation method for screening antigen-specific antibodysecreting cells from human peripheral blood[J].Nat Med,2009,15(9):1088-1092.
[2]Tiller T,Meffre E,Yurasov S,et al.Efficient generation of monoclonal antibodies from single human B cells by single cell RT-PCR and expression vector cloning[J].J Immunol Methods,2008,329(1):112-124.
[3]Volkheimer A D,Weinberg J B,Beasley B E,et al.Progressive immunoglobulin gene mutations in chronic lymphocytic leukemia:evidence for antigen-driven intraclonal diversification[J].Blood,2007,109(4):1559-1567.
[4]Wrammert J,Smith K,Miller J,et al.Rapid cloning of highaffinity human monoclonal antibodies against influenza virus[J].Nature,2008,453(7195):667-671.
[5]Boder E T,Wittrup K D.Yeast surface display for screening combinatorial polypeptide libraries[J].Nat Biotechnol,1997,15(6):553-557.
[6]McCafferty J,Griffiths A D,Winter G,et al.Phage antibodies:filamentous phage displaying antibody variable domains[J].Nature,1990,552-554.
[7]Winter G,Griffiths A D,Hawkins R E,et al.Making antibodies by phage display technology[J].Annu Rev Immunol,1994,12(1):433-455.
[8]Scheid J F,Mouquet H,Feldhahn N,et al.A method for identification of HIV gp140 binding memory B cells in human blood[J].J Immunol Methods,2009,343(2):65-67.
[9]Morris L,Chen Xi,Alam M,et al.Isolation of a human anti-HIV gp41 membrane proximal region neutralizing antibody by antigen-specific single B cell sorting[J].PLoS One,2011,6(9):e23532.
[10]Friedman J,Alam S M,Shen Xiao-ying,et al.Isolation of HIV-1-neutralizing mucosal monoclonal antibodies from human colostrum[J].PLoS One,2012,7(5):e37648.
