黑蜂王台病毒环介导等温扩增检测方法的建立
2015-03-09王向辉隋佳辰宋战昀王振国
王向辉,隋佳辰,张 健,郑 言,杨 倩,宋战昀,王振国,
(1.吉林农业大学 动物科技学院,吉林 长春 130118;2.吉林出入境检验检疫局 检验检疫技术中心,吉林 长春 130062)
蜜蜂黑蜂王台病毒(Black queen cell virus,BQCV)首次发现于死亡的蜂王幼虫和蛹中,春季和初夏多发[1-2],主要引起封盖期蜂王幼虫病害,并被证明是导致澳大利亚蜂王幼虫死亡的最常见的病因[3]。目前针对BQCV 主要的检测技术有:基于发病症状的检测、免疫学检测、显微镜检测、针对核酸序列的检测。前3 种方法由于蜜蜂发病症状复杂、病毒基因具有一定同源性、样本处理复杂且费用昂贵等缺陷,不被广泛使用。而针对核酸序列的检测技术中,RT-PCR 和荧光定量RT-PCR(qRT-PCR)技术被广泛应用,但灵敏度不足和检测耗时长对检测过程产生一定的影响[4-5]。环介导等温扩增技术(Loop-Mediated Isothermal Amplification,LAMP)是在等温条件下进行,具有特异、快速、操作简便等特点[6]。本研究针对BQCV VP 基因保守区设计LAMP 引物,通过加入SYBR Green I 荧光染料[7],建立了可视化的检测BQCV 的LAMP 方法,为BQCV 病原学快速检测提供了技术手段。
1 材料和方法
1.1 病毒株及样品来源 BQCV-JL1 株、蜜蜂残翼病毒(DWV)、蜜蜂囊状幼虫病毒(SBV)、蜜蜂慢性麻痹病毒(CBPV)、蜜蜂急性麻痹病毒(ABPV)均由技术中心动植检实验室保存;被检40 份临床样品采集于部分省份蜂场。
1.2 主要试剂与仪器 SYBR Green I 购自Invitrogen公司;RNA 转录纯化试剂盒和PrimeScriptTMII 1st Strand cDNA Synthesis Kit 购自TaKaRa 公司;质粒pGEM-T easy 和Riboprobe System-T7 体外转录试剂盒购自美国Promega 公司;Omega Biotek 质粒小量提取试剂盒I 型购自广州飞扬生物工程有限公司;DNA LAMP Kit 及LA-320 型LAMP real-time Turbidimeter 仪购自日本荣源株式会社。
1.3 LAMP 引物设计与筛选 根据GenBank 登录的BQCV-JL1 株序列(KP119603.1),选取BQCV 衣壳蛋白VP 基因序列中保守区域,采用Primer Explorer V4 软件设计引物,引物由上海捷瑞生物工程有限公司合成(表1)。
1.4 BQCV 核酸的提取及重组标准质粒的构建 按照TRIzol 法从病料中提取BQCV 总RNA,参照PrimeScriptTMII 1st Strand cDNA Synthesis Kit 说明书反转录制备cDNA,以其为模板,以F3/B3 为引物进行PCR 扩增,反应条件:95 ℃5 min;95 ℃1 min、55 ℃1 min;72 ℃1 min,循环30 次;72 ℃10 min。扩增产物经回收后克隆至pMD18-T 载体中,构建重组质粒pMD-BQCV,提取重组质粒由上海生工生物工程技术服务有限公司测序鉴定,并测定其浓度。
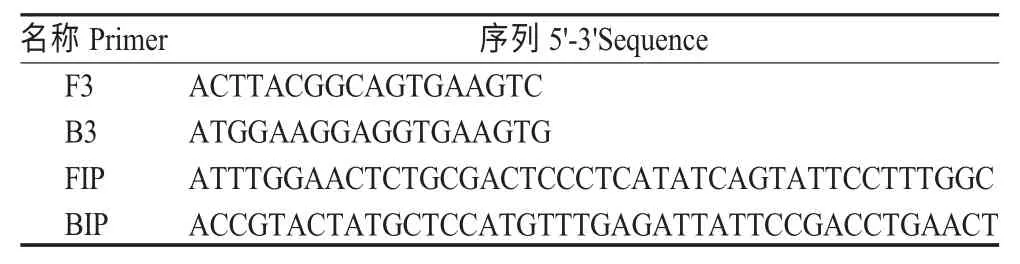
表1 BQCV LAMP 和PCR 检测引物序列Table 1 The LAMP and PCR detection primer sequences
1.5 BQCV LAMP 反应体系的建立及优化 根据DNA LAMP Kit 操作说明,利用以上引物优化BQCV LAMP 反应体系,参考 LAMP real-time Turbidimeter 仪预设参考方案中的标准,设定反应速度曲线峰值超过0.1 时判定为阳性。利用软件监控反应进程,以重组标准质粒为模板,采用不同退火温度(61 ℃、62 ℃、63 ℃、64 ℃、65 ℃)试验,选择最佳退火温度。
1.6 特异性试验 分别提取BQCV-JL1 株、DWV、SBV、ABPV、CBPV 基因组核酸,采用以上5 种核酸为模板,通过优化的反应体系和反应条件进行试验,待反应结束后添加SYBR Green I 5 μL(10 倍稀释),观察阳性管内液体颜色及紫外光照射下呈现荧光情况,检测LAMP 方法的特异性。
1.7 敏感性试验 将回收的PCR 扩增产物克隆于pGEM-T 载体中,构建重组质粒pGEM-BQCV,采用紫外分光光度计测定其浓度,根据公式Y(拷贝/μL)=X(g/μL)DNA×6.02×1023/DNA 长度(bp)×660 换算为拷贝数。重组质粒pGEM-BQCV 经测序鉴定后用限制性内切酶酶切线性化,利用Riboprobe System-T7 试剂盒进行体外转录获得模板RNA,纯化后反转录制备cDNA,并将其进行倍比系列稀释后作为模板进行LAMP 扩增确定其检测的敏感性。
1.8 重复性和稳定性试验 采用同一批次提取的3个不同浓度(4×104拷贝/μL、4×105拷贝/μL、4×106拷贝/μL)BQCV DNA 作为模板进行3 次LAMP 扩增,利用LAMP real-time Turbidimeter 仪分析最大扩增速率,计算变异系数(CV);再选取3 个不同批次提取的BQCV DNA 作为模板进行3 次LAMP 检测,计算CV 值,确定LAMP 方法的重复性和稳定性。
1.9 临床样品的检测 对从部分省份采集的40 份疑似病蜂样品(DNA 提取方法同1.4)进行常规PCR和LAMP 方法检测,并比较两种方法检出率。
2 结果
2.1 LAMP 目的片段的验证与测序分析 以BQCV的RNA 反转录制备的cDNA 为模板,采用引物F3和B3 进行PCR 扩增后经2 %琼脂糖凝胶电泳得到约200 bp 目的片段(图略),大小与预期相符。扩增片段经测序后利用NCBI 中Blast 与GenBank 中KM255693.1、HG779865.1、JX679491.1、JX679489.1、AB746348.1、AB746347.1、JX149518.2、AB723738.1、JN379018.1 进行对比分析,结果显示同源性达100%,表明用该引物可以检测到BQCV。
2.2 LAMP 反应体系的建立及优化 经优化后BQCV LAMP 反应体系见表2,根据得出的LAMP反应体系对退火温度进行优化,结果显示63 ℃为最佳温度。
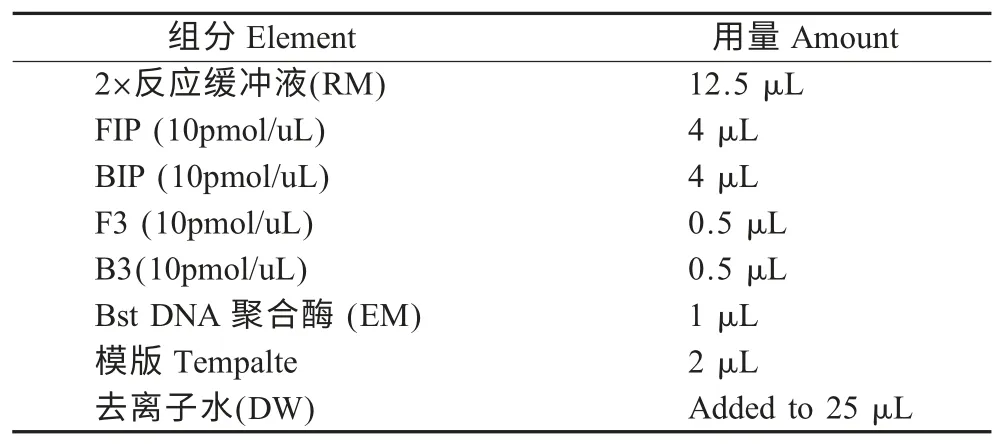
表2 BQCV LAMP 反应体系Table 2 The LAMP reaction system of BQCV
2.3 特异性试验结果 利用建立的LAMP 方法对BQCV-JL1 株、DWV、SBV、CBPV、ABPV 病毒基因组核酸进行检测,结果显示:利用软件监控显示当LAMP Turbidimeter 温度到达63 ℃时,23 min 后仅BQCV-JL1 为阳性,其它样品均为阴性,与普通PCR 检测BQCV 特异性结果一致(图1)。反应结束后加入SYBR Green I 后管内颜色情况、紫外光下产物呈现荧光情况与real-time Turbidimeter 仪检测结果一致,表明该方法具有较好的特异性。
2.4 敏感性试验结果 重组质粒pGEM-BQCV 经紫外分光光度计检测核酸含量为8.91 pg/μL,换算拷贝数为4.0×107拷贝/μL。按照Riboprobe System-T7 试剂盒说明转录合成RNA,反转录制备cDNA,将其进行倍比系列稀释,利用LAMP 进行扩增,并以real-time Turbidimeter LA-320 检测敏感性,结果显示,本实验建立的LAMP 体系检测方法最低检测浓度为4.0×102拷贝/μL,而PCR 最低检测浓度为4.0×104拷贝/μL,LAMP 检测的灵敏度是PCR 检测的100 倍。待反应结束后加入SYBR Green I 后管内颜色情况、紫外光照射下产物呈现荧光情况与real-time Turbidimeter 仪检测结果一致(图2)。表明该方法具有较高敏感性。
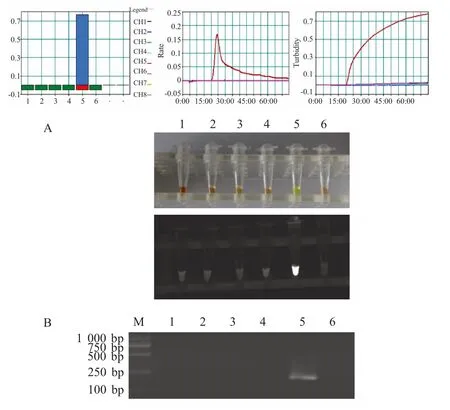
图1 BQCV LAMP 和PCR 特异性试验分析图Fig.1 Specific test of BQCV LAMP(A)and RT-PCR(B)
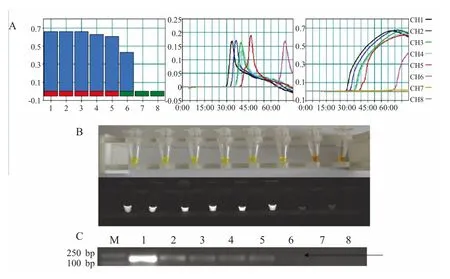
图2 BQCV LAMP 法与PCR 敏感性对比图及LAMP 可视化图Fig.2 BQCV LAMP method and the PCR sensitivity comparison chart and LAMP visualization picture
2.5 重复性和稳定性试验结果 取同一批次不同浓度和不同批次BQCV DNA 为模板进行LAMP 扩增,每个批次3 个重复,结果显示最大扩增速率的CV小于10 %(表3),表明该方法具有较好的重复性和稳定性。
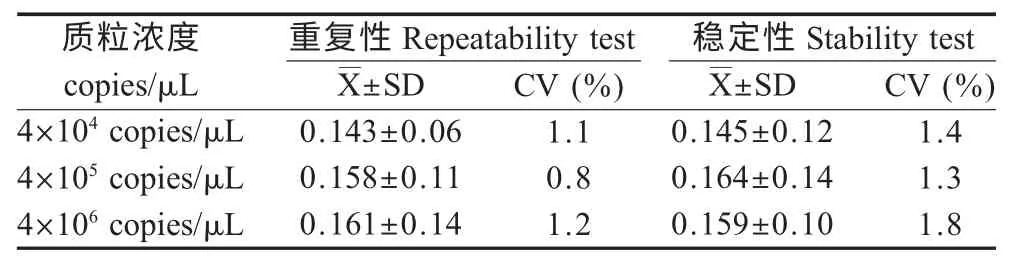
表3 BQCV 重复性和稳定性试验结果Table 3 Repeatability and stability test results for BQCV
2.6 临床样品的检测 采用建立的BQCV LAMP方法与普通PCR 同时检测40 份临床样品,结果显示,普通PCR 检出率为72.5 %(29/40),LAMP 检出率为87.5 %(35/40),LAMP 检出率明显高于常规PCR。表明本实验建立的LAMP 可用于BQCV 临床检测。
3 讨论
本研究利用LAMP real-time Turbidimeter LA-320仪针对BQCV 反应进程进行实时监控建立了BQCV的实时定量LAMP 方法。BQCV 核酸在63 ℃的恒温条件下反应35 min 即可判定结果,反应结束后在扩增产物中加入了SYBR Green I[8]及紫外光下,实现了LAMP 的可视化,使结果更为直观。应用建立的LAMP 法仅BQCV 可见特异性扩增,而DWV、SBV、CBPV、ABPV 均无扩增,表明该方法具有较好的特异性;由于BQCV 为RNA 病毒,在反转录制备cDNA 过程中的效率并不是100 %,将导致严重的系统误差,因此本研究先将目的片段克隆于含有体外转录的T7 或T3 启动子质粒中,并通过紫外分光光度计检测含量,确定其初始拷贝数,再通过体外转录方法获得RNA 片段,以其为模板反转录制备cDNA,倍比稀释检测其敏感性[8],结果显示检出最低限量可达4.0×102拷贝/μL,是普通PCR 的100 倍,通过体外转录过程使得敏感性检测结果更为完善;对同一批次和不同批次样品进行重复性和稳定性试验,最大扩增速率的变异系数均小于10%,说明该方法具有较好的重复性和稳定性;对40 份不同临床样品应用常规PCR 和LAMP 法检测,LAMP法检出率为87.5 %,而普通PCR 检出率为72.5 %,表明该方法准确度高于常规PCR,能有效减少假阴性出现。
LAMP 法只需恒温环境便可对靶序列进行扩增,省时且成本低,较PCR 方法更为快捷和准确,为快速检测BQCV 提供了一定的理论依据。本研究建立了BQCV LAMP 的检测方法,在较短时间便可完成检测,并且检出最低限量比普通PCR 高100 倍,在检验准确度与普通PCR 结果一致的情况下,操作更为简便,为快速检测BQCV 提供了一种方法。
[1]张炫,陈彦平,和绍禹.蜜蜂病毒学研究进展[J].应用昆虫学报,2012,49(5):1095-1116.
[2]Zhang X,He S Y,Evans J D,et al.New evidence that deformed wing virus and black queen cell virus are multi-host pathogens[J].J Invert Pathol,2012,109(1):156-159.
[3]Tapaszti Z,Forgách P,C,et al.First detection anddominance of Nosema ceranae in Hungarian honeybee colonies[J].Acta Vet Hung,2009,57(3):383-388.
[4]张炫,周单银,何绍禹.蜜蜂病毒病的诊断与检测[J].中国蜂业,2012,(63):56-63.
[5]褚艳娜.蜜蜂病毒病检测的研究进展[J].中国蜂业,2014,(65):11-13.
[6]Notomi T,Okayama H,asubuchi H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Res,2000,28(12):E63.
[7]Iwamoto T,Sonobe T,Hayash I K.Loop-mediated isothermal amplification for direct detection of micro bacterium tuberculosis complex,M.avium,and M.intracellulare in sputum samples[J].J Clin Microbiol,2003,41(6):2616-2622.
[8]张锦海,王忠灿,郑纪山,等.H5N1 禽流感病毒抗原基因的体外转录及RNA 标准品构建[J].传染病信息,2011,24(1):26-28.
