西妥昔单抗辅助化疗治疗进展期非小细胞肺癌疗效和安全性的Meta分析
2015-03-09任春丽缪李丽重庆医科大学附属永川医院呼吸内科重庆402160
肖 悦,任春丽,缪李丽(重庆医科大学附属永川医院呼吸内科,重庆 402160)
进展期非小细胞肺癌(Non-small cell lung cancer,NSCLC)早期缺乏典型症状,约40%患者在确诊时已是不能手术切除的转移性Ⅰ期肿瘤[1-2]。对这一患者群而言,系统化疗或酪氨酸激酶抑制剂治疗(特别是对存在肿瘤表皮生长因子受体基因激活突变的患者)是延长生存期、提高生活质量的首选方案[3-8]。一系列的随机试验已经显示,不同组合的方案在NSCLC 的一线治疗中有类似的疗效[7-11]。若在两类药物基础上再增加一类细胞毒性药物,会增加药物毒性而不提高总生存率[8,12-13]。西妥昔单抗是一种对抗表皮生长因子受体(Epidermal growth factor receptor,EGFR)的单克隆抗体。2009年,有研究显示,西妥昔单抗联合顺铂和长春瑞滨在NSCLC一线治疗中可显著提高总生存期[14];但在2010年,1项多中心、开放的Ⅰ期临床试验(BMS099),对比了紫杉醇或多西紫杉醇/卡铂联合西妥昔单抗一线治疗晚期NSCLC的疗效,结果却发现进展生存期和总生存期均没有差异[15]。因此,本文采用Meta分析的方法系统评价了西妥昔单抗辅助化疗对比单纯化疗治疗进展期NSCLC的临床疗效和安全性,以为临床治疗提供循证依据。
1 资料与方法
1.1 纳入/排除标准
1.1.1 研究类型 国内外公开发表的随机对照试验(RCT),无论是否采用盲法。语种限制为中文和英文。
1.1.2 研究对象 ①年龄≥18岁,无性别限制;②经病理确诊为NSCLC;③影像学或其他临床检查确诊为Ⅰ/Ⅰ期NSCLC;④功能状态评分标准(KPS)评分≥60 分或美国东部肿瘤协作组(ECOG)评分为0~2 分;⑤治疗前无化疗禁忌证,患者肝肾功能、血液学、心电图无明显异常。
1.1.3 干预措施 试验组患者给予西妥昔单抗+以铂类为主的化疗方案治疗,对照组患者仅给予以铂类为主的化疗方案治疗,化疗药物为卡铂、顺铂、多西紫杉醇、紫杉醇、吉西他滨、长春瑞滨或培美曲赛等。西妥昔单抗、其他化疗药物的剂量和疗程不限。
1.1.4 结局指标 疗效指标包括1 年生存率、完全缓解率(完全缓解例数/总例数×100%,完全缓解指肿块完全消失、持续时间≥1个月)、部分缓解率(部分缓解例数/总例数×100%,部分缓解指肿块缩小≥50%、持续时间≥1个月)、总有效率[(完全缓解例数+部分缓解例数)/总例数×100%];安全性指标包括贫血发生率、血小板减少发生率、白细胞减少发生率、皮疹发生率、呼吸困难发生率、输液反应发生率、疲乏发生率、呕吐发生率、发热发生率和病死率。
1.1.5 排除标准 排除合并有小细胞肺癌或其他恶性肿瘤、肝肾功能损害者;治疗方案中加入放疗者。
1.2 检索策略
计算机检索Cochrane 图书馆(2014 年第1 期)、PubMed(1966 年1 月-2014 年2 月)、中国期刊全文数据库(1994 年1月-2014 年2 月)、万方数据库(1990 年1 月-2014 年2 月)。检 索 词 包 括:“Cetuximab”“Non small cell lung cancer”“NSCLC”“西妥昔单抗”“爱必妥”。
1.3 资料提取和质量评价
由两位研究者独立提取资料并交叉核对,保证数据的准确性。RCT质量评价参考Cochrane Handbook 5.0.2的标准[16],评价指标包括序列产生、分配隐藏、盲法、不完整数据、选择性报道研究结果和其他偏倚来源6个方面。
1.4 统计学方法
采用Cochrane 协作网提供的Rev Man 5.2 统计软件进行Meta 分析。分类变量采用比值比(OR)及95%可信区间(CI)表示效应量;假设采用χ2检验判断各纳入研究间的异质性。P<0.05 为差异有统计学意义。对各研究间无统计学异质性(P>0.1,I2<50%)的研究,采用固定效应模型分析;反之,采用随机效应模型分析。
2 结果
2.1 纳入研究基本信息
共检索到相关文献274篇,通过阅读文献题目、摘要、全文后,排除非RCT、动物实验、基础研究、重复研究等,最终纳入8篇(项)RCT(中文、英文各4篇),合计2 367例患者[14-15,17-22]。纳入研究患者为57~1 125 例,年龄为18~85 岁,人种包括黄种人[17-20]、白种人[22]、黑种人等[14-15,21]。3 项研究试验组采用西妥昔单抗+顺铂+吉西他滨,对照组采用顺铂+吉西他滨[17-19];3项研究试验组采用西妥昔单抗+顺铂+长春瑞滨,对照组采用顺铂+长春瑞滨[14,20,22];1 项研究试验组采用西妥昔单抗+吉西他滨+顺铂或西妥昔单抗+吉西他滨+卡铂,对照组采用吉西他滨+顺铂或吉西他滨+卡铂[21];1 项研究试验组采用西妥昔单抗+卡铂+紫杉醇或西妥昔单抗+卡铂+多西紫杉醇,对照组采用卡铂+紫杉醇或卡铂+多西紫杉醇[15]。
2.2 方法学质量评价结果
在纳入的8 项RCT 中,4 项研究采用中央互动语音电话系统(Central IVRS)进行恰当的随机分配、分配隐藏及盲法[14-15,21-22],而其余4 项研究因信息不充分而不足以判断是否进行合理的随机分配、分配隐藏及盲法[17-20];5项研究未丢失数据[15,17-18,21-22],3项研究对不完全数据进行恰当的处理[14,19-20]。因信息不充分,8 项RCT 均不能判断是否存在选择性报道结果和其他偏倚[14-15,17-22]。
2.3 Meta分析结果
2.3.1 1 年生存率 4 项研究报道了1 年生存率[14,17,21-22],各研究间无统计学异质性(P=0.45,I2=0),采用固定效应模型分析,详见图1。Meta 分析结果显示,试验组患者1 年生存率显著高于对照组,差异有统计学意义[OR=1.33,95%CI(1.08,1.64),P=0.006]。
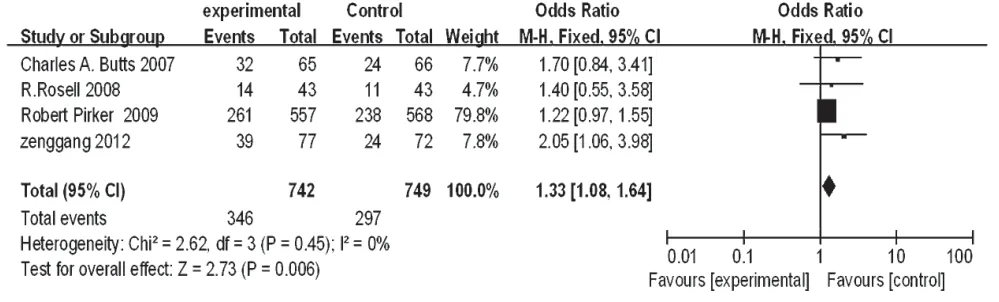
图1 两组患者1年生存率的Meta分析森林图Fig 1 Forest plot of Meta-analysis of survival rate in 1 year in 2 groups
2.3.2 其他疗效指标 两组患者其他各项生存指标及疾病控制指标的Meta分析结果详见表1。

表1 两组患者各项生存指标及疾病控制指标的Meta分析结果Tab 1 Meta-analysis results of survival index and disease control index in 2 groups
2.3.3 不良反应发生率 根据世界卫生组织(WHO)化疗药物毒副反应分级标准,最常见的3级和4级毒副反应包括白细胞减少、血小板减少、疲乏、呕吐、皮疹等,各项不良反应发生率的Meta分析结果详见表2。
2.4 敏感性分析
对生存情况、疾病控制情况、毒副反应里的每篇文献进行了逐一排除后,重新进行Meta 分析,结果发现各危险因素的OR没有本质性改变,提示本结论较为可靠。
3 讨论
随着肺癌分子机制研究的不断深入,分子靶向治疗成为治疗肺癌的新方法之一,其中以EGFR为靶点的分子治疗已成为研究的热点。
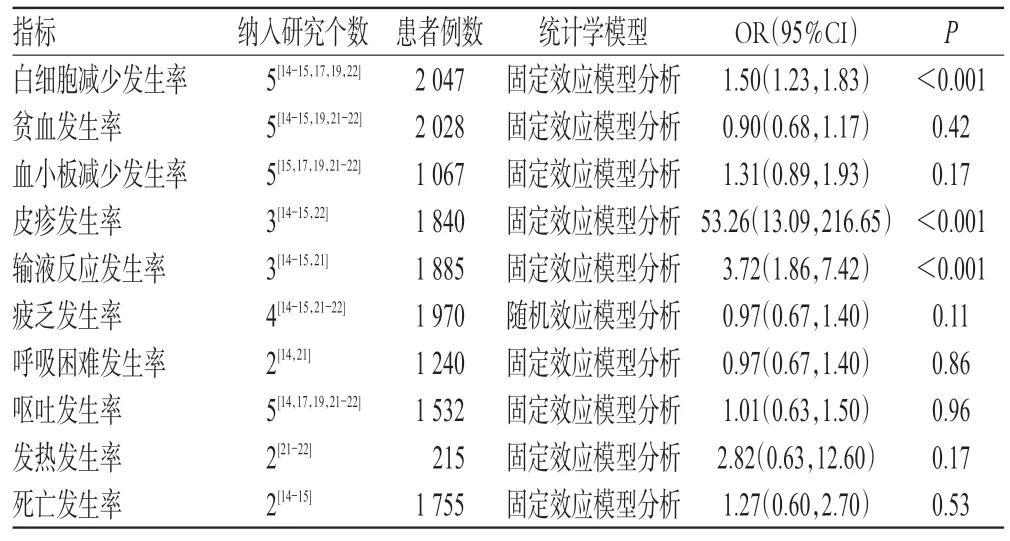
表2 主要3级和4级毒副反应的Meta分析结果Tab 2 Meta analysis results of major Grade 3 and 4 toxicity reactions
EGFR 是一种有酪氨酸激酶活性的膜表面蛋白。研究显示,EGFR 在多数NSCLC 患者中呈高表达,EGFR 信号通路异常在肿瘤的发生、发展和转移方面起着重要作用[22]。西妥昔单抗是针对EGFR设计的人鼠嵌合的单克隆抗体,可与EGFR胞外结构结合,西妥昔单抗与EGFR结合的亲和力约为其内源性配体的5~10 倍,故可阻断其与内源性受体的相互作用,阻断细胞内信号转导途径,从而抑制癌细胞的增殖,诱导癌细胞的凋亡,起到抗肿瘤的作用[23]。
本研究结果表明,西妥昔单抗联合化疗可提高患者1年生存率、部分缓解率和总有效率,与单纯化疗比较差异均有统计学意义;而完全缓解率与单纯化疗比较,差异无统计学意义。研究同时发现,西妥昔单抗联合化疗发生白细胞减少、皮疹、输液反应的比例较单纯化疗高,且差异均有统计学意义,但并没有因此增加病死率。因此,西妥昔单抗是有效且安全的。
本文的局限性包括:(1)纳入的8 项RCT 中仅有4 项研究进行了恰当的随机分配、分配隐藏及盲法[14-15,21-22],这可能会增大选择性偏倚,影响研究结果的真实性;(2)本研究中疲乏、呼吸困难、呕吐为主观测量指标,其真实性依赖于对测量者和患者实施正确的盲法,而本研究中有4 项研究没有描述盲法,这可能会增加实施偏倚和测量偏倚[17-20];(3)8项研究的选择性结局报道均不清楚,可能会增加报道偏倚;(4)各研究之间的基本化疗药物有所不同,评价疗效和毒副反应的时间也有所不同,这可能对研究结果造成一定影响。
综上所述,西妥昔单抗联合以铂类药物为基础的化疗治疗进展期NSCLC可以提高疗效,其部分不良反应发生率虽有所增加,但不增加病死率,因此是可以耐受的。受纳入研究方法学的局限性,该结论还需要更多高质量的RCT进一步验证。
[1]Makitaro R,Paakko P,Huhti E,et al.Prospective population-based study on the survival of patients with lung cancer[J].Eur Respir J,2002,19(6):1 087.
[2]Potosky AL,Saxman S,Wallace RB,et al.Population variations in the initial treatment of non-small-cell lung cancer[J].J Clin Oncol,2004,22(16):3 261.
[3]Mok TS,Wu YL,Thongprasert S,et al.Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma[J].N Engl J Med,2009,361(10):947.
[4]Rosell R,Carcereny E,Gervais R,et al.Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer(EURTAC):a multicentre,open-label,randomised phase 3 trial[J].Lancet Oncol,2012,13(3):239.
[5]Sandler A,Gray R,Perry MC,et al.Paclitaxel-carboplatin alone or with bevacizumab for non-small-cell lung cancer[J].N Engl J Med,2006,355(24):2 542.
[6]Soria JC,Mauguen A,Reck M,et al.Systematic review and meta-analysis of randomised,phase Ⅰ/Ⅰtrials adding bevacizumab to platinum-based chemotherapy as first-line treatment in patients with advanced non-smallcell lung cancer[J].Ann Oncol,2013,24(1):20.
[7]Azzoli CG,Baker SJ,Temin S,et al.American society of clinical oncology clinical practice guideline update on chemotherapy for stageⅠnon-small-cell lung cancer[J].J Clin Oncol,2009,27(36):6 251.
[8]Bunn PA.Chemotherapy for advanced non-small-cell lung cancer:who,what,when,why?[J].J Clin Oncol,2002,20(18 Suppl):23.
[9]D’Addario G,Felip E.Non-small-cell lung cancer:ESMO clinical recommendations for diagnosis,treatment and follow-up[J].Ann Oncol,2008,19(Suppl 2):ii39.
[10]Grossi F,Aita M,Defferrari C,et al.Impact of third-generation drugs on the activity of first-line chemotherapy in advanced non-small cell lung cancer:a meta-analytical approach[J].Oncologist,2009,14(5):497.
[11]Scagliotti GV,Parikh P,von PJ,et al.Phase Ⅰstudy comparing cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy-naive patients with advanced-stage non-small-cell lung cancer[J].J Clin Oncol,2008,26(21):3 543.
[12]Mancilla EE,Brodsky JL,Mehta S,et al.Teriparatide as a systemic treatment for lower extremity non-union fractures:a case series[J].Endocr Pract,2014,21(2):136.
[13]Delbaldo C,Michiels S,Syz N,et al.Benefits of adding a drug to a single-agent or a 2-agent chemotherapy regimen in advanced non-small-cell lung cancer:a meta-analysis[J].JAMA,2004,292(4):470.
[14]Pirker R,Pereira JR,Szczesna A,et al.Cetuximab plus chemotherapy in patients with advanced non-small-cell lung cancer(FLEX):an open-label randomised phase III trial[J].Lancet,2009,373(9 674):1 525.
[15]Lynch TJ,Patel T,Dreisbach L,et al.Cetuximab and first-line taxane/carboplatin chemotherapy in advanced non-small-cell lung cancer:results of the randomized multicenter phaseⅠtrial:BMS099[J].J Clin Oncol,2010,28(6):911.
[16]Julian PT,Sally G.Cochrane handbook for systematic reviews of interventions version5.0.1[EB/OL].(2011-03)[2014-03].http://www.cochrane-handbook.org/.
[17]曾刚.西妥昔单抗联合GP 方案治疗老年晚期非小细胞肺癌的疗效和安全性[J].当代医学,2012(36):12.
[18]高吉俊,崔敬敬,周鹏云.西妥昔单抗联合GP方案治疗晚期非小细胞肺癌的临床观察[J].中国医药指南,2012,10(31):566.
[19]缪建华,钟皎,过雪丹,等.西妥昔单抗联合GP方案治疗晚期非小细胞肺癌临床观察[J].实用临床医药杂志,2012,16(3):90.
[20]吴晓东,唐良法,江莲,等.西妥昔单抗联合NP方案治疗晚期非小细胞肺癌疗效观察[J].临床肺科杂志,2012,17(10):1 920.
[21]Butts CA,Bodkin D,Middleman EL,et al.Randomized phaseⅠstudy of gemcitabine plus cisplatin or carboplatin[corrected],with or without cetuximab,as first-line therapy for patients with advanced or metastatic non small-cell lung cancer[J].J Clin Oncol,2007,25(36):5 777.
[22]Rosell R,Robinet G,Szczesna A,et al.Randomized phaseⅠstudy of cetuximab plus cisplatin/vinorelbine compared with cisplatin/vinorelbine alone as first-line therapy in EGFR-expressing advanced non-small-cell lung cancer[J].Ann Oncol,2008,19(2):362.
[23]Li S,Schmitz KR,Jeffrey PD,et al.Structural basis for inhibition of the epidermal growth factor receptor by cetuximab[J].Cancer Cell,2005,7(4):301.
