白桦木质部蛋白提取方法的建立1)
2015-03-08孙丹王玉成王超
孙丹 王玉成 王超
(林木遗传育种国家重点实验室(东北林业大学),哈尔滨,150040)
责任编辑:潘 华。
蛋白质作为生命活动的物质基础,参与生物体内几乎所有的生命活动过程[1],蛋白质组学技术已成为林木材性研究的重要技术手段[2]。而双向电泳是研究蛋白质组学应用最广泛的分离技术,该技术最关键的步骤是蛋白质样品的制备[1]。如今林木蛋白质组学的研究起步较晚,进展缓慢,主要是因为林木组织含有较高的酚醛、树脂和单宁酸并且蛋白样品制备困难[3]。蛋白质的提取效果的好坏直接影响蛋白质的分离及后续试验的可靠性,所以蛋白质的提取成为研究关键[4]。
白桦(Betula platyphylla Suks.)是一个北温带的广布种,其基本密度、木材硬度、白度、纤维形态、化学组分以及打浆性能均符合造纸用材的要求[5],是优良的短周期阔叶纸浆用材树种。对其木材形成的分子生物学研究已经成为木本植物研究的重要内容之一,其中利用蛋白质组学技术研究其木质部发育的调控成为重要手段。如今对白桦蛋白的研究主要集中在花芽上[6-7],对木质部蛋白的提取未见报道,而白桦的组织中存在大量的糖类、酚类等活性成分[8],使蛋白提取的难度增大,所以建立一种适用于白桦木质部蛋白提取的方法具有重要理论与应用价值。
目前提取植物蛋白的方法有很多[4],其中TCA—丙酮法是最为常用的一种方法,在小麦叶片总蛋白的提取[9],毛白杨芽蛋白的提取[10],杨树树皮蛋白的提取[1],杨树树叶蛋白的提取[3]中均取得较好的效果,但是该方法的提取体系较大,需要大量的初始材料,对设备要求较高,在有限的材料的情况下,我们需要建立一种高效简便的方法。
本研究比较分析了TCA—丙酮法、酚提取法、试剂盒提取法3 种方法提取白桦木质部蛋白的提取效率和提取质量,并对酚提取法加以改良,建立了一个经济,实用,高效,优质的白桦木质部蛋白提取方法。为今后的蛋白质组学分析和利用分子生物学手段改良白桦材性奠定基础。
1 材料与方法
于2011年8月,采集白桦(Betula platyphylla Suks.)4年生实生苗茎干,剥去外层树皮,削取外层3~5 mm 正在发育的木质部,液氮速冻,置于冰箱中-80 ℃保存备用。
1.1 蛋白提取方法
取约2 g 冻存材料,用液氮充分研磨之后,平均分成3 份,每份0.6 g,分别用于3 种提取方法。
TCA—丙酮法:取0.6 g 用液氮充分研磨的材料,将粉末转移到50 mL 离心管中并加入3 倍体积的-20 ℃预冷的丙酮溶液(含10% TCA 和0.1%DTT),-20 ℃沉淀过夜。4 ℃,35 000 g 离心1 h,弃上清,保留沉淀。用3 倍于沉淀体积的含有0.07%的β—巯基乙醇的预冷丙酮沉淀重悬,-20 ℃沉淀1 h。4 ℃,100 000 g 离心1 h,弃上清,保留沉淀。上述步骤重复一次。用真空干燥离心机将沉淀抽干,置于-80 ℃待用。
酚提取法:取0.6 g 用液氮充分研磨的材料,分装于1.5 mL 离心管中,每管加入1 mL 的匀浆缓冲液(20 mmol/L Tris-HCl(pH=7.5),0.9 mol/L sucrose,10 mmol/L EGTA,1 mmol/L PMSF,1 mmol/L DTT 以及1% Triton X-100),震荡20 min。4 ℃,14 000 r/min 离心60 min。取上清液,加入等体积的pH=7.8 Tris—饱和酚,震荡5 min,12 000 r/min,4 ℃下离心30 min。取酚层,加入5 倍体积含0.1 mol/L 乙酸铵的预冷甲醇,充分混匀,-20 ℃下过夜,沉淀蛋白。沉淀用含0.1 mol/L 乙酸铵的预冷甲醇洗2 次。预冷丙酮洗2 次。所得蛋白干粉置于-80 ℃待用。
试剂盒提取法:采用上海生工的植物蛋白提取试剂盒(Plant Total Protein Extraction Kit)。取0.6 g用液氮充分研磨的材料,将粉末转移到1.5 mL 离心管中。每100 mg 组织粉末加入1 mL Solution A 和0.7 μL Solution C 粉末悬浮后,置-20 ℃,45 min。16 000 r/min,4 ℃,离心15 min,取沉淀。往沉淀中加入1 mL Solution B,10 μL Solution D,0.7 μL Solution D,0.7 μL Solution C,并将沉淀悬浮后,立即16 000 r/min,4 ℃,离心15 min。取沉淀进行冷冻干燥,置于-80 ℃待用。
1.2 蛋白质样品溶解
将蛋白质加入裂解液(含7 mol·L-1尿素,2 mol·L-1硫脲,4% Chaps,1% DTT,10 mmol·L-1EGTA,10 mmol·L-1PMSF),充分浸泡,于37 ℃摇床震荡60 min。4 ℃,14 000 r/min,离心60 min,去沉淀,保留上清液。采用2-D Quant Kit 试剂盒(GE 公司)测定蛋白质质量浓度测定样品吸光度值,计算样品蛋白质质量浓度。
1.3 蛋白质样品纯化与浓度测定
将裂解的蛋白质用5 倍体积的丙酮重沉,于-20 ℃沉淀24 h,4 ℃,14 000 r/min 离心60 min,弃上清。按照1.2 的方法重新进行裂解。采用2-D Quant Kit 试剂盒(GE 公司)测定蛋白质质量浓度测定样品吸光度值,计算样品蛋白质质量浓度。
1.4 SDS-PAGE 凝胶电泳与凝胶扫描
使用不连续胶SDS-PAGE 法[11],浓缩胶浓度为4%,分离胶浓度为12%,每孔上样量约为8 μL,与2×Loading buffer 等体积混匀后上样。采用Bio-Rad 公司的PowerPac basic 垂直电泳系统。电泳条件为80 V 约3 h,120 V 约1 h。电泳结束后考马斯亮蓝R 染色。染色后用Image Scanner Ⅲ扫描仪(GE Healthcare)对凝胶进行扫描和图像采集。
1.5 双向电泳与凝胶扫描
第1 向采用13 cm,pH 值3~10,NL 的IPG 胶条,蛋白上样的质量为150 μg,上样总体积为200 μL,根据蛋白定量结果,使所有样品蛋白上样总质量保持一致,不足的体积用水化液(8 mol/L 尿素,2% CHAPS,40 mmol/L DTT,2% pH 值3~10 IPG Buffer,0.002%溴酚蓝。)补齐。等电聚焦程序为:50 V,17 h;500 V,2 h;1 000 V,1 h;8 000 V,2 h;8 000 V,3.5 h,整个过程在20 ℃下进行。等电聚焦结束后,取出胶条,放入含有0.05 g DTT 的平衡液(50 mmol/L Tris-HCl,6 mol/L 尿 素,30%甘 油,2%SDS,0.002%溴酚蓝中,将平衡管置于摇床上平衡30 min。第1 步平衡结束后,将胶条放入含有0.125 g 碘乙酰胺的平衡液中,将平衡管置于摇床上平衡30 min。将平衡好的胶条转移到14%聚丙烯酰胺凝胶上,进行第2 向电泳分离,条件为:40 mA 约40 min,70 mA 约1.5 h,至溴酚蓝跑到胶底部,采用银染法(Silver Steining Kit,GE 公司)对电泳胶进行染色。染色后用Image Scanner Ⅲ扫描仪(GE Healthcare)对凝胶进行扫描和图像采集。利用专业2D 胶分析软件PDQuest8.01 进行双向电泳的图像分析。
2 结果与分析
2.1 不同方法提取的蛋白质得率比较
由表1中可以看出,3 种方法提取的蛋白浓度差异较大。酚法提取的蛋白质量浓度最大,其蛋白质量浓度是TCA—丙酮法的15 倍,试剂盒提取法的4 倍。TCA—丙酮法提取的蛋白质量浓度最低,试剂盒法提取的蛋白质量浓度是TCA—丙酮法的6倍。而TCA—丙酮法得到的蛋白溶液体积是其他两种方法的2 倍,但是最终酚法得到的蛋白总质量最多,是TCA—丙酮法的7 倍多,是试剂盒法的4 倍多。
2.2 不同提取方法的1-DE 图谱分析
由图1的结果中可以看出,相同的上样体积,酚法提取的蛋白质量浓度最大,符合上述蛋白质量浓度的测定结果。1-DE 图谱结果显示,3 种方法提取的蛋白条带清晰,且分离性较好,没有出现拖尾现象。在高分子量区域(>100 kD)和低分子量区域(<25 kD)都可以检测到明显的蛋白条带。而TCA—丙酮法在a 区域能检测到的蛋白条带明显少于其他2 种方法,酚法和试剂盒法的蛋白条带图谱很相似,在a 区域均显示出丰富的蛋白条带,但是个别条带在丰度上出现差异(图1箭头所指)。

表1 3 种方法提取的蛋白量
2.3 不同提取方法的2-DE 图谱分析
用TCA—丙酮法、酚法、试剂盒提取法分别提取白桦木质部蛋白,通过蛋白质裂解,经双向电泳及染色,通过图像采集系统得到的电泳图谱如图2所示。从2-DE 图谱中可以看出3 种方法的蛋白质点均比较清晰,呈圆形或椭圆形。蛋白质点多集中在pH 值为4~7 内,分子量在95~10 kD,在高分子量区域(>100 kD)和低分子量区域(<25 kD)的蛋白质点较少,高丰度蛋白质集中的区域与1-DE 蛋白条带丰富区相符合。其中酚法的凝胶背景干净,蛋白质点更清晰,拖尾现象较少,鉴定的蛋白质点最多,如图2所示。电泳图谱经PDQuest8.01 进行分析,酚提取法得到的蛋白质点最多,为398 个,匹配率100%;TCA—丙酮法为270 个,匹配率68%;试剂盒法为284 个,匹配率71%。

图1 3 种方法提取白桦木质部蛋白的1-DE 图谱
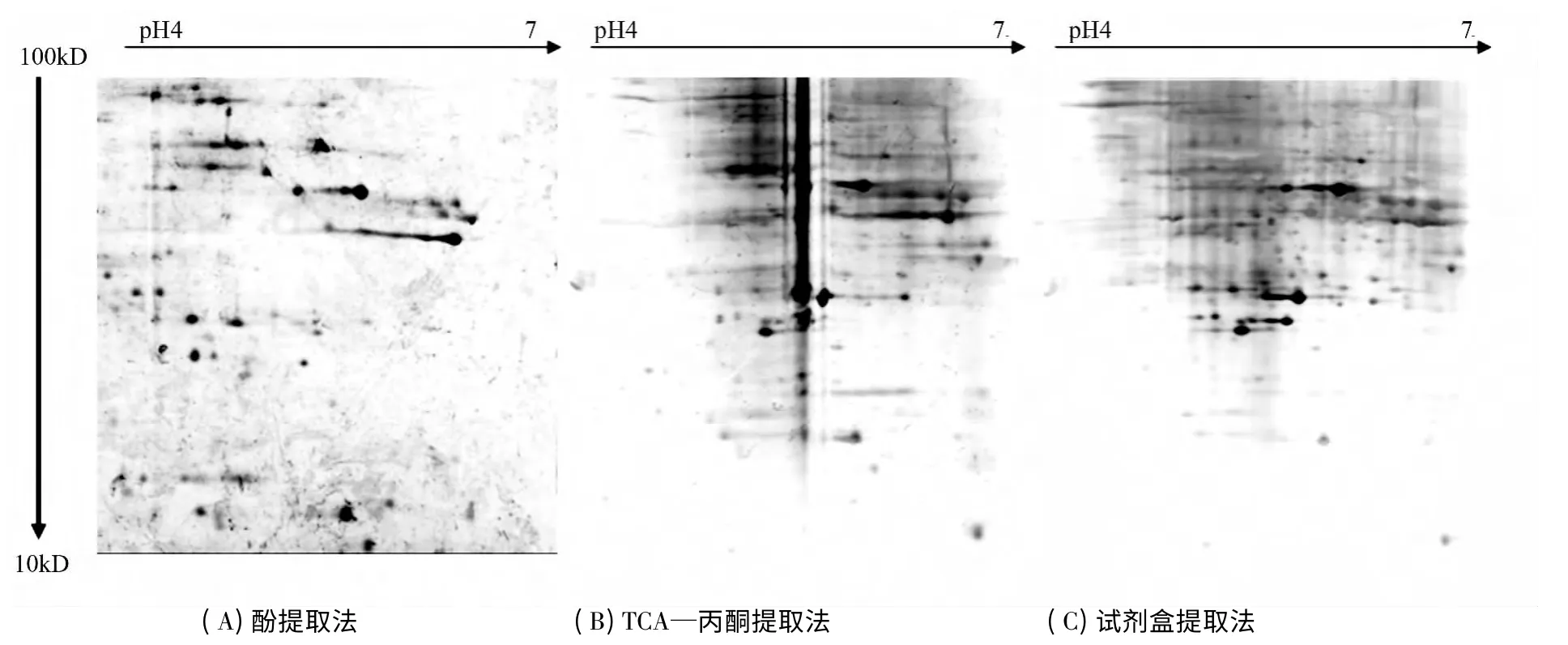
图2 3 种方法提取白桦木质部蛋白的2-DE 图谱
3 结论与讨论
蛋白提取技术一直是植物蛋白质组学研究中的关键技术[12],不同的植物组织结构及成分不同,适用的蛋白提取方法也不相同[13]。白桦木质部中本身蛋白含量较少并且存在大量的糖类和活性成分,增加了提取的难度。在个别研究中,进行蛋白质提取的样品量有限,较高的提取效率就更为重要。为了能够建立一种适用于白桦木质部蛋白的提取方法,本研究严格地控制初始材料的质量,先将材料进行充分研磨,之后进行均分,得到3 份质量为0.6 g的材料,再分别用TCA—丙酮法、酚提取法、试剂盒提取法进行提取,这样可以更直观地看出这3 种方法的优劣。结果显示,相同质量的材料提取的蛋白质浓度差异较大,获得蛋白质的最终质量也不相同,即在有限的材料的前提下,3 种方法的提取效率不同。
试剂盒法,操作简单,提取的蛋白质量浓度适中,而且从2-DE 结果中得到的蛋白质点较多,但是因为本研究的试验材料为木质部,不易研磨,一旦提取材料的质量加大,则操作不易,药品的耗损加大,而且最终得到的蛋白沉淀不易裂解,所以最终得到的蛋白质质量不高。并且一个试剂盒每100 mg 提取50 次,提取数量有限,增加了试验成本,不适合于大量蛋白提取的研究。
TCA—丙酮法是提取植物蛋白最常用的方法,操作步骤简单,蛋白粗提物产量大[4],本研究中经过纯化,TCA—丙酮法得到的蛋白质体积仍是其他方法的2 倍。但是该方法实验过程耗时较长,需要使用超速离心设备,而且不能有效地去除材料组织中的多糖[14],进而影响了蛋白质样品的上样量和电泳的质量。而且在繁琐的提取过程中也加大了蛋白质的损失量,从图1中可以看出TCA—丙酮法并没有有效地消除可能影响蛋白质量的干扰物,在a 区域的蛋白质条带也没有其他2 种方法提取的丰富。从图2中可以看出横纵条纹较多,得到的蛋白质点没有其他2 种方法的清晰。并且,提取相同质量材料的蛋白,TCA—丙酮法得到的蛋白浓度最低,尽管提取材料较少不适合该方法的大体系提取,但与其他两种方法比较,TCA—丙酮法的提取效率最低。
酚是一种温和的变性剂,而多糖类物质不溶于酚相,蛋白质更容易进入酚层,这样可有效去除样品中的杂质[4],提高蛋白的提取效率。传统的酚提取法[4]是将材料研磨之后,在研钵中加入提取缓冲液,而本研究将材料分装到1.5 mL 离心管再加入缓冲液,震荡20 min,这样能更有效的减少材料的损失,也使材料与提取液接触的更充分。并且将离心的速度加大,离心时间加长,如第一步的离心速度由10 000 r/min 改为14 000 r/min;20 min 延长至60 min。宋学东[7]等在研究白桦花芽蛋白质提取时发现高速离心办法能较好地去除多糖的影响。金艳[9]等在对小麦叶片的总蛋白提取中也同样发现高速离心和延长离心时间能够除了部分多酚和醌类物质,从而提高蛋白质的提取率。同时,为了得到更多的蛋白质,在裂解液中加入PMSF,来抑制丝氨酸和一些半光氨酸水解酶的作用,袁坤[3]等也通过加入PMSF 来以减少蛋白质的降解。实验最终得到蛋白干粉,便于裂解,所以得到的蛋白质质量最多,蛋白的提取效率最高。虽然2-DE 的结果显示得到的蛋白质点要少于其他2 种方法,但是凝胶背景干净,蛋白质点清晰,且几乎没有横纵条纹,说明用该方法提取的白桦木质部蛋白杂质较少。结合以上所述,酚提取法是目前较适于提取白桦木质部蛋白的方法。
[1] 赵相涛,吕全,赵嘉平,等.一种适合杨树树皮的蛋白质提取方法[J].山东农业科学,2012,44(7):121-123.
[2] 谢红丽,卢孟柱,李颖章.毛白杨剥皮再生过程中蛋白质变化的2-DE 分析[C]//中国植物学会七十周年年会论文摘要汇编(1933-2003).成都:中国植物学会,2003.
[3] 袁坤,王明庥,黄敏仁.一种适合杨树叶片的蛋白质提取方法[J].南京林业大学学报:自然科学版,2007,31(3):119-121.
[4] 杨秋玉,耿兴敏,彭方仁.杜鹃叶片3 种蛋白质提取方法的比较[J].安徽农业大学学报,2014,41(3):440-444.
[5] 朱大群,高玉池,魏志刚,等.白桦优质速生纤维材家系的选择[J].东北林业大学学报,2008,36(11):15-17.
[6] 杨传平,姜静,梁艳,等.白桦雄花序发育初期蛋白质的双向电泳图谱分析[J].东北林业大学学报,2004,32(1):1-4.
[7] 宋学东,李慧玉,姜静,等.白桦花芽蛋白质双向电泳技术的建立[J].生物技术通讯,2006:901-903.
[8] 詹亚光,曾凡锁.富含多糖的白桦成熟叶片DNA 的提取方法[J].东北林业大学学报,2005,33(3):24-25.
[9] 金艳,许海霞,徐圆圆,等.几种不同提取方法对小麦叶片总蛋白双向电泳的影响[J].麦类作物学报,2009,29(6):1083-1087.
[10] 谢进,田晓明,刘淑欣,等.适用于毛白杨芽双向电泳分析的蛋白质提取方法[J].北京林业大学学报,2013,35(4):144-148.
[11] Laemmli U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227:680-685.
[12] 王力敏,王东阳,王丹,等.木薯块根膨大期韧皮部和木质部比较蛋白组学初步研究[J].热带作物学报,2014,35(3):525-533.
[13] Bertolde F Z,Almeida A A F,Silva F A C.Efficient method of protein extraction from Theobroma cacao L.roots for two-dimensional gel electrophoresis and mass spectrometry analyses[J].Genetics and Molecular Research,2014,13(3):5036-5047.
[14] 彭存智,李蕾,刘志昕,等.红树叶蛋白质样品制备方法的比较及其双向电泳分析[J].热带生物学报,2010,1(1):12-16.
