子痫前期患者胎盘组织中Syncytin-2和MFSD2的表达
2015-03-08刘益芬陈敦金刘启才李映桃陈艳红邓运芝胡雪娴
刘益芬 陈敦金 赵 扬 刘启才 李映桃 陈艳红 邓运芝 胡雪娴
(1广州医科大学附属第三医院妇产科,广州重症孕产妇救治中心,广东省产科重大疾病重点实验室,广东 广州 510150;2广州医科大学中心实验室,广东 广州 510182; 3广东省人民医院妇产科,广东省医学科学院,广东 广州 510080)
·论著·
子痫前期患者胎盘组织中Syncytin-2和MFSD2的表达
刘益芬1陈敦金1赵 扬2刘启才3李映桃1陈艳红1邓运芝1胡雪娴1
(1广州医科大学附属第三医院妇产科,广州重症孕产妇救治中心,广东省产科重大疾病重点实验室,广东 广州 510150;2广州医科大学中心实验室,广东 广州 510182;3广东省人民医院妇产科,广东省医学科学院,广东 广州 510080)
目的:探讨Syncytin-2及其受体MFSD2在不同程度子痫前期和正常晚期妊娠胎盘组织中的表达情况。方法:选择2010年3月至2013年8月在广州医科大学附属第三医院住院分娩的60例孕妇作为研究对象,分为轻度子痫前期组、重度子痫前期组和正常晚期妊娠组,每组各20例。采用定量RT-PCR 方法检测Syncytin-2 mRNA的转录水平,Western blotting法测定MFSD2蛋白表达强度。结果:3组Sycytin-2 mRNA和MFSD2蛋白相对表达量比较,差异均有统计学意义(P<0.05),其中正常晚期妊娠组高于轻度子痫前期组和重度子痫前期组(P<0.05),而轻度子痫前期组与重度子痫前期组比较,差异无统计学意义(P>0.05)。结论:胎盘组织Syncytin-2和MFSD2表达下调与子痫前期发病密切相关。
子痫前期; Syncytin-2;MFSD2
子痫前期(preeclampsia,PE)是妊娠期特有的多系统疾病,是导致围产期母亲死亡的第二个主要并发症[1]。目前认为子痫前期不是单一病因的疾病,可能是多种因素相互作用的结果,滋养细胞分化异常导致螺旋动脉重铸失败和胎盘浅着床是PE的特征性病理生理变化,在PE发生发展过程中起着重要的作用[2]。Syncytin-2和MFSD2是参与胎盘滋养细胞分化、融合的重要基因,与胎盘正常形态和功能的维持关系密切,因而可能与PE的发病密切相关。本研究采用定量RT-PCR 方法检测Syncytin-2 mRNA 的转录水平,Western blotting法测定MFSD2蛋白表达强度,探讨Syncytin-2和MFSD2在PE发病中的作用,为子痫前期病因的深入研究提供线索,也为今后采取相应的干预措施提供理论依据。
1 资料与方法
1.1 研究对象
选择2010年3月至2013年8月在广州医科大学附属第三医院住院分娩的60例孕妇作为研究对象,根据孕周匹配,分为轻度子痫前期组、重度子痫前期组和正常晚期妊娠组,每组各20例。PE诊断标准参考乐杰主编《妇产科学》教材第7版[3],排除妊娠合并原发性高血压、肾炎等;正常晚期妊娠组排除胎膜早破、早产等病理妊娠。3组孕妇年龄、孕周、孕产次比较,差异均无统计学意义(P>0.05)。见表1。
1.2 主要试剂
引物和探针由上海闪晶生物技术有限责任公司设计并合成, Quantitect Probe RT PCR试剂盒购于Qiagen公司。Sv Total RNA提取试剂盒购于Promega公司。羊抗Syncytin-2 抗体购自Santa Crui生物技术公司,兔抗羊二抗购自Sigma公司。荧光定量PCR仪为Mxpro 3000 型,产自美国Stratagene公司。
1.3 胎盘取材与处理
胎盘娩出后30 min内取脐带附着点至胎盘边缘范围的中间区域(避开钙化灶及出血点),剔除外部的母体面组织至少1.0 cm,取胎盘组织总质量约50~100 mg,生理盐水洗净后液氮冻存备用。
1.4 总RNA和蛋白提取
称取约胎盘组织40 mg,充分研磨后依SV Total RNA 提取试剂盒说明书操作, 提取总RNA后紫外分光光度计测定其纯度并计算浓度后,2%琼脂糖凝胶电泳确定RNA 完整性,-80 ℃保存备用;胎盘组织剪碎后加入1 mL裂解液,充分匀浆后胶乳蛋白抽提液,离心后吸除液相,干燥沉淀蛋白,-20 ℃保存备用。
1.5 实时PCR检测
Mxpro 3000 型荧光定量PCR 仪检测Syncytin-2的相对转录水平,引物和探针序列:正向序列5′-ATGGCCCTCCCTTATCA-3′,反向序列5′-TGGGTG TGGGCAGTGAA-3′,一步法实时荧光定量RT-PCR反应条件如表2。每次反应均设由DEPC 水作模板的阴性对照,以GAPDH为内参照,计算机软件分析各管反应物的荧光强度,标准曲线法半定量计算各目的基因相对反应起始拷贝数。
1.6 Western blotting检测
生物分光光度比色分析测定蛋白质含量后,各取50 μg蛋白,进行SDS-PAGE 电泳,转移至PVDF 膜上,1:500 一抗孵育过夜,1∶3 000 二抗标记,ECL液显色,然后依次曝光、显影、定影,凝胶图像处理系统分析目标带的分子质量和净光密度值,用灰度分析软件得出MFSD2表达图像峰面积值,与β-actin表达峰面积值进行标准化处理。
1.7 统计学分析
采用SPSS 20.0 统计软件进行分析,计量资料以均数±标准差表示,多组比较采用单因素方差分析,组间两两比较采用LSD-t检验,计数资料采用卡方检验进行比较,P<0.05为差异有统计学意义。
2 结 果
2.1 Sycytin-2 mRNA相对表达情况
PCR 检测结果显示,3组Sycytin-2 mRNA相对表达量比较,差异均有统计学意义(P<0.05),其中正常晚期妊娠组高于轻度子痫前期组和重度子痫前期组(P<0.05),而轻度子痫前期组与重度子痫前期组比较,差异无统计学意义(P>0.05),见表3。

表1 3组孕妇一般资料比较±s)
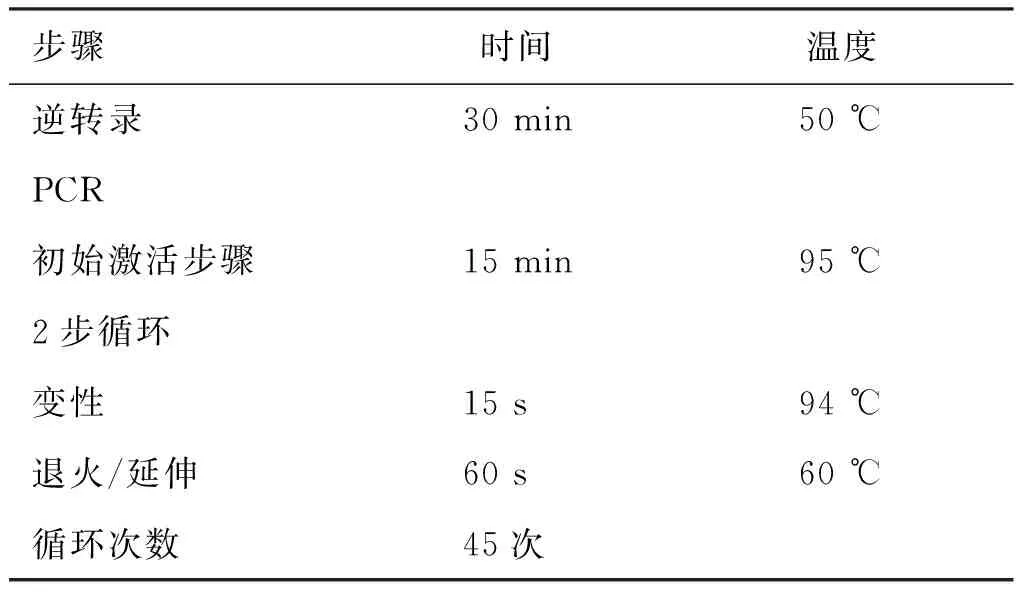
表2 检测条件
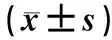
表3 3组Sycytin-2mRNA的相对表达情况
注:内参校正后的Syncytin-2 mRNA的相对表达量=Syncytin-2 mRNA的表达量/GAPDHmRNA的表达量;与正常晚期妊娠组比较,*P<0.05。
2.2 MFSD2蛋白表达情况
Western blotting检测结果显示,3组胎盘组织中MFSD2蛋白表达水平比较,差异均有统计学意义(P<0.05),其中正常晚期妊娠组高于轻度子痫前期组和重度子痫前期组(P<0.05),而轻度子痫前期组与重度子痫前期组比较,差异无统计学意义(P>0.05),见图1,2。
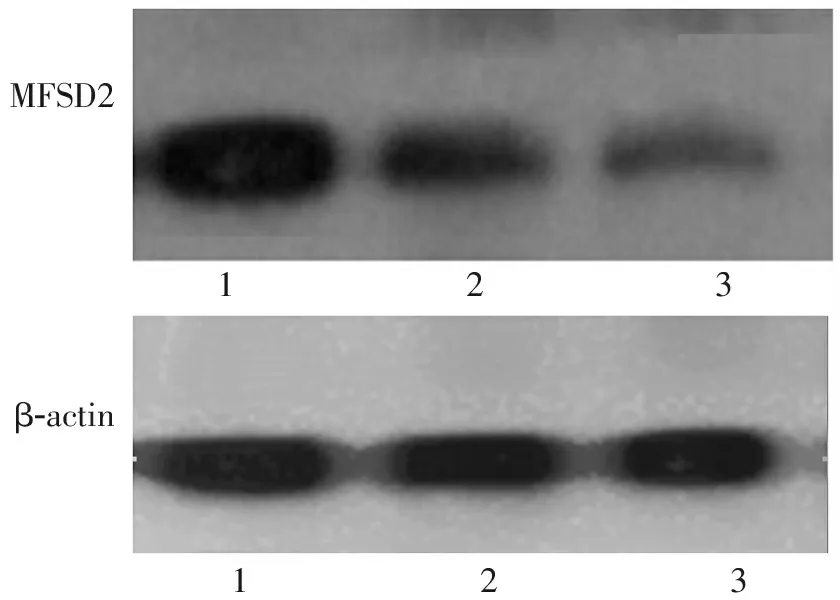
MFSD2β-actin123123
注:1.正常晚期妊娠组;2.轻度子痫前期组;3.重度子痫前期组
图1 3组胎盘组织MFSD2蛋白表达情况
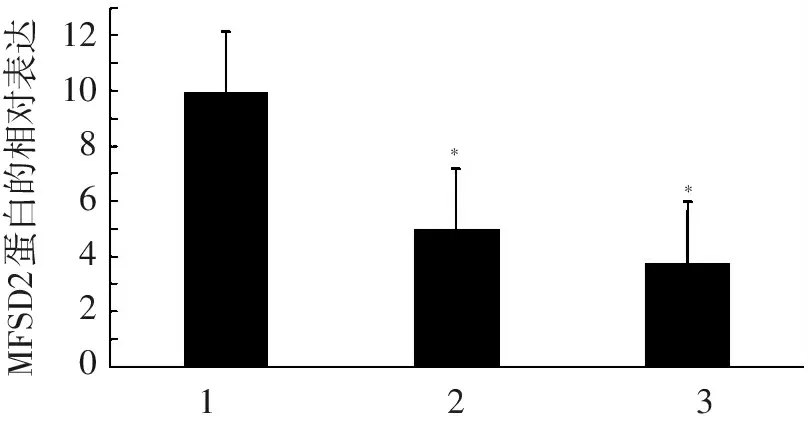
121086420MFSD2蛋白的相对表达**123
注:1.正常晚期妊娠组;2.轻度子痫前期组;3.重度子痫前期组;与正常晚期妊娠组比较,*P<0.05
图2 3组MFSD2蛋白的相对表达情况
3 讨 论
Syncytin-2是人内源性逆转录缺陷病毒HERV家族成员之一的HERV-FRD 编码的包膜蛋白。HERV基因家族是2 500~4 000万年前侵入灵长类动物体内的逆转录病毒基因片段[4]。哺乳动物在漫长进化过程中捕获感染的逆转录病毒部分基因片段,整合入自身基因组,并在体内加以表达,其组成约占人类基因组8%[5-7]。HERV的确切功用目前尚不十分清楚,但有研究显示, HERV可影响基因组的有序运作及其生物功能,在分子演变中HERV基因的某一编码序列可翻译出具有特异功能的蛋白质,对细胞生物功能起重要作用[5]。Syncytin是人内源性逆转录缺陷病毒HERV家族成员编码的包膜蛋白,分为Syncytin-1和Syncytin-2,最新研究提示,HERV家族中的HERV-FRD的包膜蛋白Syncytin-2在胎盘细胞融合过程中,细胞滋养细胞形成合胞体滋养细胞中起着比Syncytin-1更重要的作用[8]。Syncytin-2的表达随着孕周的延长,其表达水平显著下降,在早期,其转录水平比Syncytin-1低10倍,但足月妊娠时,在胎盘组织中检测低到40倍左右,这也意味着Syncytin-2在合胞体形成过程中与Syncytin-1相比起着不同的作用[9],这种不同可能与Syncytin-2蛋白仅表达于CT与ST交界的部分绒毛滋养细胞内有关[10]。但台湾有学者报道Syncytin-2的表达随着孕周的延长,早中晚孕期表达水平显著上升,并且在PE中表达明显下降[11]。这与本组前期研究的结果一致,Syncytin-2 mRNA在PE中明显降低[12]。Syncytin-2 PCR扩增产物1 038 bp,在胎盘形态建成中,Syncytin-2作为灵长类的真正细胞基因维持它的融合特性的功能的结构状态,对比感染病毒基因组有非常低的突变率,这归因于Syncytin-2的晶体结构,这种结构的中央由化石般的外功能区组成,容许相应的目前感染的逆转录病毒大量的叠加,有60%的分叉序列,正是由于Syncytin-2的这种独特结构通过它的融合功能从HERV的包膜蛋白中选择出来[13]。本研究结果显示,3组均有Syncytin-2 mRNA的表达,不同程度PE胎盘组织中Syncytin-2 mRNA的表达量均比正常妊娠胎盘组织中低。轻度PE胎盘Syncytin-2 mRNA的表达跟重度PE胎盘Syncytin-2 mRNA的表达差异无统计学意义。
Syncytin-2在胎盘滋养细胞融合分化过程中的作用发挥尚依赖于独特的受体MFSD2。MFSD2属于设定的超过10~12跨膜区域的碳水化合物的运载体,位于人类染色体1P34.2,在演变过程中相对保守。MFSD2在单核细胞滋养层中不断的通过融合增殖使细胞滋养层形成合胞体滋养层,使MFSD2在合胞体滋养层中高度表达。MFSD2在胎盘组织表达具有特异性,除了在睾丸低4倍,在其余组织中低至十倍以上[14]。本研究结果也显示,3组中均有MFSD2蛋白的表达,不同程度PE胎盘组织中MFSD2蛋白的表达量均比正常晚期妊娠胎盘组织中低。轻度PE胎盘的表达跟重度PE胎盘的表达差异无统计学意义。这与Syncytin-2 mRNA在PE的表达下降完全一致,但与作者前期研究的MFSD2 mRNA在PE的表达差别无显著性意义[2]不同,这可能与MFSD的定位不同有关。
综上所述,胎盘中Syncytin-2、MFSD2表达下降可能引起合体滋养细胞形成减少,胎盘绒毛发育缺陷,导致胎盘缺血缺氧,从而使妊娠高血压患者胎盘功能失调。对Syncytin-2 和MFSD2 的研究有助于进一步了解PE的发病机制。
[1] Robillard PY. Interest in preeclampsia for researchers in reproduction [J]. J Reprod Immunol , 2002, 53(1-2): 279-287.
[2] Huppertz B. Placental origins of preeclampsia: challenging the current hypothesis [J]. Hypertension, 2008, 51(4): 970-975.
[3] 乐 杰.妇产科学[M].第7版. 北京: 人民卫生出版社, 2010: 92-101.
[4] Dupressoir A, Marceau G, Vernochet C, et al. Syncytin-A and syncytin-B, two fusogenic placenta-specificm urine envelope genes of retroviral origin conserved in muridae [J]. Proc Natl Acad Sci U S A, 2005, 102(3): 725-730.
[5] Venables PL, Brookes SM, Griffiths D, et al. Abundance of an endogenous retroviral envelope protein in placental trophoblasts suggests a biological function [J]. Viro logy, 1995, 211(5): 589-592.
[6] Britten RJ. Coding sequences of functioning human genes derived entirely from mobile element sequences[J]. Proc Natl Acad Sci USA, 2004, 101(2): 16825-16830.
[7] Taruscio D, Mantovani A. Factors regulating endogenous retroviral sequences in human and mouse [J]. Cytogenet Genome Res, 2004, 105(4): 351-362.
[8] Vargas A, Moreau J, Landry S, et al.Syncytin-2 Plays an important role in the fusion of human trophoblast cells [J]. J Mol Biol, 2009, 392(2): 301-318.
[9] Okaharaab G, Matsubarac S, Oda T, et al. Expression analyses of human endogenous retroviruses (HERVs): tissue specific and developmental stage-dependent expression of HERVs [J]. Genomics, 2004, 84(7): 982-990.
[10] Malassine A, Blaise S, Handschuh K, et al. Expression of the fusogenic HERV-FRD Envglycoprotein(syncytin 2) in human placenta is restricted to vilous cytotrophoblastic Cells [J]. Placenta, 2007, 28(5): 185-191.
[11] Chen CP, Chen LF, Yang SR, et al.Functional characterization of the Human Placental Fusogenic Membrane Protein Syncytin-2 [J]. Biol Reprod, 2008, 79(3): 815-823.
[12] 刘慧姝.宋小飞,袁文常,等. 水通道蛋白3在人胎盘和胎膜中的表达及分布[J].中华生物医学工程杂志,2007,13(4):210-212.
[13] Renard M, Varela PF, Letzelter C, et al. Crystal structure of a pivotal domain of human syncyti n-2, a 40 million years old endogenous retrovirus fusogenic envelope gene captured by primates [J]. J Mol Biol, 2005, 352(5): 1029-1034.
[14] Esnault C, Priet S, Ribet D, et al. A placenta-specific receptor for the fusogenic, endogenous retrovirus-derived, human syncytin-2 [J]. Proc Natl Acad Sci U S A, 2008, 105(45): 17532-17537.
(本文编辑:欧阳菁)
Expression of Syncytin-2 and MFSD2 in placenta tissues of patient with preeclampsia
LiuYifen1,ChenDunjin1,ZhaoYang2,LiuQicai3,LiYingtao1,ChenYanhong1,DengYunzhi1,HuXuexian1
(1DepartmentofObstetricsandGynaecology,TheThirdAffiliatedHospitalofGuangzhouMedicalUniversity,GuangzhouMedicalCenterforCriticalDiseasesinPregnancy,GuangdongKeyLaboratoryofCriticalObstetricDiseases,Guangzhou510150;2CentralLaboratoryofGuangzhouMedicalUniversity,Guangzhou510150;3DepartmentofObstetricsandGynaecology,GuangdongProvincialPeople′sHospital,GuangdongAcademyofMedicalSciences,Guangzhou510080,China)
Objective:To investigate the expression of Syncytin-2 and its receptor MFSD2 in placenta tissues of different levels of preeclampsia and normal late pregnancy. Methods: Sixty pregnant women hospitalized for childbirth in the Third Affiliated Hospital of Guangzhou Medical University between March 2010 and August 2013 were included as the subjects in the study, and were divided into the mild preeclampsia group, severe preeclampsia group, and normal late pregnancy group (n=20 each). The transcription level of Syncytin-2 mRNA was determined by quantitative real-time PCR (RT-PCR), and the expression intensity of MFSD2 protein was determined by Western blotting. Results: There were statistically significant differences in the relative expression levels between Syncytin-2 mRNA and MFSD2 protein among the three groups (P<0.05). The relative expression levels of Syncytin-2 mRNA and MFSD2 protein in the normal late pregnancy group was higher than those in the mild preeclampsia group and severe preeclampsia group (P<0.05), whereas no statistically significant differences was found between the mild preeclampsia group and severe preeclampsia group (P>0.05). Conclusion:Down-regulated expressions of Syncytin-2 and MFSD2 in placenta tissue are closely related to the occurrence of preeclampsia.
preeclampsia; syncytin-2; MFSD2
10.3969/j.issn.2095-9664.2015.04.001
广州市医药卫生科技项目(201102A213179);广州医学院科研基金项目;广州医学院第三附属医院科研基金项目(2010Y07)
刘益芬(1976-),女,硕士,主治医师。
R714.245
A
2095-9664(2015)04-0001-04
2015-02-01)
研究方向:围产医学和产后保健。
