三种方案行冷冻囊胚移植临床结局分析
2015-03-08李锐聂玉林张艳霞赵雪峰李梅清廖宏庆
李锐 聂玉林 张艳霞 赵雪峰 李梅清 廖宏庆
三种方案行冷冻囊胚移植临床结局分析
李锐 聂玉林 张艳霞 赵雪峰 李梅清 廖宏庆
目的比较三种方案行冷冻囊胚移植的临床结局。方法回顾分析409个冷冻囊胚移植周期, 比较其与妊娠结果的关系。结果3种方案中患者的年龄、不孕年限、移植胚胎数目、移植前平均内膜厚度差异均无统计学意义(P>0.05)。三组移植周期临床妊娠率分别为61.1%,55.7%和61.0%, 胚胎着床率为46%、43.5%和37.1%, 早期流产率为8.1%、10.2%和13.9%, 宫外孕发生率1.3%、2%和2.8%,差异均无统计学意义(P>0.05)。结论在冷冻囊胚移植中, 采用自然周期、激素替代周期、GnRH-a激素替代周期三者在临床结局上差异均无统计学意义, 但是其适应证各有不同, 对每位患者应该酌情选择最适合的方案。
冷冻囊胚移植;三种方案;临床结局
随着辅助生殖技术的发展, 冷冻胚胎移植使用越来越广泛, 它可以有效的提高新鲜周期的累及妊娠率, 有效的避免卵巢过度刺激综合征的发生、反复的促排卵、穿刺卵巢对患者的创伤, 并减轻患者的经济负担及多胎风险, 其越来越在辅助生殖技术中的发挥着重要作用。其中影响冷冻胚胎移植成功率的因素主要有患者年龄、胚胎质量、胚胎发育潜能、子宫内膜厚度以及子宫内膜容受性等。本院目前采用三种方案来准备内膜, 即自然周期、激素替代周期、GnRH-a激素替代周期。本文对本院409个冷冻囊胚周期的妊娠结局进行分析, 报告如下。
1 资料与方法
1.1 一般资料2011年7月~2014年10月本院开展冷冻胚胎移植技术, 其中大多数患者采用冷冻囊胚进行移植。行冷冻囊胚移植周期为409例, 冷冻的囊胚均为取卵术后第5或者第6天形成的囊胚, 患者平均年龄(31.3±4.72)岁, 不孕年限(4.27±3.44)年。三组患者年龄、不孕年限、移植胚胎数目及内膜厚度差异等一般资料比较差异均无统计学意义(P>0.05), 具有可比性。见表1。
表1 三组患者一般情况比较(±s)
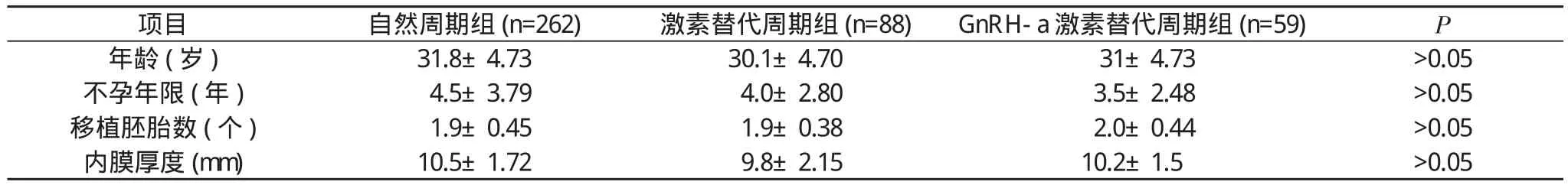
表1 三组患者一般情况比较(±s)
项目 自然周期组(n=262) 激素替代周期组(n=88) GnRH-a激素替代周期组(n=59) P年龄(岁) 31.8±4.73 30.1±4.70 31±4.73 >0.05不孕年限 (年) 4.5±3.79 4.0±2.80 3.5±2.48 >0.05移植胚胎数(个) 1.9±0.45 1.9±0.38 2.0±0.44 >0.05内膜厚度(mm) 10.5±1.72 9.8±2.15 10.2±1.5 >0.05
1.2 三种子宫内膜准备方案及分组 取卵周期未孕或因其他原因未行鲜胚移植的患者于取卵后2~3个月经周期行冷冻囊胚移植。三种方法如下:①自然周期组262例患者, 根据月经周期的长短, 通常在月经周期第8~10天起行B超开始监测卵泡发育, 当卵泡直径达到16 mm时开始监测LH峰的出现, B 超提示卵泡消失或内膜转换第2天加用地屈孕酮片20~40 mg/d, 第4天解冻患者冷冻的囊胚。②激素替代周期组88例患者, 从月经第3天开始服用戊酸雌二醇片6 mg/d,14 d后检查B超及抽血查E2、P, 根据内膜的厚度决定药物剂量的增减, 当内膜厚度≥8.0 mm, E2>150 pg/ml, P<1.5 ng/ml后,使用黄体酮阴道缓释凝胶90 mg/d进行黄体支持, 黄体支持第5天解冻冷冻的囊胚。③GnRH-a激素替代周期组59例患者, 在患者排卵后第5~7天或从月经第4天开始服用炔雌醇环丙孕酮片1粒/d吃到第18~20粒注射一次长效曲普瑞林1.50~3.75 mg, 注射后第14天当天加用戊酸雌二醇片, 戊酸雌二醇的用法同激素替代周期。
1.3 胚胎评级标准及冷冻方式 本院采用常规控制性超排卵方案, 进行取卵、受精, 受精后第3天将胚胎情况告知患者, 详细告知囊胚培养的利弊及风险, 征得患者同意后, 行囊胚培养。培养后第2天或第3天, 本院对囊胚进行评分, 采用Gardner[1]提出的方法, 根据囊胚扩张或孵出的程度分为6期:1期为囊胚不足胚胎体积的50%;2期为超过50%;3期为占满整个胚胎;4期为囊胚扩张、透明带变薄;5期为囊胚开始从透明带孵出;6期为囊胚完全孵出。对处于3~6期的囊胚,再按照内细胞团和滋养细胞层的细胞数量和形态分级。
根据内细胞团表现分为三级:A级为细胞数目多, 排列紧密;B级为细胞数目较少, 排列松散;C级为细胞数目很少。
根据滋养细胞层表现分为三级:A级为细胞数目多, 囊腔四周均有细胞, 排列紧密;B级为细胞数目较少, 排列松散;C级为细胞数目很少。
本院对发育为囊胚≥3期, 仅有需内细胞团或滋养细胞中任何一项评分达到B级, 进行分批、分管行快速玻璃化冷冻。行冷冻囊胚移植当天行解冻, 培养(4±2)h候行移植手术。
1.4 妊娠判断标准 移植后第12天监测血HCG阳性者继续黄体支持, 移植第28、45天行B超监测, 宫内见孕囊、胚芽和心管搏动即确定为临床妊娠。
1.5 统计学方法 采用SPSS11.0统计学软件进行统计分析。计量资料以均数±标准差(±s)表示, 采用t检验;计数资料以率(%)表示, 采用χ2检验。P<0.05表示差异具有统计学意义。
2 结果
三组患者用药方案临床结局比较, 临床妊娠率、胚胎着床率、早期流产率、宫外孕发生率方面, 差异均无统计学意义(P>0.05)。见表2。

表2 三组患者用药方案的临床结局比较[n(%)]
3 讨论
随着辅助生殖技术水平的不断提高, 进行冷冻胚胎移植越来越广泛。在我国冷冻胚胚移植中, 大多数生殖中心采用取卵后第3天的有发育潜能的卵裂期胚胎, 进行冷冻胚胎移植[2,3]。随着胚胎体外囊胚培养系统的不断完善, 有部分生殖中心开始尝试将胚胎培养至囊胚后进行冷冻, 再行冷冻囊胚移植, 本院采用冷冻囊胚移植, 目前妊娠率达到59.9%。主要考虑到移植囊胚较卵裂期可以获得更高的临床妊娠率,其通过囊胚培养系统可以筛选出更具有发育潜力的胚胎, 同时缩短了胚胎植入子宫腔后进一步发育与着床之间的时间,有利于胚胎着床[4,5]。囊胚的形成经历细胞融合、囊胚腔出现及囊胚腔扩张的变化, 在基因水平上经历了由母型调节向胚胎调节的转变。而且囊胚其抗冷冻损伤能力强、解冻复苏率高的特点, 比卵裂期胚胎更具有优势。有学者对冻融胚胎和冷冻囊胚移植进行比较, 发现囊胚解冻移植能获得更好的妊娠率和种植率, 且两者有显著性差异[6]。
本院目前采用三种方案进行冷冻囊胚移植。其中自然周期是本院使用最多的方案, 适应证为既往月经规则且排卵正常的患者, 其最为接近胚胎着床的生理状态, 而且患者使用药物少, 治疗时间短, 费用低, 患者依从性较高。但是在监测过程中发现有部分患者出现卵泡发育不良, 从而导致周期取消率较高。激素替代周期主要用于既往各种原因导致的排卵障碍、黄体功能不全、自然周期内膜薄或者宫腔粘连分离术后的患者。该方案在月经期使用大剂量戊酸雌二醇片促进子宫内膜的生长, 当内膜厚度≥8.0 mm, E2>150 pg/ml后,立即添加黄体酮阴道缓释凝胶使内膜转化为分泌期, 为囊胚移植做好准备。该方案的缺点有时候患者会出现自发性排卵的现象。GnRH-a激素替代周期适用于子宫内膜异位症、子宫腺肌病、子宫肌瘤或者多次移植均未妊娠的患者。该方案费用较高, 周期取消率较低, 可以避免出现自发性排卵的现象。其与激素替代周期的区别在于注射长效曲普瑞林进行降调节后, 再使用戊酸雌二醇进行激素替代。注射后容易出现低雌激素现象, 且戊酸雌二醇片用量明显加大, 容易增加性激素依赖性疾病及生殖器肿瘤的风险。目前, GnRH-a激素替代周期已获得较好的临床妊娠率, 且稍高于激素替代周期。主要考虑:GnRH-a的应用可以抑制炎性因子的释放或抑制胚胎毒性自身抗体的产生, 增加子宫内膜细胞粘附分子整合素的表达, 使异位的子宫内膜萎缩, 同时可以抑制自身内源性LH峰出现, 提高子宫内膜容受性[7]。
三种内膜准备方案对冷冻复苏胚胎移植妊娠结局的影响各家观点不同, EL-Toukhy等[8]认为激素替代周期的临床妊娠率明显低于GnRH-a激素替代周期, 其原因可能为未给予GnRH-a降调节, 其后期可能由于体内雌激素水平升高对下丘脑-垂体产生正反馈作用而出现內源性LH峰, 从而影响胚胎着床的内环境。Morozev等[9]认为自然周期与激素替代周期的患者相比内膜厚, 在年龄、胚胎质量等同的条件下,自然周期妊娠率高于激素替代周期。吴晓燕等[10]认为多次移植失败的患者采用GnRH-a激素替代周期和激素替代周期,比较临床妊娠率、胚胎着床率差异均无统计学意义(P>0.05),而对于内膜形态欠佳的患者可考虑GnRH-a激素替代周期。在本研究中, 作者采用冷冻移植的胚胎均为优质的囊胚, 且三种方案在临床妊娠率和胚胎着床率差异均无统计学意义(P>0.05)。但是对于其三者各有其适应证, 对于多次移植失败的患者, 作者还是主张采用GnRH-a激素替代周期。在早期流产率、宫外孕发生率方面, 本研究显示三组数据差异无统计学意义(P>0.05), 与国内其他学者的研究结果相似[3,10,11]。其中GnRH-a激素替代周期中较另两组样本量偏少, 早期流产率方面稍高于其他两组, 比较差异无统计学意义(P>0.05)。
综上所述, 这三种方案中患者年龄、不孕年限、移植胚胎数目及内膜厚度差异均无统计学意义(P>0.05), 进行移植的胚胎均为优质囊胚, 而上述这些都是制约冷冻囊胚移植妊娠的重要因素。排除了这些因素的影响下, 这三种方案在这409例患者中对其临床妊娠率、胚胎着床率、早期流产率、宫外孕发生率方面差异均无统计学意义(P>0.05)。这三种方案中其适应证和利弊方面各有不相同, 但是在冷冻囊胚移植中均取得良好的临床结局, 临床医生要根据每位患者的情况制定最适合治疗的方案。
[1]Gardner DK, Lane M, Stevens J, et al. Blastocyst score affects implantion and pregnanccy outcome: towards a single Blastocyst transfer. Fertil Steril,2000,73(6):1155-1158.
[2]杜彦, 廖月婵, 吴日然, 等.三种内膜准备方案在不育症患者冻融胚胎移植周期中的临床应用.生殖医学杂志,2013,22(7):495-499.
[3]胡煜, 任海琴, 连喜玉, 等.3种内膜准备方案对冷冻胚胎移植结局的影响.中外医疗杂志,2012,31(10):11-12.
[4]Thomas MR, Sparks AE, Ryan GL, et al. Clinicai predictors of human blastocyst formation and pregnancy after extended embryo and transfer . Fertil Steril,2010,94(2):543-548.
[5]Mangalraj AM, Muthukumar K, Aleyamma T, et al. Blastocyst stage transfer vs cleavage stage embryo transfer . J Hum Reprod Sci,2009,2(1):23-26.
[6]牟联俊, 李楠, 韦继红, 等.冻融胚胎和冻融囊胚对移植周期和分娩结局影响的比较.中国组织工程研究,2014,18(27):4412-4417.
[7]Khan KN, Kitajima M, Hiraki K, et al. Cell proliferation effect of GnRH agonist on pathologicallesions of women with endome-triosis, adenomyosis and uterine myoma. Hum Reprod,2010,25(11):2878-2890.
[8]El-Toukhy T, Taylor A, Khalaf Y, et al. Pituitary suppression inultraso-monitored frozen embryo replacement cycles. Hum Reprod,2004,19(4):874-879.
[9]Morozev V, Ruman J, Kenigsberg D, et al. Natural cycle cryo—thaw transfer may improve pregnancy outcome. J Assist Repred Genet,2007,24(4):119-123.
[10]吴晓燕, 李志凌, 林虹, 等.多次胚胎移植失败患者采用冻融胚胎移植3种内膜准备方案结局分析.中国计划生育学杂志,2014,22(4):248-251.
[11]郭慧, 龚斐, 罗克丽, 等.两种雌孕激素替代法内膜准备对多囊卵巢综合征冷冻胚胎移植临床效果的比较.中国现代医学杂志,2013,23(2):74-77.
10.14164/j.cnki.cn11-5581/r.2015.06.073
2014-12-12]
421001 衡阳市南华星辉生殖健康专科医院
廖宏庆
