帕瑞昔布钠原料的药理化性质及含量的测定方法
2015-03-08刘美娜马攀勤于秋洋刘晓红何仲贵
刘美娜,马攀勤,于秋洋,刘晓红,何仲贵*
(1. 沈阳药科大学 药学院,辽宁 沈阳 110016;2. 宁夏康亚药业有限公司,宁夏 银川 750002)
帕瑞昔布钠原料的药理化性质及含量的测定方法
刘美娜1,马攀勤2,于秋洋1,刘晓红1,何仲贵1*
(1. 沈阳药科大学 药学院,辽宁 沈阳 110016;2. 宁夏康亚药业有限公司,宁夏 银川 750002)
目的研究帕瑞昔布钠理化性质与含量测定方法,为其制剂开发提供理论依据。方法 按照药品研究相关指导原则,研究帕瑞昔布钠初步理化性质,建立容量分析与HPLC法测定帕瑞昔布钠原料药含量,并进行比较。结果帕瑞昔布钠为白色至类白色粉末,在波长(245±2) nm处有最大吸收,熔点约为268 ℃,在2θ角度为17.582o和 23.493o处存在明显晶体衍射峰,帕瑞昔布的pKa为 4.81;容量分析法与HPLC法测定含量,结果无明显差异。结论帕瑞昔布钠理化性质的系统考察,可为其制剂研究提供重要参考;非水滴定法、HPLC法均可有效的控制帕瑞昔布钠的含量,可为本品的质量控制提供科学依据。
药剂学;理化性质;高效液相色谱法;帕瑞昔布钠;非水滴定;含量测定
帕瑞昔布钠,化学名为N-[[4-(5-甲基-3-苯基-4-异恶唑基)苯基]磺酰基]丙酰胺钠盐(图1),是一种新型的非甾体抗炎药[1],是COX-2选择性抑制剂伐地昔布的水溶性、非活性前体药物,在体内可经肝脏迅速几乎完全转化成伐地昔布[2]。其对COX-2的抑制强度是对COX-1的2.8万倍[3],这种高选择性使其可在不影响胃黏膜、肾脏及血小板的功能的同时,发挥镇痛及抗炎作用[4-8]。
帕瑞昔布钠是全球第一个可同时静脉、肌肉注射用的COX-2抑制剂,主要用于治疗中、重度手术后急性疼痛[9]。目前国内研究主要集中于其药理作用、临床应用与联合用药等方面[10-12],对其理化性质与定量分析的研究存在很大的空白。理化常数的测定对其制剂研究具有重要的指导意义,本文作者初步研究了其理化性质,并建立2种含量测定的方法。
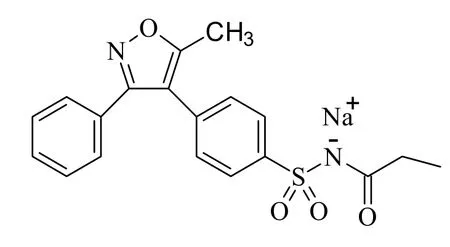
Fig. 1 Structure of parecoxib sodium图 1 帕瑞昔布钠的化学结构式
1 仪器与材料
UV-1801紫外-可见分光光度计(北京瑞利分析仪器公司),高效液相色谱仪(HITACHI Pump L-2130、HITACHI UV Detector L-2455,日本日立公司),ZDJ-4A自动电位滴定仪(上海精密科学仪器有限公司),pHS-2C酸度计(上海理达仪器厂),Adventurer电子分析天平(奥豪斯国际贸易有限公司),水分测定仪(上海雷磁精密仪器厂),棕色滴定管(规格 10 mL,天津玻璃厂)。
帕瑞昔布钠对照品(纯度质量分数≥99.8%,沈阳药科大学,批号 20140420),帕瑞昔布钠供试品(纯度质量分数≥99.0%,沈阳药科大学,批号20140205、20140215、20140315),帕瑞昔布(纯度质量分数≥99.0%,沈阳药科大学,批号20140810),醋酐(分析纯,天津凯信化学工业有限公司),甲醇、乙腈(色谱纯,天津康科德科技有限公司),高氯酸(分析纯,天津政成化学制品有限公司),邻苯二甲酸氢钾、冰醋酸(分析纯,天津博迪化工股份有限公司)。
2 方法与结果
2.1 理化性质考察
2.1.1 外观性状
经肉眼观察,帕瑞昔布钠为白色至类白色粉末。
2.1.2 溶解性的测定
精密称取帕瑞昔布钠细粉适量,于25 ℃加入一定量的不同溶剂中,每隔5 min强力振摇30 s,观察30 min内的溶解情况,无可见的溶质颗粒时,则视为完全溶解,结果见表1。
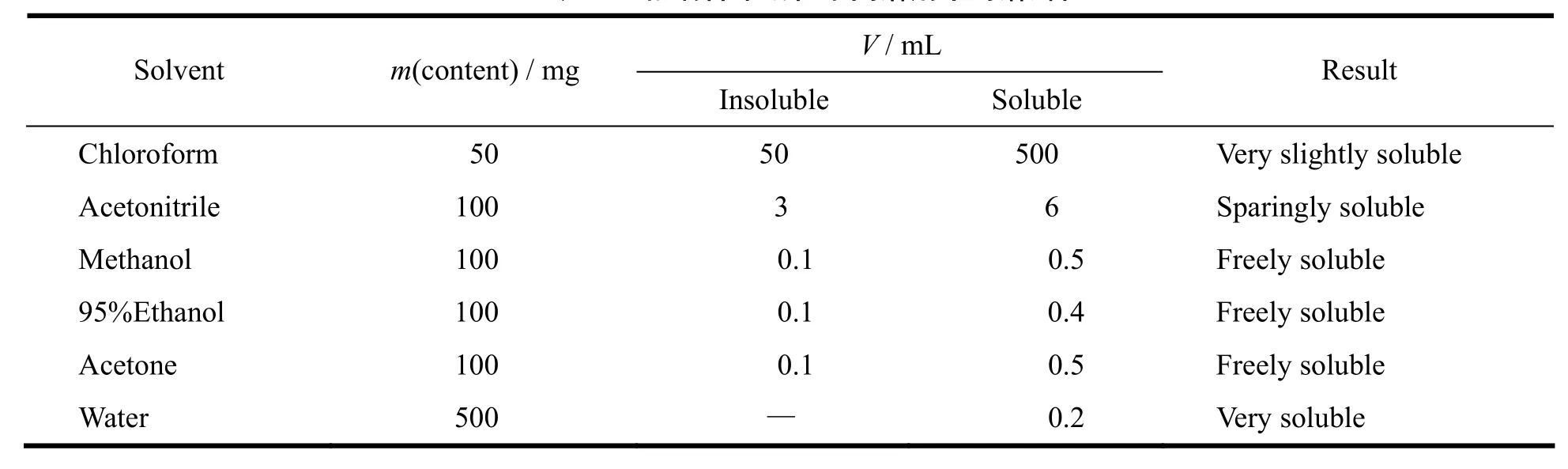
Table 1 The solubility of parecoxib sodium in different solvents表 1 帕瑞昔布钠在不同溶剂中的溶解性
2.1.3 熔点的测定
取本品适量,使用差示扫描量热法(DSC),在50~300 ℃温度内、以10 ℃·min-1的升温速率,测定帕瑞昔布钠熔点,结果熔点约为268 ℃,典型的DSC曲线见图2。

Fig. 2 The DSC thermograph of parecoxib sodium图2 帕瑞昔布钠的DSC曲线
2.1.4 X-射线衍射(XRD)
粉末X-射线衍射法(XRD)是一种直观的晶型测定方法。试验条件为:CuKa靶石墨单色器衍射束单色化,单流30 mA,高压40 kV,扫描2θ角度为3~50o,扫描速度为2o·min-1。扫描结果见图3。由图3可见,帕瑞昔布钠为典型的晶体化合物,在2θ角度17.582o和23.493o处存在明显的晶体衍射峰。
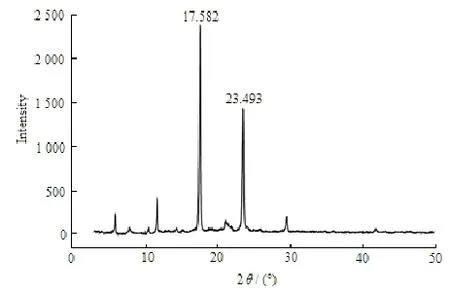
Fig. 3 XRD patterns of parecoxib sodium图 3 帕瑞昔布钠X-射线衍射结果
2.1.5 紫外吸收光谱
精密称取帕瑞昔布钠适量,用水稀释,得质量浓度约为 10 mg·L-1的溶液,以水为空白,按照《中华人民共和国药典》2010年版二部附录ⅣA,在波长200~400 nm内进行扫描,结果见图4。帕瑞昔布钠在波长(245±2) nm 处存在最大吸收,在波长200~220 nm有很强的末端吸收。
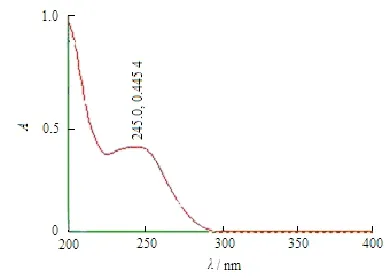
Fig. 4 UV spectrum of parecoxib sodium in water图 4 帕瑞昔布钠在水中的紫外吸收测定结果
2.1.6 帕瑞昔布钠原料药平衡溶解度考察
精密量取水与pH值2.5、5.0、5.8、7.0、8.0、9.0的磷酸盐缓冲液2.0 mL,分别加至10 mL离心管中,并逐渐加入适量帕瑞昔布钠原料药,于 37 ℃水浴恒温振荡并随时观察添加药物至过饱和状态,在过饱和状态下持续振摇72 h。将饱和帕瑞昔布钠溶液以13 000 r·min-1离心10 min,上清液经0.45 μm滤膜滤过,取续滤液进行适当稀释,按“2.3.2”条方法测定,并计算帕瑞昔布钠在各pH值条件下的平衡溶解度。结果表明:帕瑞昔布钠在水中的平衡溶解度为 533.6 g·L-1,在缓冲液中的平衡溶解度随pH值增大而增大(表2)。

Table 2 Equilibrium solubility of parecoxib sodium at different pH phosphate buffer solutions (n=2)表 2 帕瑞昔布钠在不同pH磷酸盐缓冲溶液中的平衡溶解度(n=2)
2.1.7 解离常数的测定
解离常数的测定有电位滴定法、毛细管电泳法、电导法和分光光度法等多种方法[13-14]。作者采用适用范围广、操作简便的紫外分光光度法,测定强碱弱酸盐帕瑞昔布钠相应的弱酸帕瑞昔布的解离常数。
称取帕瑞昔布约5 mg,置于100 mL量瓶中,加入甲醇溶解并稀释至刻度即得储备液。
精密移取上述储备液2.0 mL 7份,置于10 mL量瓶中,分别加入0.1 mol·L-1盐酸水溶液、0.1 mol·L-1氢氧化钠水溶液和pH 值为3.49、4.49、5.00、5.47、5.97的磷酸盐缓冲液,稀释定容,摇匀。以对应的缓冲溶液为空白,测定各药液在波长 245 nm处的吸光度(A)值,根据推倒公式pKa=pH-log[(Aacid-A)/(A-Aalkali)][14]计算帕瑞昔布的pKa, 公式中Aacid为帕瑞昔布在0.1 mol·L-1盐酸水溶液中的吸光度,Aalkali为帕瑞昔布在0.1 mol·L-1氢氧化钠水溶液中的吸光度,结果见表3。
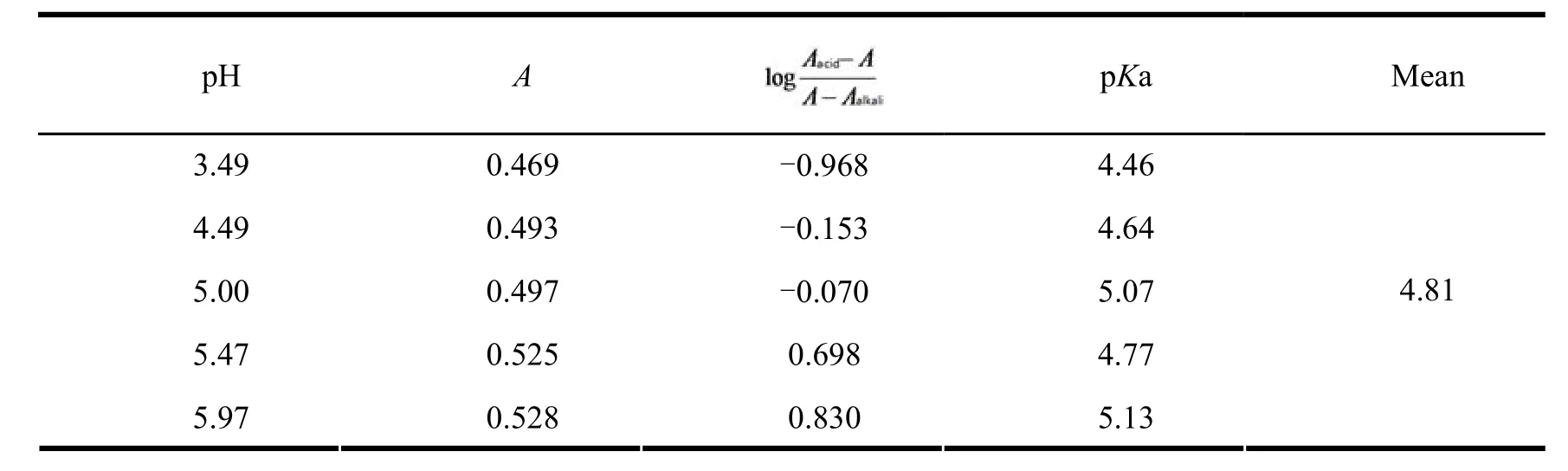
Table 3 The results of dissociation constant determination表3 解离常数测定结果
2.2 非水滴定法
2.2.1 0.1 mol·L-1高氯酸滴定液的配制与标定
无水冰醋酸的制备: 取冰醋酸溶液适量,按其含水量计算,添加醋酐适量(每 1 g水加入醋酐5.22 mL),混匀即得。
取无水冰醋酸适量,置于1 000 mL棕色量瓶中,加入质量分数70%~72%高氯酸8.5 mL,摇匀,缓缓滴加醋酐23 mL,边加边摇,至均匀混合,放冷至室温,用无水冰醋酸定容,摇匀,放置24 h即得,避光贮存备用。
取邻苯二甲酸氢钾基准物质适量,在105 ℃干燥至质量恒定,称取约0.16 g,精密称定,于20 mL无水冰醋酸中溶解,加入结晶紫指示液1滴,用上述高氯酸滴定液,缓慢滴定至蓝色,并用空白试验校正滴定结果。经计算,所配制的高氯酸滴定液浓度为0.102 4 mol·L-1。
2.2.2 滴定终点指示剂颜色的确定
称取本品约0.32 g,精密称定。溶于25 mL无水冰醋酸中,加结晶紫指示液1滴,用0.102 4 mol·L-1高氯酸滴定液滴定,于滴定过程中测定电位,并记录电位突跃时指示剂颜色的变化[15]。以电位(E,mV)为纵坐标,滴定体积(V,mL)为横坐标,绘制E-V滴定曲线(图5A),对结果进行一阶导数处理得图5B。当电位发生突跃时溶液的颜色变为蓝绿色,变化明显,所以当指示剂颜色转变为蓝绿色时即为滴定终点,与2010版《中华人民共和国药典》中大部分弱碱性化合物的终点颜色一致。滴定终点时,消耗0.102 4 mol·L-1高氯酸滴定液约8 mL,实验设计符合2010版《中华人民共和国药典》附录Ⅶ B的相关规定。
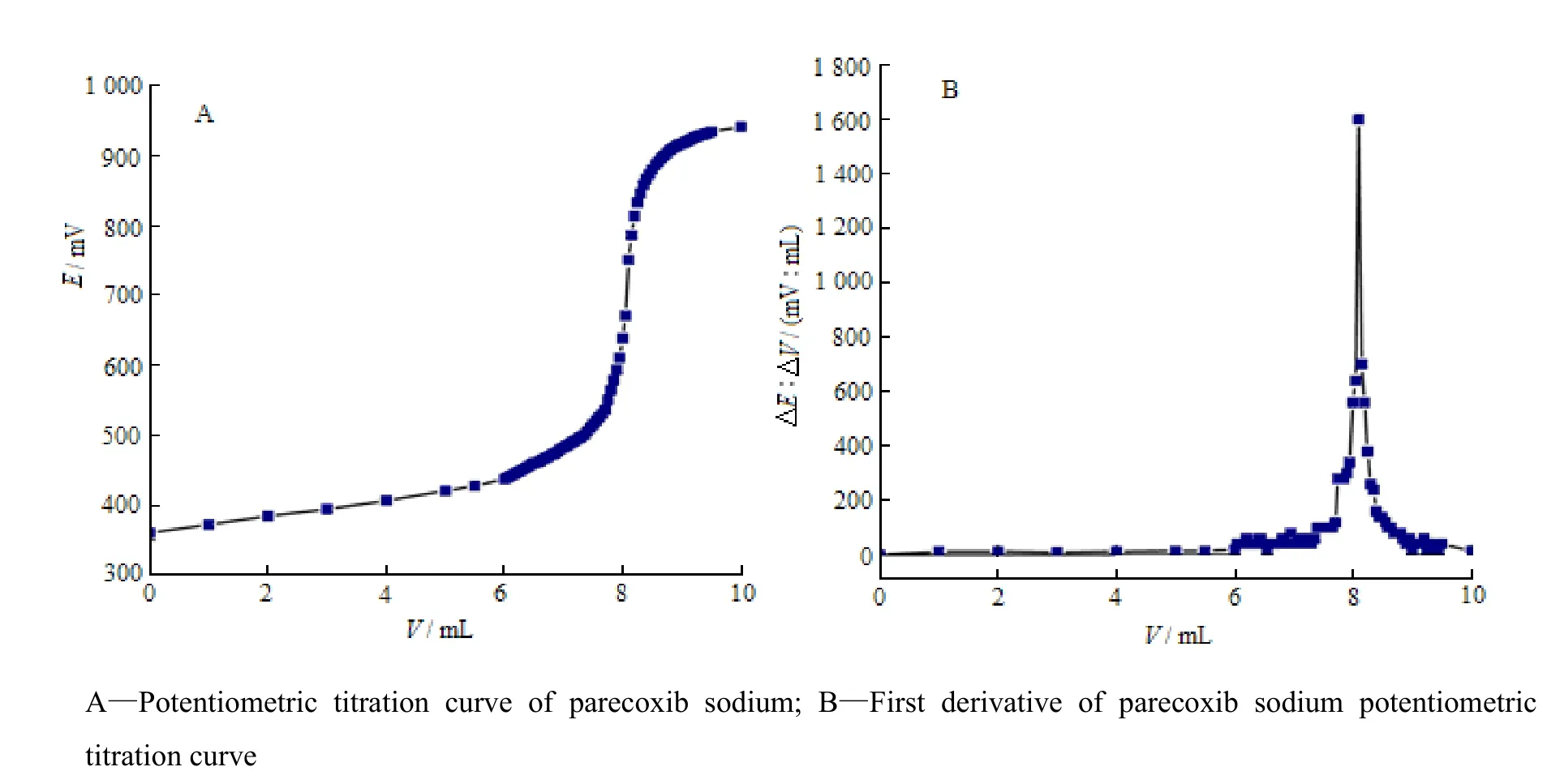
Fig. 5 Potentiometric titration curves of parecoxib sodium图5 帕瑞昔布钠电位滴定曲线
2.2.3 重复性试验
称取帕瑞昔布钠(批号 2 0140205)约0.32 g (n=6),精密称定。按“2.2.7”条方法进行含量测定,帕瑞昔布钠含量质量分数平均值为99.1%,RSD为 0.15%。结果表明本方法重复性良好。
2.2.4 中间精密度试验
由两名不同分析人员在不同时间配制帕瑞昔布钠(批号 20140205)原料药样品(n=6),按“2.2.7”条方法进行含量测定,计算帕瑞昔布钠含量质量分数平均值为99.2%,RSD 为0.17%。结果表明方法中间精密度良好。
2.2.5 样品溶液稳定性试验
称取帕瑞昔布钠(批号 20140205)约0.32 g (n=6),精密称定。室温放置0、2、4、6 h,按“2.2.7”条方法进行含量测定,考察帕瑞昔布钠原料药供试溶液的含量变化情况。测得不同时间的帕瑞昔布钠含量质量分数平均值为99.2%,RSD为 0.23%。结果表明,供试溶液室温放置6 h内稳定。
2.2.6 回收率试验
分别称取帕瑞昔布钠精制品(批号 20140820)约0.256、0.320、0.384 g各3份,精密称定。按“2.2.7”条方法进行含量测定,计算80%、100%、120% 3种浓度水平的回收率(n=3),结果分别为99.2%、100.2%和99.7%,RSD分别为0.15%、0.05%和0.12%,平均回收率为99.7%,均在90%~110%内,符合测定要求。
2.2.7 样品含量测定
称取帕瑞昔布钠样品约0.32 g,精密称定。置于25 mL无水冰醋酸中溶解,加结晶紫指示液1滴,用0.1 mol·L-1高氯酸滴定液滴定至蓝绿色,记录滴定终点体积,并用空白试验校正滴定结果。每l mL 0.1 mol·L-1髙氯酸滴定液相当于C19H17N2O4SNa 39.24 mg。计算样品中帕瑞昔布钠含量质量分数,结果见表4。
2.3 HPLC法
2.3.1 供试溶液与对照溶液的配制
取帕瑞昔布钠样品约25.0 mg,精密称定。置于25 mL量瓶中,加乙腈溶解定容,作为供试储备液,于-20 ℃条件保存备用。精密量取供试储备液5.0 mL置于10 mL量瓶中,用稀释剂乙腈-水(体积比40∶60)定容,作为供试溶液。
取帕瑞昔布钠对照品(批号 20140820)约25.0 mg,精密称定。置于25 mL量瓶中,用乙腈定容,作为对照储备液,于-20 ℃条件保存备用。精密量取对照储备液5.0 mL置于10 mL量瓶中,用稀释剂乙腈-水(体积比40∶60)定容,作为对照溶液。
2.3.2 色谱条件与系统适用性试验
色谱柱为COSMOSIL PAQ C18柱(250 mm×4.6 mm,5 μm),流动相为甲醇-10 mmol·L-1磷酸氢二钠水溶液(用磷酸调节pH值至3.0±0.1)(体积比53∶47),柱温为30 ℃,检测波长为215 nm,流速为1.0 mL·min-1,进样量为10 μL。参照进口注册标准[16],在上述色谱条件下,系统适用性标准定为帕瑞昔布峰的理论板数大于5 000,拖尾因子应不大于2.0。
2.3.3 专属性试验
取帕瑞昔布钠原料药约25.0 mg,置于10 mL玻璃试管中,分别在酸、光照、氧化、碱以及热5种条件下进行破坏实验。具体条件如下:4 mol·L-1盐酸溶液4 mL,(4500±500) lx 光照10 d,体积分数30%过氧化氢溶液4 mL,8 mol·L-1氢氧化钠溶液 4 mL以及直火加热30 s。加乙腈-水(体积比40∶60)溶解各样品,并转移至50 mL量瓶中,得含帕瑞昔布钠约0.5 g·L-1的样品溶液,进样分析。结果表明,帕瑞昔布钠原料药在加热和氧化破坏条件下最不稳定,其次是酸性条件,在光照条件下最稳定。各破坏条件下产生的杂质峰均能与主药峰得到良好的分离,表明方法专属性良好,结果见图6。
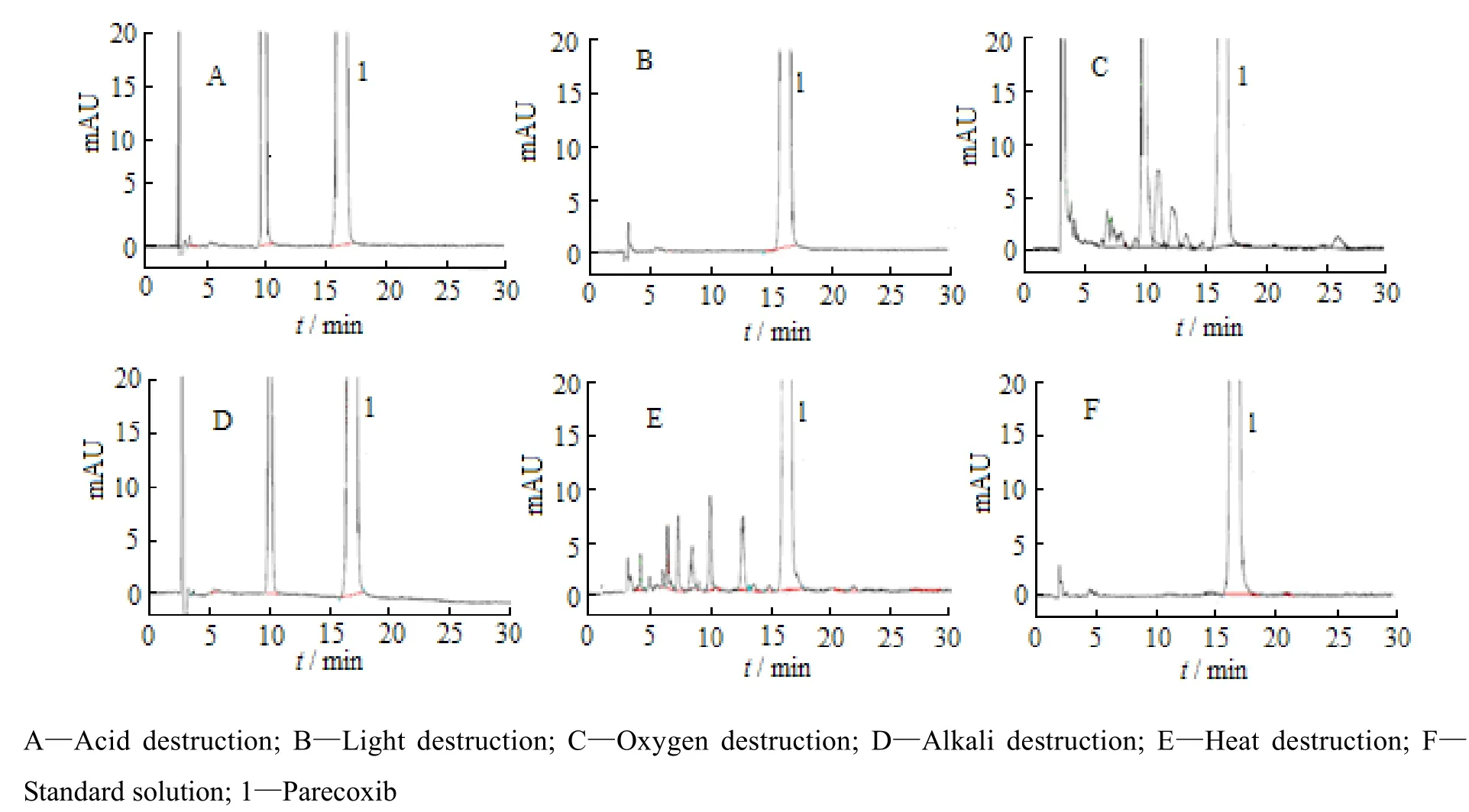
Fig. 6 Chromatograms of destruction test for parecoxib sodium图 6 帕瑞昔布钠破坏实验高效液相色谱图
2.3.4 线性相关性试验
分别精密量取帕瑞昔布钠对照储备液1.0、2.0、3.0、4.0、5.0、6.0、7.0和8.0 mL置于10 mL量瓶中,用乙腈-水(体积比40∶60)稀释至刻度,摇匀,制得帕瑞昔布钠质量浓度约为0.1、0.2、0.3、0.4、0.5、0.6、0.7和0.8 g·L-1的系列标准溶液。分别精密量取上述标准溶液各10 μL,注入高效液相色谱仪,并记录峰面积。以帕瑞昔布钠溶液的质量浓度(ρ,g·L-1)为横坐标,峰面积(A)为纵坐标,进行线性回归,得回归方程如下:A=3.42×107ρ+1.32×104,r=0.999 7。结果表明,帕瑞昔布钠质量浓度在0.1~0.8 g·L-1内与峰面积呈良好的线性相关性。
2.3.5 检测限与定量限的确定
取质量浓度为0.1 g·L-1的帕瑞昔布钠对照溶液,用乙腈-水(体积比40∶60)逐级稀释,精密量取10 μL,进样分析。以信噪比10∶1计算定量限,以信噪比3∶1计算检测限。结果表明,帕瑞昔布钠的定量限为20 µg·L-1,检测限为6 µg·L-1。
2.3.6 精密度试验
取质量浓度为0.5 g·L-1帕瑞昔布钠对照溶液,连续测定6次,计算峰面积相对标准偏差,RSD小于2.0%,表明仪器精密度良好。
取帕瑞昔布钠样品(批号 20140205),按“2.3.1”条方法平行制备供试溶液6份,按外标法计算帕瑞昔布钠含量,测得含量质量分数平均值为99.4%,RSD为0.6%,表明该方法重复性良好。2.3.7 回收率试验
分别称取帕瑞昔布钠对照品(批号 20140820)20.0、25.0、30.0 mg各3份,精密称定。置于25 mL量瓶中,按“2.3.1”条方法制备正常进样浓度的80%、100%和120% 3种质量浓度水平的对照溶液,按“2.3.9”条方法测定,计算各浓度水平的回收率。结果分别为99.8%、100.0%和99.3%,RSD分别为0.40%、0.20%和0.24%,平均回收率为99.7%,均符合测定要求。
2.3.8 溶液稳定性试验
取“2.3.1”条下的对照溶液,于阳光不直射的室温条件下放置,分别于 0、2、4、6、8、10、12和24 h取样依法测定,计算帕瑞昔布峰面积变化率。结果24 h时为-0.1%,说明溶液在24 h内稳定。
2.3.9 样品含量测定
分别称取3批帕瑞昔布钠样品与帕瑞昔布钠对照品,按“2.3.1”条方法制备对照溶液与供试溶液,按“2.3.2”条色谱条件,取各溶液10 μL,注入高效液相色谱仪,并记录色谱图,按外标法计算帕瑞昔布钠含量,结果见表4。经比较,非水滴定法与HPLC法含量测定结果无明显差异[15,17]。
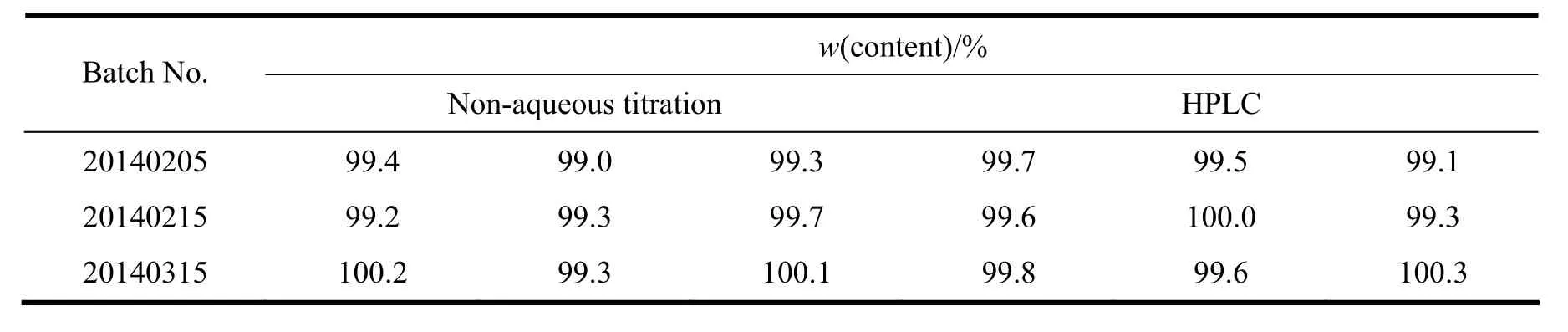
Table 4 Results of parecoxib sodium content determination (n=3)表 4 帕瑞昔布钠含量测定结果(n=3)
3 结论与讨论
a. 作者对帕瑞昔布钠原料药的理化性质进行了初步研究,帕瑞昔布钠为白色或类白色粉末,极易溶于水,易溶于甲醇、体积分数为95%乙醇和丙酮,在乙腈中略溶,极微溶于氯仿。帕瑞昔布钠水溶液在(245±2) nm处有最大吸收,在200~220 nm有较强的末端吸收,由DSC测得其熔点约为268 ℃,帕瑞昔布钠为典型的晶体化合物,在2θ角度17.582o与23.493o处存在明显晶体衍射峰,帕瑞昔布的pKa为4.81。帕瑞昔布钠在水中的平衡溶解度为533.6 g·L-1,在缓冲液中的平衡溶解度随pH增大而增大,理化性质的研究对其制剂的开发有重要的指导意义。
b. 帕瑞昔布钠为弱碱性化合物,使用非水滴定法测定含量时,终点指示剂颜色变化明显。参照注射用帕瑞昔布钠进口注册标准[16],并根据理化性质研究结果,建立了高效液相色谱法测定帕瑞昔布钠含量。通过对帕瑞昔布钠原料药破坏样品进行分析,为使主药与杂质峰达到较好的分离,实验中对多个流动相组成系统进行考察,最终选择甲醇-水体系,为了提高响应、改善峰形,水相体系确定为磷酸氢二钠缓冲溶液。
c. 作者采用2种含量测定方法测定3批帕瑞昔布钠原料药的含量,测定结果无明显差异,方法学考察结果表明,2种方法均能有效的控制本品的含量,可为帕瑞昔布钠原料药的质量控制提供科学依据,但由于高效液相法流动相体系pH值在3.0左右,帕瑞昔布钠在流动相中以帕瑞昔布的形式存在,测定的主药峰为帕瑞昔布,而帕瑞昔布为帕瑞昔布钠合成中最后一步的起始原料,本研究建立的高效液相色谱法不能区分帕瑞昔布钠与帕瑞昔布,而非水滴定法可以区分帕瑞昔布钠与帕瑞昔布,因此,非水滴定法应为优先选择。
[1] CHEER S M, GOA K L. Parecoxib (Parecoxib Sodium)[J]. Drugs, 2001, 61(8): 1133-1141.
[2] 许瑞, 张建杰. 帕瑞昔布钠主要降解杂质-伐地昔布的 HPLC 测定方法研究[J]. 中国卫生检验杂志, 2014, 24(19): 2785-2790.
[3] TALLCY J J, BERTENSHAW S R, BROWN D L, et al. N-[[(5-methyl-3-phenylisoxazol-4-yl)-phenyl]sulfonyl] propanamide, sodium salt, parecoxib sodium: A potent and selective inhibitor of COX-2 for parenteral administration[J]. J Med Chem, 2000, 43(9): 1661-1663.
[4] SILVERSTEIN F E, FAICH G, GOLDSTEIN J L, et al. Gastrointestinal toxicity with celecoxib vs nonsteroidal anti-inflammatory drugs for osteoarthritis and rheumatoid arthritis: the class study: a randomized controlled trial. Celecoxib long-term arthritis safety study[J]. JAMA, 2000, 284(10): 1247-1255.
[5] RASMUSSEN G L, STECKNER K, HOGUE C, et al. Intravenous parecoxib sodium for acute pain after orthopedic knee surgery[J]. Am J Orthop, 2002, 31(6): 336-343.
[6 ] BARTON S F, LANGELAND F F, SNABES M C, et al. Efficacy and safety of intravenous parecoxib sodium in relieving acute postoperative pain following gynecologic laparotomy surgery[J]. Anesthesiology, 2002, 97(2): 306-314.
[7] MALAN T P, GORDON S, HUBBARD R, et al. The cyclooxygenase-2-specific inhibitor parecoxib sodium is aseffective as 12 mg of morphine administered intramuscularly for treating pain after gynecologic laparotomy surgery[J]. Anesth Analg, 2005, 100(2): 454-460.
[8] DANIELS S E, GROSSMAN E H, KUSS M E, et al. A double-blind, randomized comparison of intramuscularly and intravenously administered parecoxib sodium versus ketorolac and placebo in a post-oral surgery pain model[J]. Clin Ther, 2001, 23(7): 1018-1031.
[9] 练毅, 阚永星. 帕瑞昔布钠临床应用进展[J]. 临床医药实践, 2009, 18(2): 144-146.
[10] 黄礼兵, 崔苏扬. 帕瑞昔布钠在术后镇痛中的应用进展[J]. 重庆医学, 2010, 39(3): 355-358.
[11] 何娟, 马虹. 帕瑞昔布钠复合舒芬太尼用于胸科术后患者静脉自控镇痛的观察[J]. 临床麻醉学杂志, 2011, 27(3): 239-241.
[12] 潘国标, 何荣新, 王卫, 等. 帕瑞昔布钠联合盐酸羟考酮缓释片在全膝关节置换术后镇痛中的应用[J]. 临床骨科杂志, 2013, 16(6): 646-649.
[13] 吴禄春, 甘勇军, 方大树, 等. 利用紫外分光光度法测定罗格列酮游离碱的 pKa值[J]. 重庆医科大学学报, 2009, 34 (11): 1546-1548.
[14] 李慧, 张起, 赵燕芳, 等. 抗痛风药 SE-10平衡溶解度、表观油水分配系数及解离常数的测定[J]. 中国药剂学杂志, 2015, 13(1): 27-34.
[15] 岳喜典, 王丽, 曲桂武, 等. 非水滴定法测定丹参素钠原料药的含量[J]. 中国实验方剂学杂志, 2013, 19(15):137-139.
[16] 国家食品药品监督管理局进口药品注册标准[S]. 标准号: JX20070042.
[17] 姬莉芳, 李清, 毕开顺, 等. 妥洛特罗原料药含量测定方法的比较[J]. 中国现代应用药学, 2014, 31(12): 1493-1496.
Physicochemical properties and quantitative determination methods of parecoxib sodium
LIU Mei-na1, MA Pan-qin2, YU Qiu-yang1, LIU Xiao-hong1, HE Zhong-gui1*
(1. School of Pharmacy, Shenyang Pharmaceutical University, Shenyang 110016, China; 2. Kangya of Ningxia Pharmaceuticals Co., Ltd., Yinchuan 750002, China)
ObjectiveTo preliminarily study the physicochemical properties and to develop a method to determine the content of parecoxib sodium. MethodsThe physicochemical properties such as solubility, melting point, ultraviolet absorption spectrum and so on were investigated according to some related guiding principles for pharmaceutical research and development. To determine the content of parecoxib sodium, non-aqueous titration method and HPLC method were developed and compared.ResultsParecoxib sodium was white powder with a maximum absorption at (245 ± 2) nm. Its melting point was 268 ℃. XRD results showed two characteristic diffraction peaks located at 2θ = 17.582°and 23.493°,respectively. The pKa value of parecoxib is 4.81. The results of non-aqueous titration were comparable to the results of HPLC.ConclusionsThe preliminary study on physicochemical properties of parecoxib sodium can provide important information for the subsequent pharmaceutical research and development. Both the non-aqueous titration method and high performance liquid chromatography (HPLC) method can effectively control the content of parecoxib sodium.
pharmaceutics; physicochemical properties; HPLC; parecoxib sodium; non-aqueous titration method; quantitative analysis
R 94
:A
(本篇责任编辑:赵桂芝)
(2015)06-0218-11
10.14146/j.cnki.cjp.2015.06.004
2015-04-02
刘美娜(1989-), 女(汉族), 辽宁营口人, 硕士研究生, E-mail liumeina.happy@163.com; *
: 何仲贵(1965-), 男(汉族), 宁夏盐池人, 教授, 博士, 博士生导师, 主要从事药物新剂型与新技术研究, Tel. 024-23986321, E-mail hezhonggui@vip.163.com。
