普瑞巴林胃漂浮缓释片的制备及体外释放研究
2015-03-08王东凯
黄 旭,王东凯
(沈阳药科大学 药学院,辽宁 沈阳 110016)
普瑞巴林胃漂浮缓释片的制备及体外释放研究
黄 旭,王东凯*
(沈阳药科大学 药学院,辽宁 沈阳 110016)
目的制备普瑞巴林胃漂浮缓释片,并通过紫外分光光度法考察其体外释放影响因素。方法以普瑞巴林为模型药物,分别以聚氧乙烯303、聚氧乙烯N-60K、羟丙基甲基纤维素K15M和海藻酸钠为基质制备胃漂浮缓释片,采用紫外可见分光光度法,在波长365 nm处测定吸光度,计算释放度。结果聚氧乙烯303每片用量为250 mg、聚氧乙烯N-60K每片用量为250 mg和海藻酸钠每片用量为150 mg时漂浮性能和释放度最佳。结论制备的普瑞巴林胃漂浮缓释片漂浮性良好, 且能够达到缓释的目的。
药剂学;胃漂浮缓释片;紫外可见分光光度法;普瑞巴林;释放度
普瑞巴林(pregabalin)是一种在3位有异丁基取代的γ-氨基丁酸(GABA)类似物,具有抗癫痫、止痛以及抗焦虑等治疗作用[1],被作为加巴喷丁的取代品而开发。普瑞巴林目前的每日给药剂量为150~900 mg,每日需要给药至少2次,且普瑞巴林有特定的吸收窗,主要在胃部和小肠部位吸收[2],作者在上述性质的基础上设计了24 h胃漂浮缓释片剂,使药物制剂长时间漂浮滞留于胃中,增加药物在胃肠道的吸收时间。该制剂经口给药遇胃液后,外层凝胶膨胀,在制剂表面形成一层凝胶屏障,维持骨架的密度小于胃内容物(1.004~1.01)而漂浮于胃液上,使其不受胃排空的影响,并成为长时间驻留于胃的药物贮库,药物从凝胶骨架中缓慢向胃液中迁移,直到所负载的药物释放完全。因此作者研制了普瑞巴林胃漂浮缓释片,并参照文献[3]中普瑞巴林含量测定方法,采用紫外可见分光光度法测定本品的释放度。
1 仪器与材料
UV-1700紫外-可见分光光度计(日本Shimadzu公司),8200FFLIN ERWEKA溶出仪(德国ERWEKA有限公司),Bsa423S电子天平(北京赛多利斯仪器系统有限公司),创博佳维C&C600B单冲压片机(北京创博佳维科技有限公司),YD-2硬度仪(天津天光光学仪器有限公司)。
聚氧乙烯303、聚氧乙烯N-60K(陶氏化学公司),交联聚维酮(国际特品(香港)有限公司),海藻酸钠(青岛晶岩生物科技开发有限公司),硬脂酸镁(山东聊城阿华制药有限公司),HPMC K15M(上海卡乐康包衣技术有限公司),硼酸(分析纯,国药集团化学试剂有限公司),十六烷基三甲基溴化铵(分析纯)、2,4-二硝基氟苯(分析纯)(百灵威科技有限公司),普瑞巴林对照品(纯度质量分数为99.8%,自制),普瑞巴林胃漂浮缓释片(自制)。
2 方法与结果
2.1 胃漂浮缓释片的制备
将普瑞巴林、聚氧乙烯303、聚氧乙烯N-60K、海藻酸钠、HPMC K15M、交联聚维酮分别过178 μm筛,按处方量分别称取并混合均匀,之后加入处方量的硬脂酸镁,混合均匀,压片,制备100片。硬度控制在16~20 kg。
2.2 体外释放度分析方法的建立
2.2.1 释放介质的选择
取普瑞巴林胃漂浮缓释片6片,采用《中华人民共和国药典》2010年版二部附录ⅩC溶出度测定法第二法的装置,按《中华人民共和国药典》2010年版二部附录ⅩD释放度测定法第一法测定。分别以60 mmol·L-1盐酸水溶液、pH值4.5醋酸盐缓冲液、pH值6.8磷酸盐缓冲液和纯化水1 000 mL为释放介质,桨法,转速为50 r·min-1,温度为37 ℃,依法操作。于0.5、1、2、4、8、12、16、20和24 h时分别取溶液5 mL,滤过,精密量取续滤液适量置于10 mL量瓶中,加入0.2 mol·L-1硼酸盐缓冲液1 mL、27 mmol·L-1十六烷基三甲基溴化铵溶液0.8 mL和质量分数为0.3% 的2,4-二硝基氟苯0.6 mL,放置5 min后,加水至10 mL,按《中华人民共和国药典》2010年版二部附录ⅣA紫外-可见分光光度法,在波长365 nm处测定吸光度。另取普瑞巴林对照品适量,精密称定,加水溶解并定量稀释制成每1 mL约含普瑞巴林100 μg的溶液,精密量取0.6 mL置于10 mL量瓶中,加入0.2 mol·L-1硼酸盐缓冲液1 mL、27 mmol·L-1十六烷基三甲基溴化铵溶液0.8 mL和质量分数为0.3% 的2,4-二硝基氟苯0.6 mL,放置5 min后,加水至10 mL,同法测定吸光度,计算每片在不同时间的释放量,绘制不同释放介质的释放曲线(图1)。
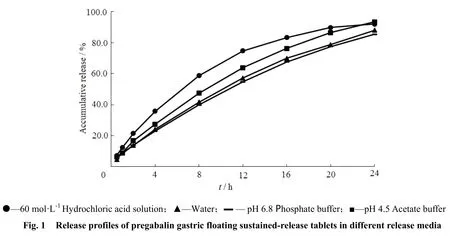
图1 普瑞巴林胃漂浮缓释片在不同介质中的释放曲线
结果表明,样品在60 mmol·L-1盐酸水溶液中的释放最完全,比在pH值4.5醋酸盐缓冲液、水和pH值6.8磷酸盐缓冲液中更快一些。而且普瑞巴林胃漂浮缓释片在胃部滞留时间较长,因此主要在胃部吸收。考虑60 mmol·L-1盐酸水溶液能更好的模拟体内吸收环境,并且普瑞巴林胶囊进口注册标准中溶出介质选用60 mmol·L-1盐酸水溶液,故最终选用60 mmol·L-1盐酸水溶液1 000 mL进行测定。
2.2.2 检测波长的选择
称取普瑞巴林适量,用60 mmol·L-1盐酸水溶液溶解并定量稀释制成每1 mL约含普瑞巴林100 μg的溶液,精密量取0.8 mL置于10 mL量瓶中,加入0.2 mol·L-1硼酸盐缓冲液1 mL、27 mmol·L-1十六烷基三甲基溴化铵溶液0.8 mL和质量分数为0.3% 的2,4-二硝基氟苯0.6 mL,放置5 min后,加60 mmol·L-1盐酸水溶液至10 mL,配成适宜浓度的样品溶液,同法配制相应浓度的辅料溶液,分别以相应的溶剂为空白对照液,于波长200~800内进行紫外扫描,结果见图2。
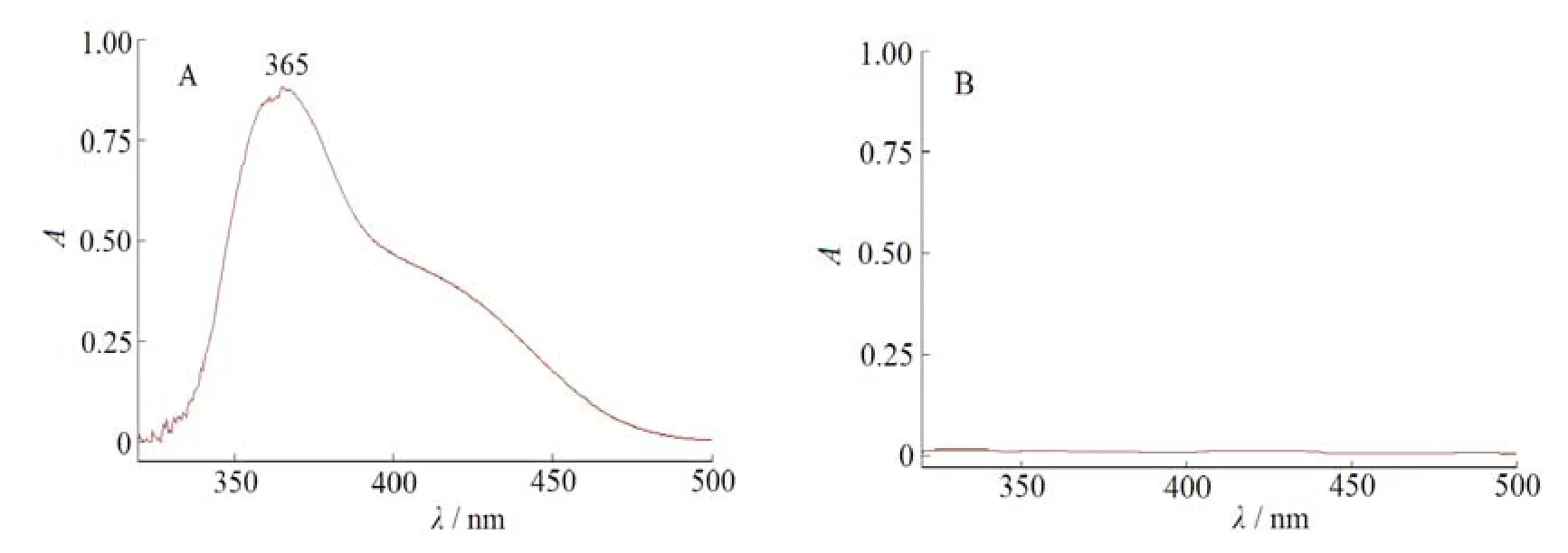
Fig. 2 Spectra of the complex of pregabalin(A) and blank materials (B) with Sanger’s reagent in presence of cetrimide图2 普瑞巴林(A)及空白辅料(B)分别与桑格试剂在十六烷基三甲基溴化铵存在下反应生成复合物的紫外扫描图
结果表明,该复合物在波长365 nm处有最大吸收,空白辅料无干扰。故选取365 nm作为60 mmol·L-1盐酸水溶液中的测定波长。
2.2.3 线性关系的考察
称取普瑞巴林对照品适量,精密称定,加60 mmol·L-1盐酸水溶液溶解并定量稀释制成每1 mL约含普瑞巴林100 μg的溶液。分别精密量取0.2~0.8 mL的系列药物溶液置于10 mL量瓶中,加入0.2 mol·L-1硼酸盐缓冲液1 mL、27 mmol·L-1十六烷基三甲基溴化铵溶液0.8 mL和质量分数为0.3% 的2,4-二硝基氟苯0.6 mL,放置5 min后,加水至10 mL,按《中华人民共和国药典》2010年版二部附录ⅣA紫外-可见分光光度法,在波长365 nm处测定吸光度,以吸光度为纵坐标,质量浓度为横坐标进行线性回归,得线性方程A=9.75×10-2ρ+2.9×10-2,r =0.999 3。结果普瑞巴林质量浓度在1.996~7.984 mg·L-1内与吸光度线性关系良好。
2.2.4 精密度试验
取本品1片,采用《中华人民共和国药典》2010年版二部附录ⅩC溶出度测定法第二法装置,按《中华人民共和国药典》2010年版二部附录ⅩD释放度测定法第一法测定。以60 mmol·L-1盐酸水溶液1 000 mL为释放介质,转速为50 r·min-1,温度为37 ℃,依法操作。1 h后取释放液,滤过,连续精密量取续滤液1.5 mL分别置于6个10 mL量瓶中,加入0.2 mol·L-1硼酸盐缓冲液1 mL、27 mmol·L-1十六烷基三甲基溴化铵溶液0.8 mL和质量分数为0.3% 的2,4-二硝基氟苯0.6 mL,放置5 min后,加水至10 mL,作为供试溶液。按《中华人民共和国药典》2010年版二部附录ⅣA紫外-可见分光光度法,在波长365 nm处测定吸光度,结果见表1。
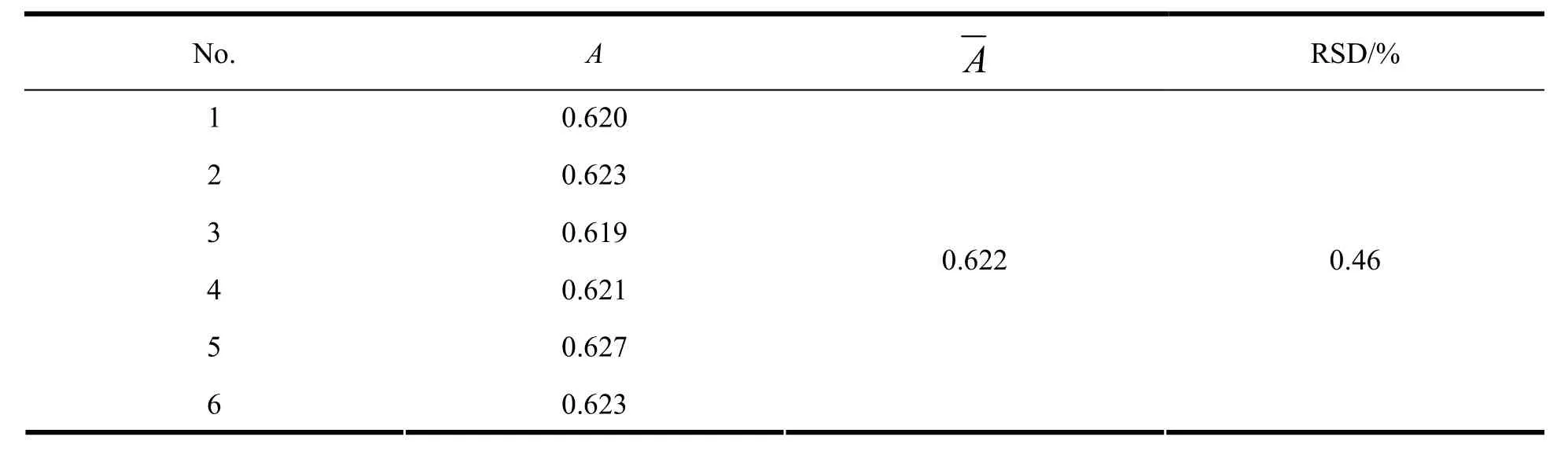
Table 1 Results of precision of pregabalin表1 普瑞巴林的精密度试验结果
结果表明该方法的精密度良好。
2.2.5 回收率试验
按20片处方量分别称取空白全辅料和主药完全释放量的10%、50%、100%、120%,充分混合均匀作为回收率样品。取回收率样品适量,精密称定,加60 mmol·L-1盐酸水溶液溶解并定量稀释制成每1 mL约含普瑞巴林100 μg的溶液。精密量取0.6 mL药物溶液置于10 mL量瓶中,加入0.2 mol·L-1硼酸盐缓冲液1 mL、27 mmol·L-1十六烷基三甲基溴化铵溶液0.8 mL和质量分数为0.3% 的2,4-二硝基氟苯0.6 mL,放置5 min后,加水至10 mL;另取本品对照品适量,同法操作。将供试溶液与对照溶液在波长365 nm处测定吸光度,结果见表2。
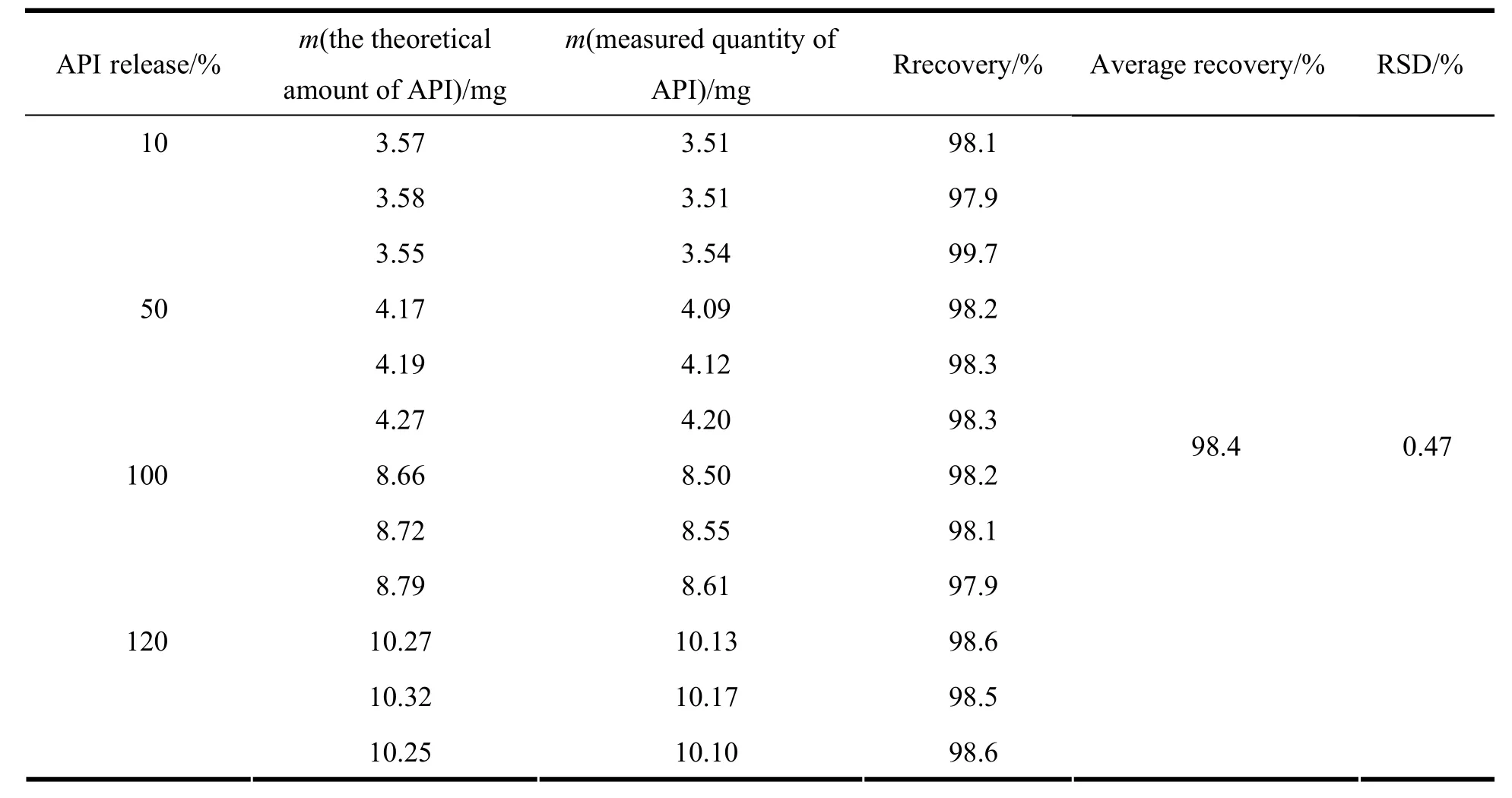
Table 2 Results of accuracy of pregabalin by recovery studies表2 普瑞巴林的回收率结果
本品平均回收率为98.4%,RSD为0.47%。结果表明方法回收率良好,可以用来测定释放介质中不同时间点普瑞巴林的释放量。
2.2.6 释放介质中的稳定性考察
取本品1片,采用《中华人民共和国药典》2010年版二部附录ⅩC溶出度测定法第二法装置,按《中华人民共和国药典》2010年版二部附录ⅩD释放度测定法第一法测定。以60 mmol·L-1盐酸水溶液1 000 mL为释放介质,转速为50 r·min-1,温度为37 ℃,依法操作。1 h后取释放液,滤过,精密量取续滤液1.5 mL置于10 mL量瓶中,加入0.2 mol·L-1硼酸盐缓冲液1 mL、27 mmol·L-1十六烷基三甲基溴化铵溶液0.8 mL和质量分数为0.3% 的2,4-二硝基氟苯0.6 mL,放置5 min后,加水至10 mL,作为供试溶液,在室温于自然光和避光条件下分别放置0、3、6、9、12、18、24、36 h后在波长365 nm处分别测定吸光度,结果见表3。

Table 3 Results of solution stability of pregabalin表3 普瑞巴林溶液的稳定性测定结果
8个不同时间测定供试溶液吸光度的平均值分别为0.620和0.619,相对标准偏差RSD为0.43%和0.48%(n=8)。结果表明供试溶液在室温条件下放置36 h稳定性良好,无需避光。
2.2.7 滤膜吸附试验
取本品1片,采用《中华人民共和国药典》2010年版二部附录ⅩC溶出度测定法第二法装置,按《中华人民共和国药典》2010年版二部附录ⅩD释放度测定法第一法测定。以60 mmol·L-1盐酸水溶液1 000 mL为释放介质,转速为50 r·min-1,温度为37 ℃,依法操作。1 h后取释放液,滤过,作为供试溶液。取上述供试溶液10 mL置于离心管中,4 000 r·min-1高速离心5 min,取上清液1.5 mL 置于10 mL量瓶中,加入0.2 mol·L-1硼酸盐缓冲液1 mL、27 mmol·L-1十六烷基三甲基溴化铵溶液0.8 mL和质量分数为0.3% 的2,4-二硝基氟苯0.6 mL,放置5 min后,加水至10 mL,作为溶液1;另取上述供试溶液适量,经0.45 μm 微孔滤膜过滤,取续滤液1.5 mL 置于10 mL量瓶中,加入0.2 mol·L-1硼酸盐缓冲液1 mL、27 mmol·L-1十六烷基三甲基溴化铵溶液0.8 mL和质量分数为0.3% 的2,4-二硝基氟苯0.6 mL,放置5 min后,加水至10 mL,作为溶液2。按《中华人民共和国药典》2010年版二部附录ⅣA紫外-可见分光光度法,在波长365 nm处测定吸光度,结果见表4。
Table 4 Results of membrane adsorption of pregabalin表4 普瑞巴林的滤膜吸附试验结果
结果表明:滤膜对溶液没有吸附作用,采用滤膜过滤不会影响释放度的测定。
2.2.8 释放度均一性试验
取本品6片,采用《中华人民共和国药典》2010年版二部附录ⅩC溶出度测定法第二法的装置,按《中华人民共和国药典》2010年版二部附录ⅩD释放度测定法第一法测定。以60 mmol·L-1盐酸水溶液1 000 mL为释放介质,转速为50 r·min-1,温度为37 ℃,依法操作。于0.5、1、2、4、8、12、16、20和24 h时分别取溶液5 mL,滤过,精密量取续滤液适量置于10 mL量瓶中,加入0.2 mol·L-1硼酸盐缓冲液1 mL、27 mmol·L-1十六烷基三甲基溴化铵溶液0.8 mL和质量分数为0.3% 的2,4-二硝基氟苯0.6 mL,放置5 min后,加水至10 mL,按《中华人民共和国药典》2010年版二部附录ⅣA紫外-可见分光光度法,在波长365 nm处测定吸光度;另取普瑞巴林对照品适量,精密称定,加水溶解并定量稀释制成每1 mL约含普瑞巴林100 μg的溶液,精密量取0.6 mL置于10 mL量瓶中,加入0.2 mol·L-1硼酸盐缓冲液1 mL、27 mmol·L-1十六烷基三甲基溴化铵溶液0.8 mL和质量分数为0.3% 的2,4-二硝基氟苯0.6 mL,放置5 min后,加水至10 mL,同法测定吸光度,计算每片在不同时间的释放量。释放均一性试验曲线见图3。
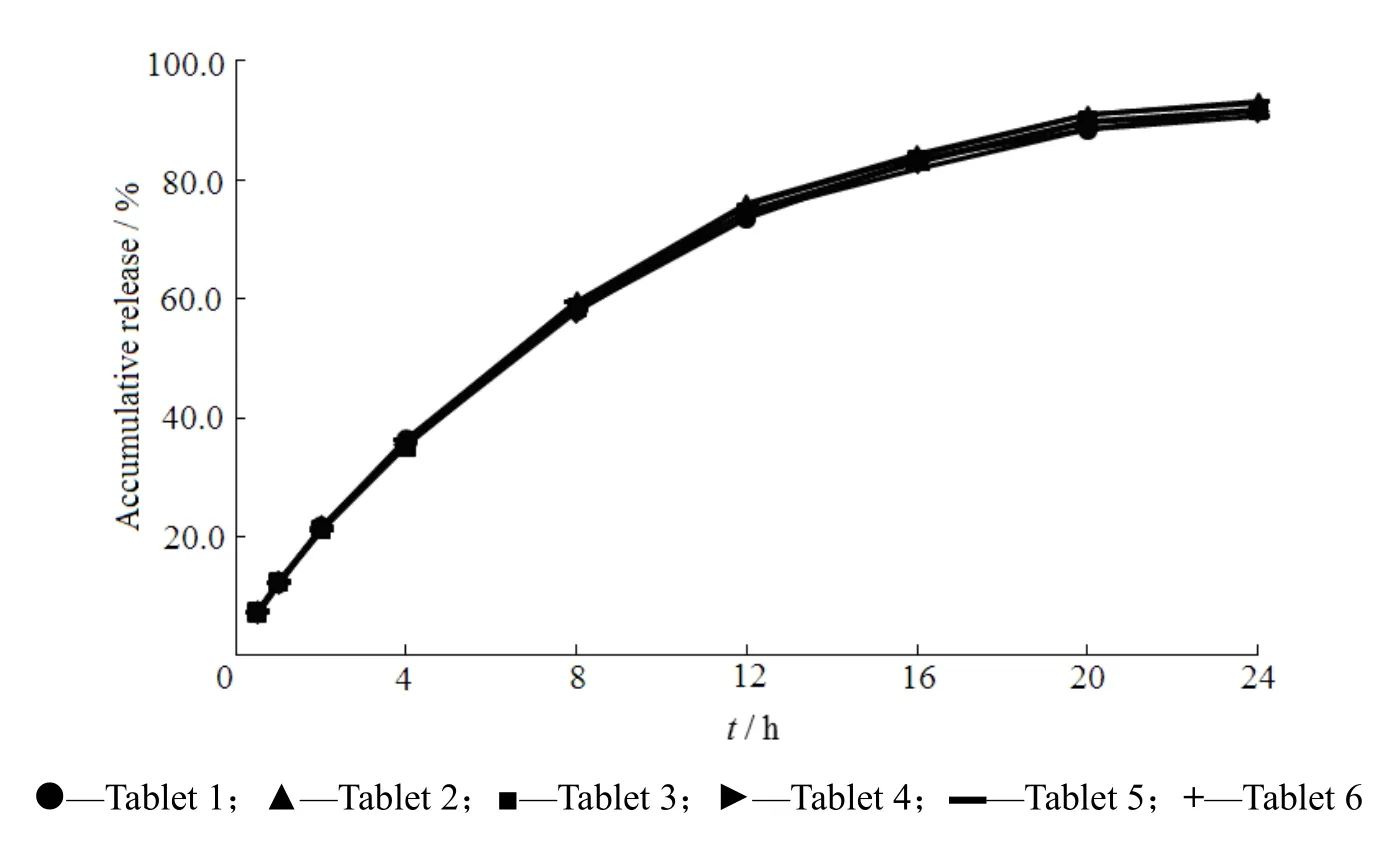
Fig. 3 Release profiles of pregabalin gastric floating sustained-release tablets in release uniformity test图3 普瑞巴林的释放度均一性试验释放曲线
2.3 胃漂浮缓释片释放度的测定
取本品6片,采用《中华人民共和国药典》2010年版二部附录ⅩC溶出度测定法第二法的装置,按《中华人民共和国药典》2010年版二部附录ⅩD释放度测定法第一法测定。以60 mmol·L-1盐酸水溶液1 000 mL为释放介质,转速为50 r·min-1,温度为37 ℃,依法操作。于0.5、1、2、4、8、12、16、20和24 h时分别取溶液5 mL,滤过,精密量取续滤液适量置于10 mL量瓶中,加入0.2 mol·L-1硼酸盐缓冲液1 mL、27 mmol·L-1十六烷基三甲基溴化铵溶液0.8 mL和质量分数为0.3% 的2,4-二硝基氟苯0.6 mL,放置5 min后,加水至10 mL,按《中华人民共和国药典》2010年版二部附录ⅣA紫外-可见分光光度法,在波长365 nm处测定吸光度;另取普瑞巴林对照品适量,精密称定,加水溶解并定量稀释制成每1 mL约含普瑞巴林100 μg的溶液,精密量取0.6 mL置于10 mL量瓶中,加入0.2 mol·L-1硼酸盐缓冲液1 mL、27 mmol·L-1十六烷基三甲基溴化铵溶液0.8 mL和质量分数为0.3% 的2,4-二硝基氟苯0.6 mL,放置5 min后,加水至10 mL,同法测定吸光度,计算每片在不同时间点的释放量。
2.4 体外漂浮性能试验
将所制得的普瑞巴林胃漂浮缓释片置于37 ℃、1 000 mL 的60 mmol·L-1盐酸水溶液中,在搅拌转速为50 r·min-1模拟胃蠕动条件下观察胃漂浮缓释片的起漂时间和持续漂浮时间。体外设计目标为漂浮制剂应放入人工胃液后5 min 内起漂,且可以维持漂浮状态达24 h 以上。
2.5 胃漂浮缓释片处方考察
2.5.1 溶胀材料的考察
采用聚氧乙烯(Polyox WSR)和羟丙甲基纤维素(HPMC)作为缓释溶胀材料进行处方筛选。采用粉末直压制备胃漂浮缓释片,考察缓释效果,筛选结果见表5、图4。
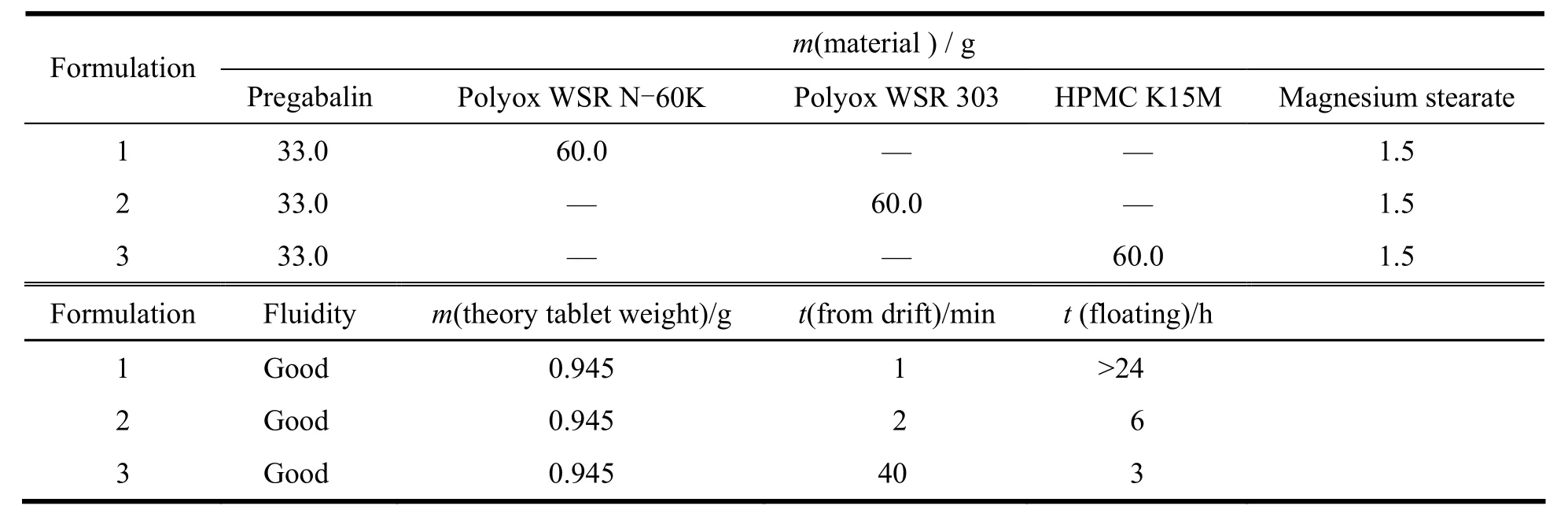
Table 5 Pregabalin gastric floating sustained-release tablets formulation screening表5 普瑞巴林胃漂浮缓释片的筛选处方
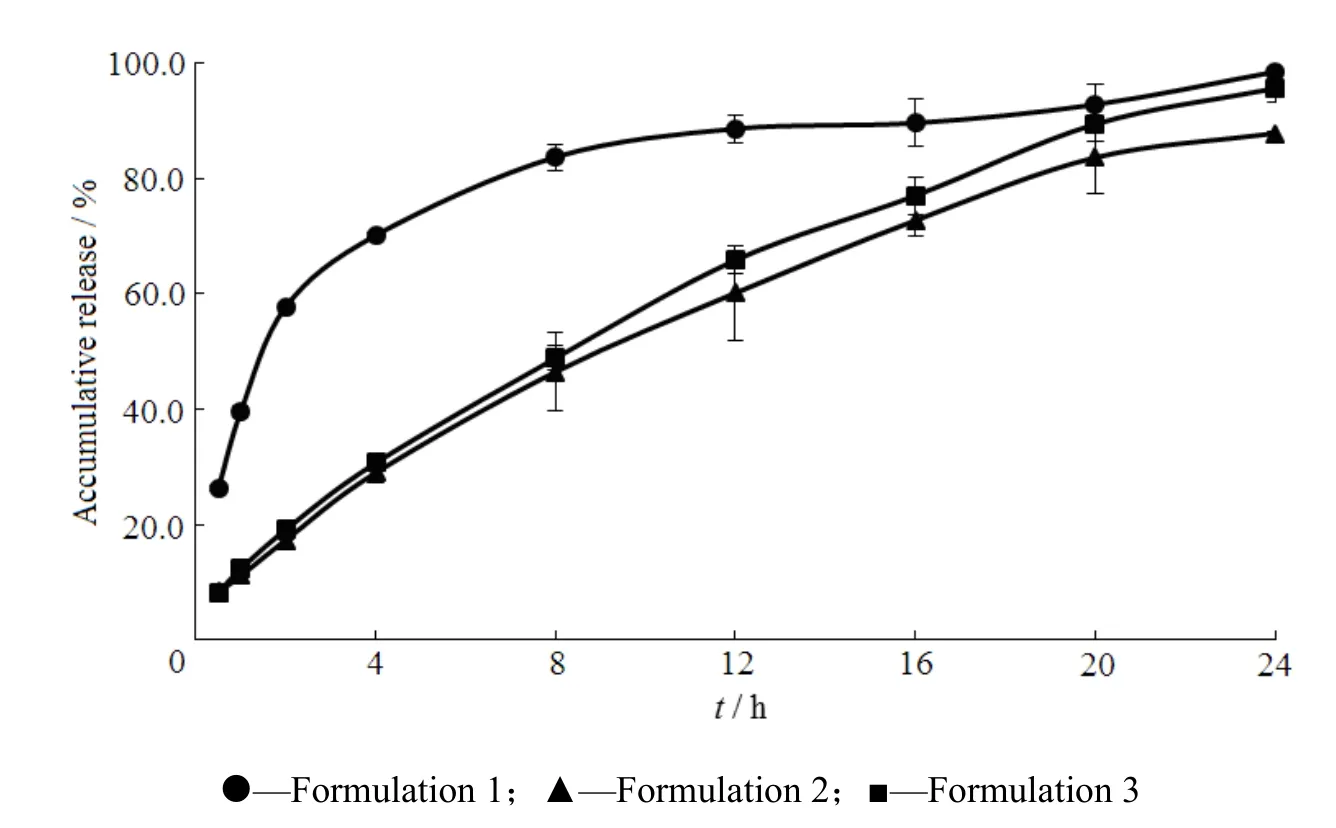
Fig. 4 Release profiles of pregabalin gastric floating sustained-release tablets图4 普瑞巴林胃漂浮缓释片的释放曲线
从图4可以看出:采用Polyox WSR N-60K作为缓释溶胀材料漂浮时间长,但是释放较快;采用Polyox WSR 303作为缓释溶胀材料可以有效的减慢药物的释放,基本可以达到24 h缓释,但是漂浮时间短;采用HPMC K15M作为缓释溶胀材料同样可以有效的减慢药物的释放,基本可以达到24 h缓释,但是漂浮时间较短。聚氧乙烯不但密度低,容易漂浮,因此初步选择Polyox WSR 303、Polyox WSR N-60K作为溶胀材料继续进行处方筛选。
2.5.2 PEO303与PEO N-60K用量的考察
单独使用Polyox WSR 303,虽释放较为理想,但是漂浮性能不好;单独使用Polyox WSR N-60K,虽漂浮性能非常好,但是释放较快。因此采用了这2种溶胀材料混合使用进行处方筛选,采用粉末直压制备胃漂浮缓释片,考察漂浮缓释效果,筛选结果见表6、图5。
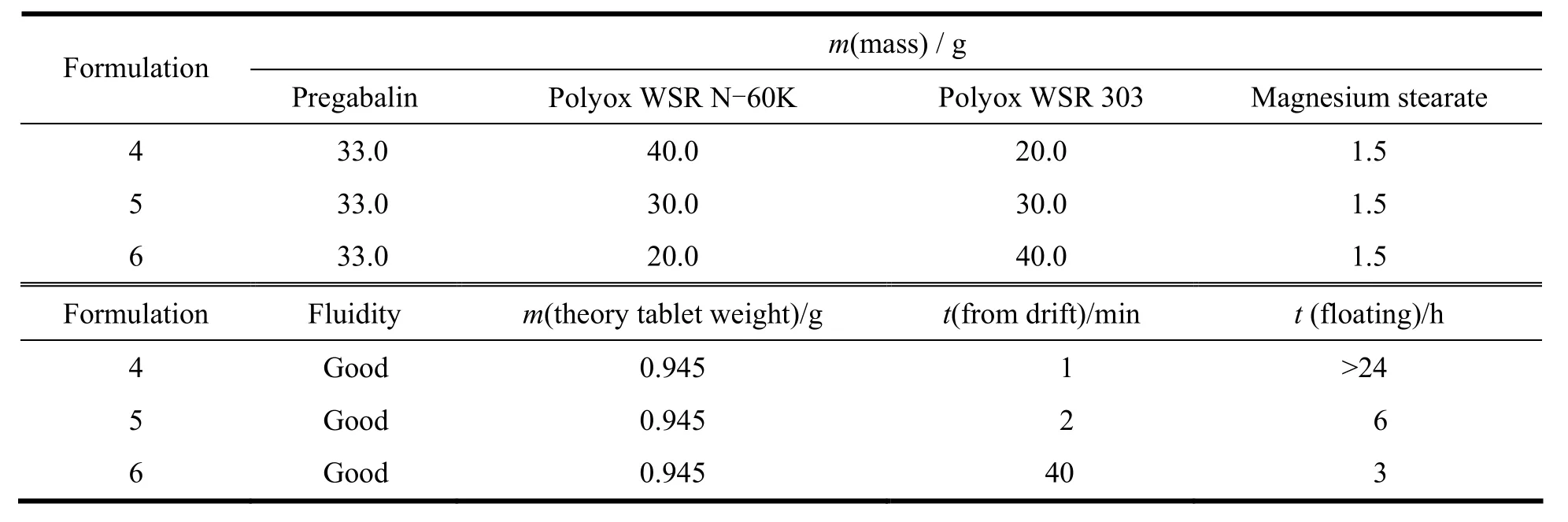
Table 6 Pregabalin gastric floating sustained-release tablets formulation screening表6 普瑞巴林胃漂浮缓释片筛选处方
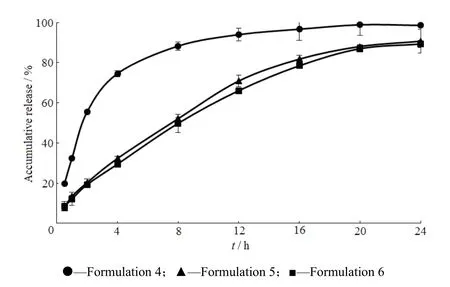
Fig. 5 Release profiles of pregabalin gastric floating sustained-release tablets图5 普瑞巴林胃漂浮缓释片释放曲线
从图5可以看出,采用m(Polyox WSR 303)∶m(Polyox WSR N-60K)=1∶2作为缓释溶胀材料漂浮时间长,但是释放较快;采用m(Polyox WSR 303)∶m (Polyox WSR N-60K)=2∶1作为缓释溶胀材料可以有效的减慢药物的释放,但是漂浮时间短;采用 m(Polyox WSR 303)∶m(Polyox WSR N-60K)=1∶1作为缓释溶胀材料可以有效的减慢药物的释放,基本可以达到24 h缓释,并且漂浮时间长,因此初步选择m(Polyox WSR 303)∶m(Polyox WSR N-60K)=1∶1作为溶胀材料继续进行处方筛选。
2.5.3 骨架材料的考察
单独使用Polyox WSR,溶出后整体片子偏软,骨架成型不好。因此采用了常用的亲水性骨架材料羟丙甲基纤维素和海藻酸钠作为骨架材料进行处方筛选。采用粉末直压制备胃漂浮缓释片,考察漂浮缓释效果,筛选结果见表7、图6。
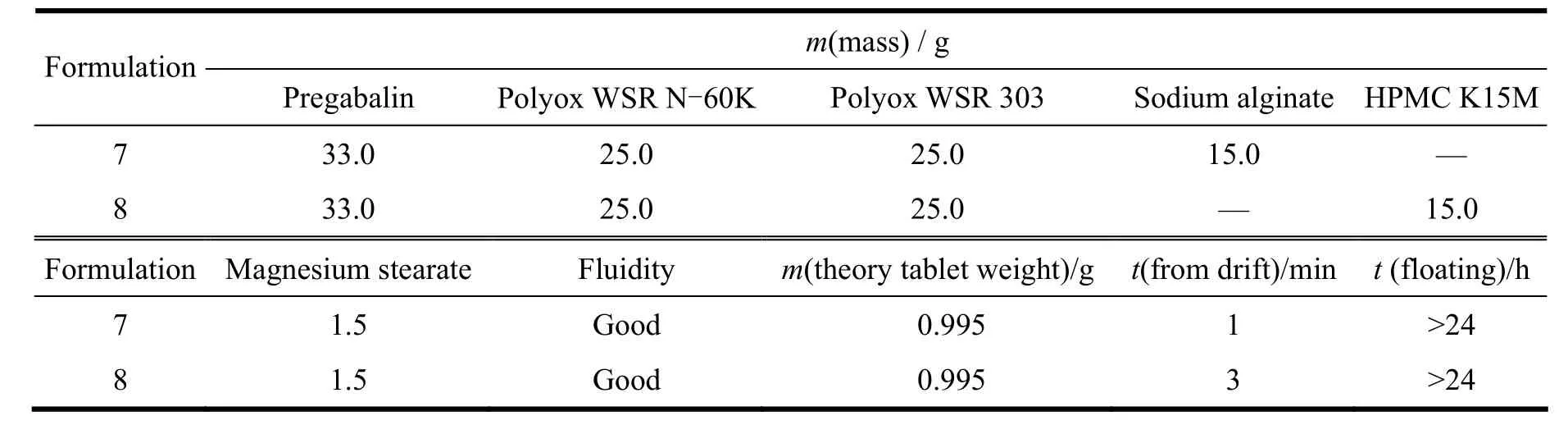
Table 7 Pregabalin gastric floating sustained-release tablets formulation screening表7 普瑞巴林胃漂浮缓释片筛选处方
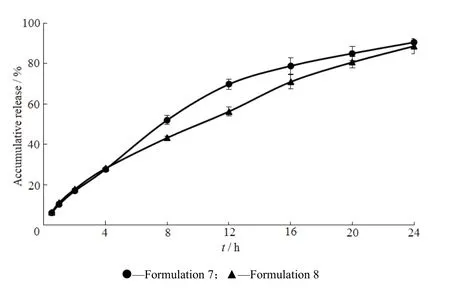
Fig. 6 Release profiles of pregabalin gastric floating sustained-release tablets图6 普瑞巴林胃漂浮缓释片释放曲线
从图6可以看出,采用海藻酸钠和HPMC K15M作为缓释骨架材料可以有效的减慢药物的释放,基本可以达到24 h缓释,并且片子均能形成足够强度硬度的骨架。而羟丙甲纤维素8 h后释放较慢,同等情况下其膨胀程度偏小,且片子偏硬,在胃部很容易被挤压而被排出,从而影响药物的体内吸收。因此初步选择海藻酸钠作为骨架材料继续进行处方筛选。
2.5.4 崩解剂用量的考察
由于片子整体释放过程较慢,故采用交联聚维酮(Polyplasdone XL)作为崩解材料,并对其用量进行处方筛选。采用粉末直压制备胃漂浮缓释片,考察漂浮缓释效果,筛选结果见表8、图7。

Table 8 Pregabalin gastric floating sustained-release tablets formulation screening表8 普瑞巴林胃漂浮缓释片筛选处方
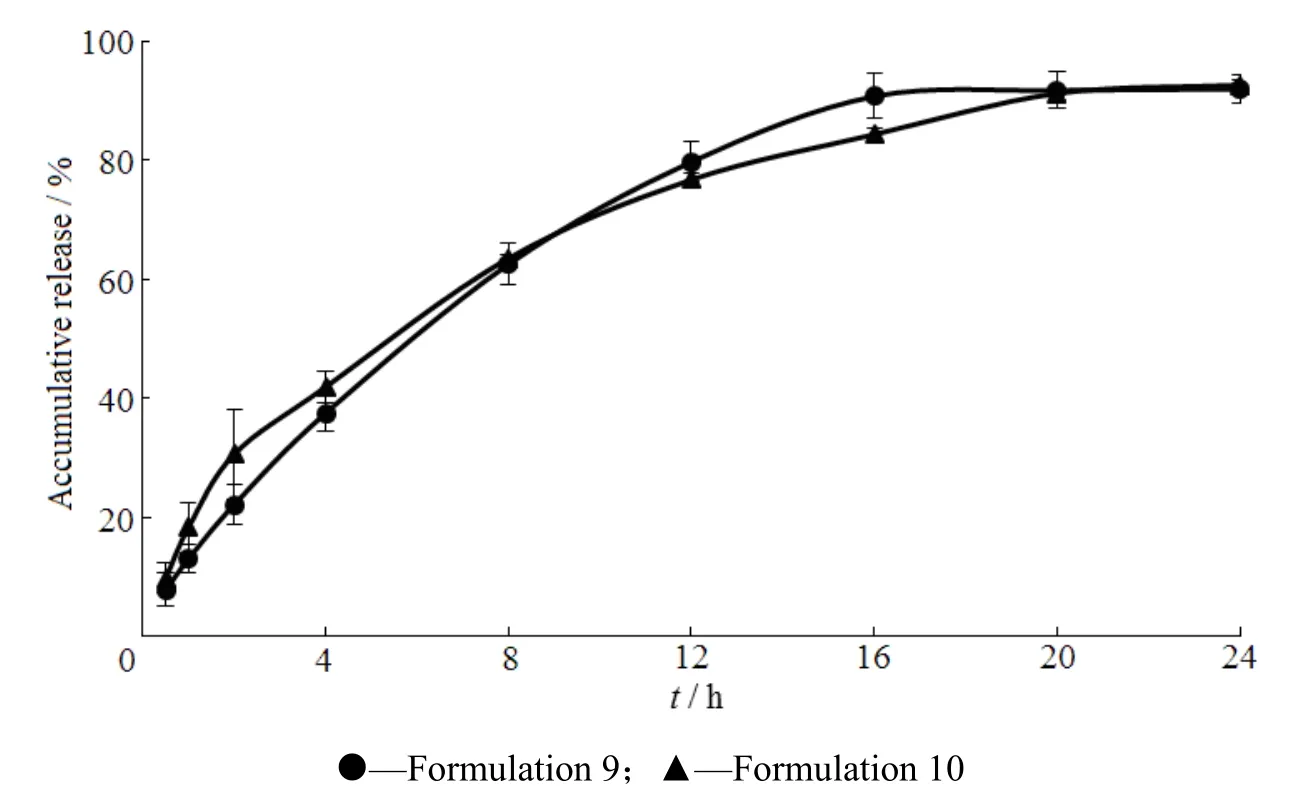
Fig. 7 Release profiles of pregabalin gastric floating sustained-release tablets图7 普瑞巴林胃漂浮缓释片释放曲线
由图7可以看出,随着交联聚维酮在片剂中用量的增加,药物8 h之前的释放速度变快,因此选择交联聚维酮的用量为总质量的 5%(处方 9)。使用海藻酸钠和聚氧乙烯组合,可以获得较好的缓释效果,并且采用m(Polyox WSR 303)∶m(Polyox WSR N-60K)=1∶1,制剂1 min起漂,漂浮时间大于24 h,吸水体积膨胀较大,整个过程释放的最为平稳,并能够很好的在24 h内释放完全,且片子吸水体积膨胀大,片形维持有一定刚性。
2.5.5 优化处方的确定
按照处方9制备普瑞巴林胃漂浮缓释片1 000片。体外漂浮性能测定表明约1 min后片剂表面形成层凝胶屏障,并保持片剂形状,漂浮于液面。随漂浮时间延长,片剂体积膨胀,但仍保持片形完整,持漂时间均大于24 h。3批样品释放度良好,24 h 累积释放量85% 以上,结果见图8。
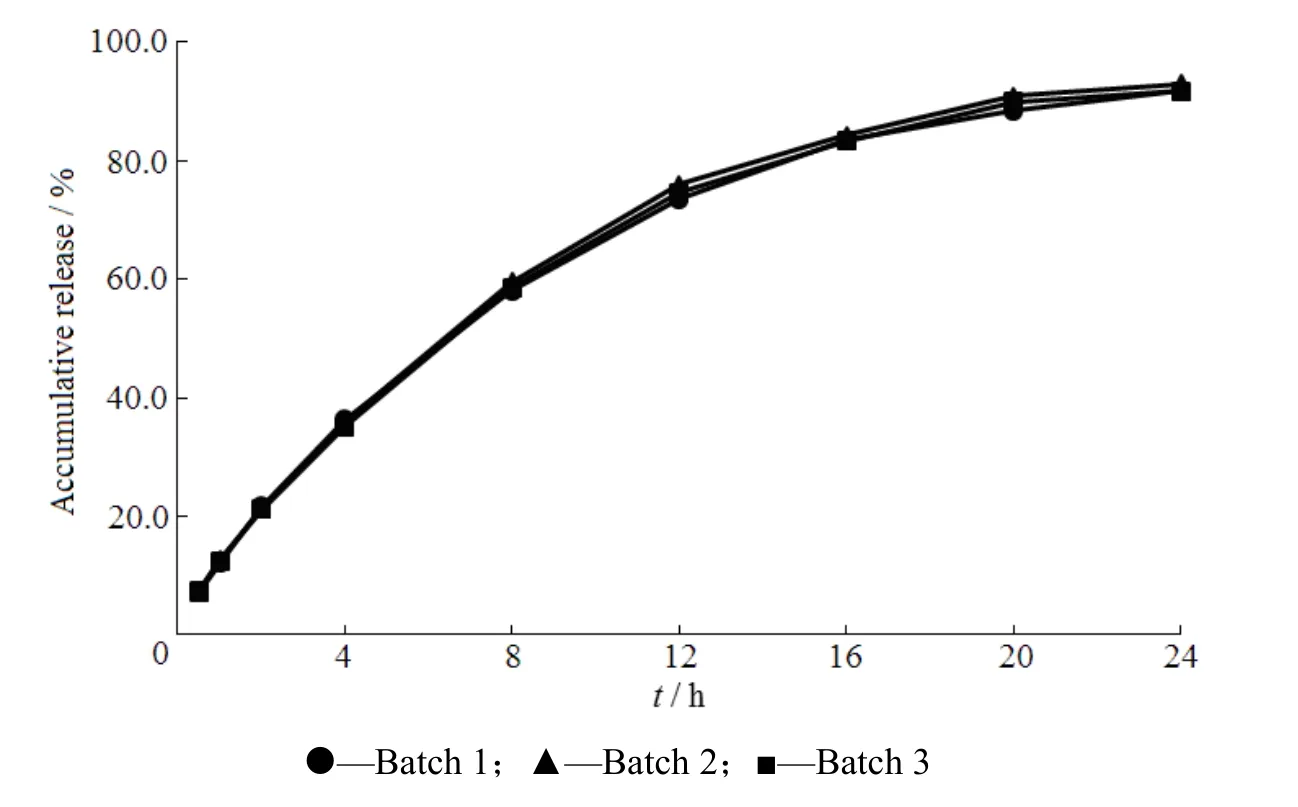
Fig. 8 Release profiles of pregabalin gastric floating sustained-release tablets in reproducibility test图8 释放度重现性试验释放曲线
3 讨论
a. 普瑞巴林是末端吸收,在210 nm有最大吸收,但是聚氧乙烯在210 nm处有吸收,用紫外可见分光光度法会干扰普瑞巴林胃漂浮缓释片释放度的测定。作者参考文献,开发出一种简单、快速、新颖的紫外可见分光光度法测定其释放度,该方法是基于普瑞巴林与桑格试剂2,4-二硝基氟苯在催化剂为十六烷基三甲基溴化铵的存在下反应,生成复合物,该复合物在365 nm有最大吸收,可以用紫外可见分光光度法测定其含量[3]。反应如下:

b. 由于聚氧乙烯303和聚氧乙烯N-60K遇水发黏,因此不宜采用湿法制粒,可以考虑采用直接压片或干法制粒。干法制粒收率低,并且需要特殊的设备,需要的设备性能高,在以后的大生产中所需成本较高,生产效率低,耗时。而普瑞巴林原料药单独直接压片可压性较好,因此最终选择粉末直接压片法。
[1] 李建川, 王微微, 吴逊.一种新型抗癫痫药物普瑞巴林[J]. 中国临床药理学杂志, 2009, 25(2): 145-148.
[2] BOCKBRADER H N, WESCHE D. A comparison of the pharmacokinetics and pharmacodynamics of pregabalin and gabapentin[J]. Clin Pharmacokinet, 2010, 49 (10): 661-669.
[3] VARIK S, WALKE T. Spectrophotometric determination of pregabalin from the capsule dosage form based on its micellar catalyzed reaction with Sanger’s reagent[J]. International Journal of Research in Pharmaceutical and Biomedical Sciences, 2013, 4 (4): 1051-1054.
Preparation and in vitro release of pregabalin gastric floating sustained-release tablets
HUANG Xu,WANG Dong-kai*
(School of Pharmacy,Shenyang Pharmaceutical University,Shenyang 110016,China)
ObjectiveTo prepare the pregabalin gastric floating sustained-release tablets and investigate the drug release by UV.MethodsPregabalin was used as a model drug with Polyox WSR 303, Polyox WSR N-60K, HPMC K15M and sodium alginate as matrix materials. The content of pregabalin was determined by ultraviolet spectrophotometry at 365 nm and accumulative release amount was calculated.ResultsThe tablets showed a good sustained-release and continuous floating property with Polyox WSR 303 250 mg/tablet, Polyox WSR N-60K 250 mg/tablet, sodium alginate150 mg/tablet.ConclusionsFloating state of pregabalin gastric floating sustained-release tablets was maintained during the wholerelease process, and sustained-release properties was achieved.
Pharmaceutics; gastric floating sustained-release tablets; UV-visible spectrophotometry; pregabalin; release
R94
:A
(本篇责任编辑:赵桂芝)
(2015)06-0205-13
10.14146/j.cnki.cjp.2015.06.003
2015-03-30
黄旭(1987-), 男(汉族), 辽宁沈阳人, 硕士研究生, E-mail hxlikeyou@126.com; *
:王东凯(1962-), 男(汉族), 辽宁沈阳人, 教授, 博士, 博士生导师, 主要从事缓控释制剂及新剂型的研究, Tel. 024-23986310, E-mail wangdksy@126.com。
