反溶剂结合湿法研磨技术制备阿立哌唑混悬注射剂
2015-03-08何璐瑛王艳娇
钟 月,何璐瑛,王艳娇,唐 星
(沈阳药科大学 药学院,辽宁 沈阳 110016)
反溶剂结合湿法研磨技术制备阿立哌唑混悬注射剂
钟 月,何璐瑛,王艳娇*,唐 星
(沈阳药科大学 药学院,辽宁 沈阳 110016)
目的采用反溶剂结合湿法研磨技术制备稳定的阿立哌唑混悬注射剂。方法将阿立哌唑原料药采用反溶剂法进行前处理后得到棒状的阿立哌唑晶体,将精制后的阿立哌唑进行湿法研磨,用激光粒度测定仪测定混悬液中颗粒大小随研磨时间的变化,筛选颗粒d50在 1.9~2.2 μm内需要的研磨时间;筛选不同的冻干保护剂,以冻干前后的粒径大小和分布为指标,得到最优的冻干保护剂。结果阿立哌唑混悬液在进行湿法研磨15 min后得到粒径d50为2.109 μm,分布跨度为1.942的混悬液。甘露醇作为最优的冻干保护剂,冻干复溶后混悬液中颗粒大小和分布与冻干前基本一致。结论采用反溶剂结合湿法研磨制备阿立哌唑混悬注射剂,以甘露醇为冻干保护剂,可以得到复溶状态良好且稳定性高的阿立哌唑混悬液。
药剂学;混悬注射剂;湿法研磨;反溶剂法;阿立哌唑;冻干保护剂
阿立哌唑(aripiprazole,APZ)是二氢喹啉酮类抗精神病药,是继第一、二代抗精神病药之后,对精神障碍治疗的药理作用和机制具有革新性的新一代抗精神病药。一般情况下,治疗精神分裂的药物均需要持续治疗保持稳定的血药浓度,以维持精神病人良好的精神状态。对于此类需长期使用的药物,适宜于制成注射型缓控释制剂以进行维持治疗。
注射型缓控释制剂具有以下优点[1]:1) 可保持药物的药理活性,避免其在胃肠道中被破坏,提高药物的生物利用度;2) 对于需要长期给药的药物,注射用缓控释制剂能够减少给药次数,提高患者用药依从性;3) 保持平稳的血药浓度,减少药物的不良反应;4) 部分缓控释注射剂可直接注入治疗部位治疗,从而降低其全身毒性。因此,注射型缓控释制剂的研究是近些年来药剂学研究领域的热点之一[2]。
湿法研磨技术是制备纳米晶体最常用的方法之一[3],通过电机的高速运转带动研磨腔体中研磨介质的强烈转动,借助研磨介质与药物颗粒之间的碰撞以及药物颗粒与颗粒之间的碰撞,使药物的大颗粒被破碎成微米或纳米颗粒[4]。研磨介质的种类有很多[5],包括氧化锆研磨珠、玻璃研磨珠和交联聚苯乙烯研磨珠等。其中,氧化锆珠是最常使用研磨介质之一。
阿立哌唑由于分子之间不同的排列组合,具有多种晶型,除了阿立哌唑无定型态以外,还存在着阿立哌唑一水合物、阿立哌唑无水物和阿立哌唑溶剂化物等三大种类晶型[6]。
作者采用反溶剂法结合湿法研磨技术制备阿立哌唑混悬注射液,制备得到粒径分布均匀、单一无水晶型[6](熔点为139 ℃)且稳定性好的阿立哌唑混悬液。通过不同种类冻干保护剂筛选,制备得到复溶前后粒径分布基本一致的稳定冻干制剂。
1 仪器与材料
MiniZeta湿法研磨机 (德国NETZSCH公司),FA-1104 电子天平(上海民桥精密科学仪器有限公司),DSC1差示扫描量热分析仪(瑞士Mettler-Toledo公司),热重分析仪TGA-50(日本岛津公司),ZRS-8G 药物溶出度仪(天大天发科技有限公司),HITACHI L-2000 高效液相色谱仪(日本日立公司),程序升温冻干机(美国SP工业),激光粒度测定仪(丹东百特仪器有限公司),电热恒温水浴锅(北京市长风仪器仪表公司),高速剪切机(德国IKA公司)。
阿立哌唑原料药(南京正大天晴制药有限公司),羧甲基纤维素钠(日本第一工业制药),磷酸二氢钠(西陇化工股份有限公司),甘露醇(罗盖特(中国)精细化工有限公司),其他试剂(色谱纯或分析纯,市售)。
2 方法
2.1 阿立哌唑原料药的前处理
称取阿立哌唑原料药约10 g置于500 mL的圆底烧瓶中,向其中加入体积分数为0.9%的乙醇200 mL,充分搅拌并开始加热回流,保持回流状态2 h。回流结束后将阿立哌唑的乙醇溶液迅速倒入正在以1×104r·min-1剪切的200 mL冰浴纯化水中,待阿立哌唑晶体充分析出后,抽滤,40~50 ℃真空干燥至物料质量恒定,得到棒状的重结晶阿立哌唑。
2.2 阿立哌唑长效注射混悬液研磨时间的考察
分别精密称取助悬剂羧甲基纤维素钠、缓冲盐磷酸二氢钠以及冻干保护剂并将其分散于纯化水中,搅拌使3种辅料溶解得辅料溶液。将精制后的阿立哌唑原料药20 g分散到150 mL上述辅料溶液中,待搅拌均匀后,继续加入上述辅料溶液,使总体积为200 mL,即得粗混悬液。将氧化锆研磨珠200 mL和上述粗混悬液加入到研磨机的研磨腔中,以3 000 r·min-1进行高速循环研磨,每隔1 min取样5 mL置于EP管中留样测定。阿立哌唑混悬注射液中原辅料的质量浓度为:阿立哌唑精制原料药0.1 kg·L-1、羧甲基纤维素钠0.9 kg·L-1、磷酸二氢钠80 g·L-1和冻干保护剂5 kg·L-1,适量0.1 mol·L-1氢氧化钠溶液将混悬液的pH值调节到7.0。
2.3 阿立哌唑长效注射剂冻干保护剂的筛选
分别精密称取助悬剂羧甲基纤维素钠、缓冲盐磷酸二氢钠以及不同种类冻干保护剂(甘露醇、乳糖、蔗糖、海藻糖)并将其分散于纯化水中,搅拌将上述3种辅料溶解后,将精制后的阿立哌唑原料药20 g分散到150 mL上述溶液中,待搅拌均匀后,继续加入上述溶液,使总体积为200 mL。将氧化锆研磨珠200 mL和上述粗混悬液加入到研磨机的研磨腔中,以3 000 r·min-1进行高速循环研磨。将研磨得到的混悬液用0.1 mol·L-1的氢氧化钠溶液调节pH值到7.0。将制备得到的混悬注射液2 mL灌装于半塞住的镀膜西林瓶中,放置于程序升温冻干机中冻干(冻干曲线如图1所示),即得。

Fig. 1 Lyophilizing curve of the APZ suspension图 1 阿立哌唑混悬液的冻干曲线
2.4 阿立哌唑混悬液粒径分布的测定
取不同处方的阿立哌唑混悬注射液适量,逐滴加入到搅拌下的样品池中,待遮光度到达9.0%~11.0%时,开始连续测定样品,测定体系的d10、d50、d90(即样品的累计粒度分布百分数达到10%、50%和90%时所对应的粒径)和粒径分布跨度(span),连续测定3次,求平均值。
2.5 阿立哌唑冻干样品的表征
2.5.1 差示扫描量热 (DSC)法
采用DSC1 差示扫描量热(differential scanning calorimetry, DSC)分析仪进行测定。取阿立哌唑原料药粗品、阿立哌唑精制后原料药和最优阿立哌唑的冻干保护剂处方粉末适量,精密称定后,放入到氧化铝盘中,以氧化铝空白锅为参比物,置于50 mL·min-1的N2流中,以10 ℃·min-1的速率扫描升温,从25 ℃升温至200 ℃。
2.5.2 显微镜法
采用显微镜法观察阿立哌唑原料药、阿立哌唑精制后原料药、冻干前后阿立哌唑混悬液中的颗粒形态,将1 滴研磨液滴到载玻片上,滴加适量的水稀释后,用盖玻片覆盖到液体表面,吸去多余的液体,在10×40倍显微镜下观察药物颗粒的大小和形态。
3 结果与讨论
3.1 阿立哌唑原料药和制剂晶型的对比
阿立哌唑粗品、阿立哌唑精制品以及冻干制剂的DSC测定结果见图2。由图2可知:阿立哌唑原料药粗品的DSC曲线图上存在着2 个熔融峰,峰值分别为139 ℃和149 ℃,表示着原料药中存在着2 种不同的晶型;阿立哌唑混悬剂冻干粉末的DSC曲线上,药物在139 ℃附近有一明显的吸热峰,即为药物的熔点,在165 ℃左右有一个明显的熔融峰,与甘露醇的熔点相对应。
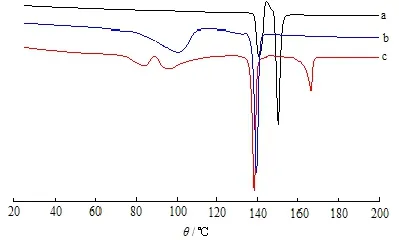
Fig. 2 DSC thermograms of crude APZ (a), recrystallized APZ (b) and lyophilized APZ suspensions (c)图 2 阿立哌唑原料药(a)、重结晶阿立哌唑(b)和冻干后制剂(c)的DSC分析结果
3.2 阿立哌唑粒径分布随研磨时间的变化
由图3可知,阿立哌唑粒径大小和分布跨度随着研磨时间的增长而不断减小。在前3 min,阿立哌唑晶体的粒径d50从70.54 μm降低到4.154 μm,说明在研磨的初期,由于阿立哌唑粗混悬液中的颗粒与研磨珠之间的高速碰撞以及颗粒自身的激烈碰撞,使得药物的颗粒迅速破碎成微米或纳米级别的粒子,并随着研磨时间的增加,药物的粒径分布跨度缓慢减小,阿立哌唑混悬液中的颗粒随着研磨时间的增加不断趋于均匀。研磨时间为 15 min时,药物的粒子d50为 2.109 μm,粒径分布跨度为1.942。
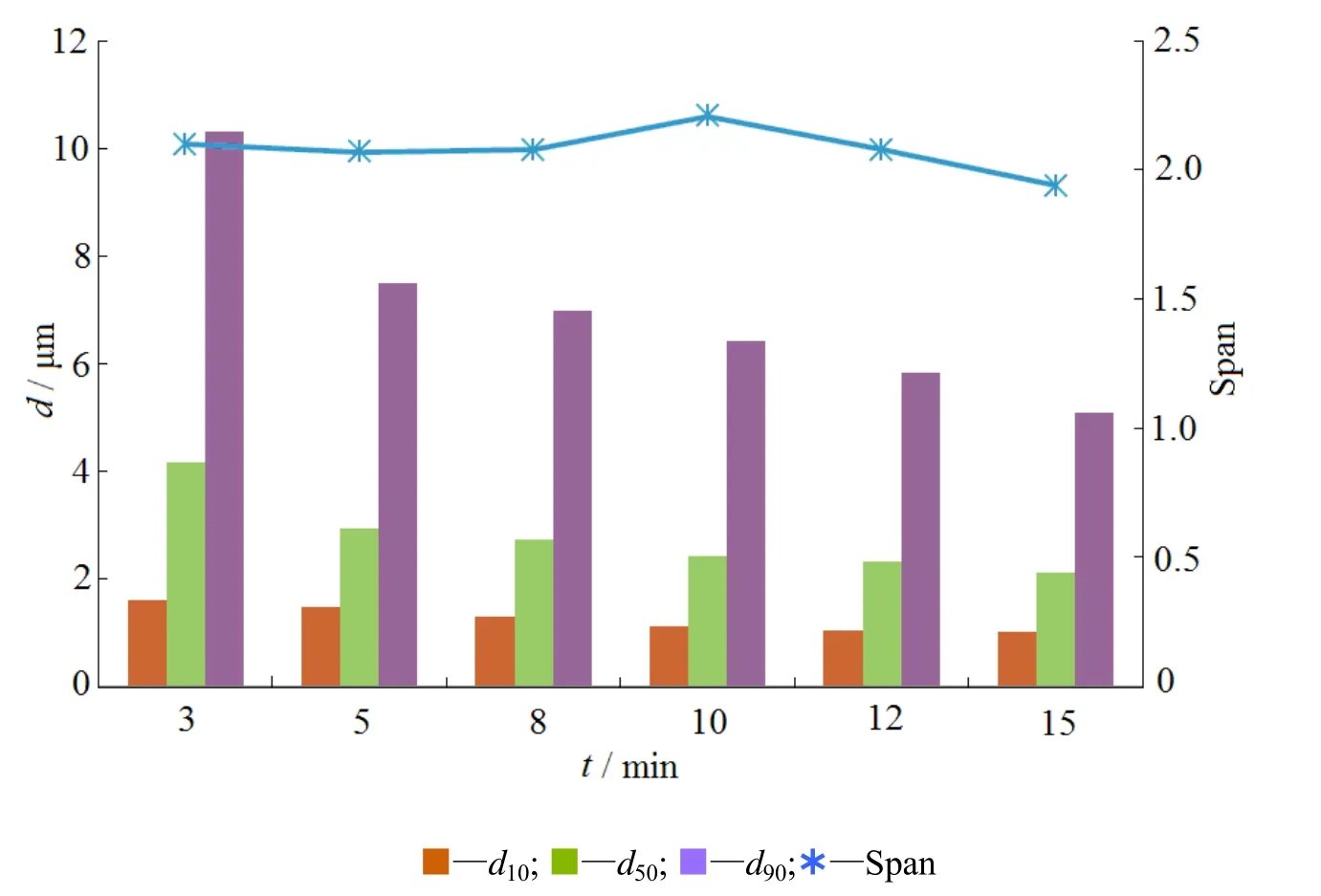
Fig. 3 Particle sizes (d50) and span of APZ suspension during processing at different milling time图 3 阿立哌唑混悬液粒径大小和分布随研磨时间的变化图
3.3 阿立哌唑混悬液冻干保护剂的评价
阿立哌唑混悬液在不同冻干保护剂的保护下冻干复溶后粒径大小和分布如表1所示。其中:以甘露醇作为冻干保护剂时,阿立哌唑混悬液冻干前后的粒径大小和分布基本保持不变,冻干粉饼状态完整,无萎缩和塌陷现象发生,冻干保护作用最好;以乳糖作为冻干保护剂时,冻干复溶后的粒径和跨度产生微小的变化,粒径分布跨度从1.942增加到2.155;以海藻糖和蔗糖作为冻干保护剂时,阿立哌唑混悬液复溶前后的粒径有明显差别,粒径分布显著增大,采用海藻糖、乳糖和海藻糖这三种冻干保护剂不能有效的保护阿立哌唑混悬液中的粒子的分布状态;在葡萄糖作为冻干保护剂的处方当中,冻干后样品出现了严重的塌陷和萎缩现象,并且复溶后的d50和d90明显增大,粒径分布跨度达到6.046 μm,葡萄糖不能有效的保护混悬液中的粒子的大小和形态,不适合作为阿立哌唑混悬剂的冻干保护剂。五种冻干保护剂对阿立哌唑混悬颗粒的保护能力从强到弱依次是甘露醇、乳糖、海藻糖、蔗糖和葡萄糖。因此,本研究应该选用甘露醇作为阿立哌唑混悬液的冻干保护剂。
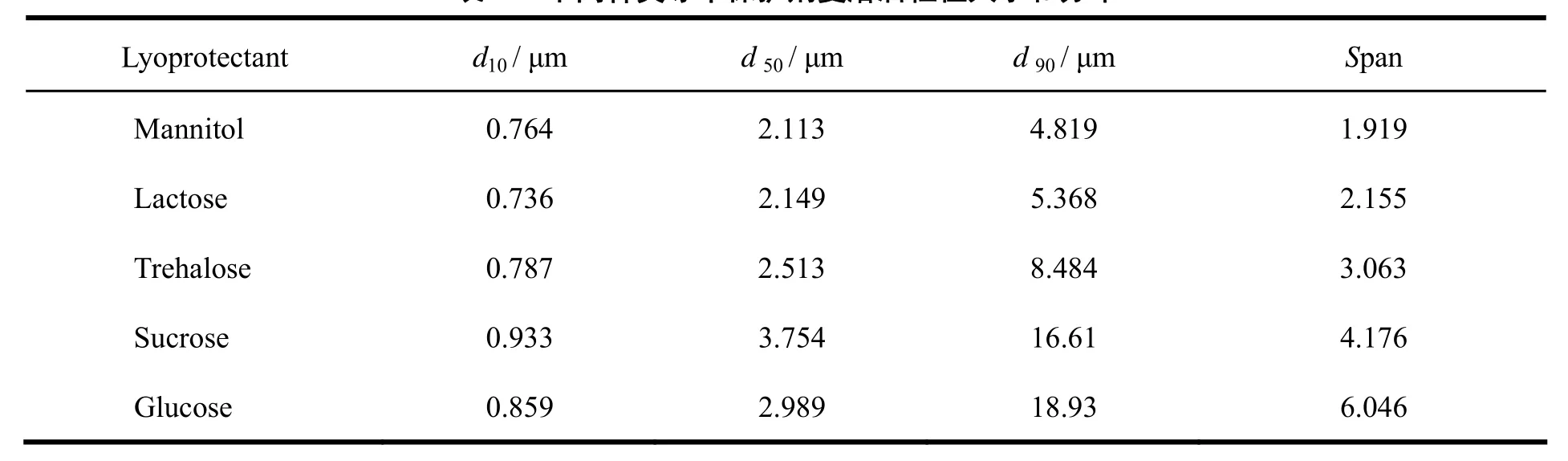
Table 1 Effects of cryoprotectants on the size and distribution of APZ suspensions after reconstruction表 1 不同种类冻干保护剂复溶后粒径大小和分布
3.4 阿立哌唑混悬液粒径显微图像分析
由图4可知:阿立哌唑原料药粗品是表面不规则的大颗粒;重结晶后的阿立哌唑原料药呈现出明显的棒状形态,棒状的形态使其更容易被破碎成小颗粒而形成微米混悬液;以氧化锆研磨珠作为研磨介质,经过湿法研磨得到的粒子呈现颗粒状形态,并且在冻干保护剂甘露醇的保护下,在冻干前后阿立哌唑混悬液中的粒子大小和形态基本保持一致。

Fig. 4 Optical micrographs of crude APZ (A), purified APZ (B) and APZ suspensions before (C) and after (D) lyophilization (×400 )图4 原料阿立哌唑(A)、精制后阿立哌唑(B)与阿立哌唑冻干前(C)和冻干制剂复溶(D)显微镜观察结果(×400)
4 结论
作者采用了反溶剂法结合湿法研磨制备阿立哌唑混悬注射液。反溶剂法的作用是制备得到单一晶型(熔点约为139 ℃)并且形态为更易破碎的棒状晶体的阿立哌唑,通过考察研磨时间对粒径大小和分布的影响确定最佳的研磨时间。在本研究中,参考已上市的阿立哌唑混悬注射剂的的粒径,将目标粒径d50定为1.9 μm至2.2 μm。当研磨时间为15 min时,得到的混悬液粒径d50的大小为2.109 μm,粒径分布跨度为1.942。同时筛选了不同冻干保护剂对阿立哌唑混悬液的冻干保护作用,筛选出冻干保护效果最好的甘露醇作为冻干保护剂。混悬液中粒子的大小和形态在冻干前后均能够保持一致。阿立哌唑混悬注射剂以冻干粉饼的状态出现与混悬液的状态相比,稳定性更高,储存运输方便。
[1] 袁慧玲, 易加明, 张彩云, 等. 纳米混悬剂的制备方法及给药途径研究进展[J]. 中国新药杂志, 2014, 23(3): 297-301.
[2] 徐清, 黄琴琴, 王永禄, 等. 纳米混悬剂物理稳定性的研究进展[J]. 中国医药工业杂志, 2012, 43(2): 148-152.
[3] VAN EERDENBRUGH B, VAN DEN MOOTER G, AUGUSTIJNS P. Top-down production of drug nanocrystals: nanosuspension stabilization, miniaturization and transformation into solid products[J]. Int J Pharm, 2008, 364: 64-75.
[4] ZHANG Ke-ru, YU Hong-xia, LUO Qing, et al. Increased dissolution and oral absorption of itraconazole/Soluplus extrudate compared with itraconazole nanosuspension [J]. Eur J Pharm Biopharm, 2013, 85: 1285-1292.
[5] HU Xi, CHEN Xi, ZHANG Ling, et al. A combined bottom-up/top-down approach to prepare a sterile injectable nanosuspension[J]. Int J Pharm, 2014, 472: 130-139.
[6] BRAUN D E, GELBRICH T, KAHLENBERG V, et al. Conformational polymorphism in aripiprazole: Preparation, stability and structure of five modifications [J]. J Pharm Sci, 2009, 98: 2010-2026.
A combined anti-solvent/wet ball milling approach to prepare aripiprazole injectable suspension
ZHONG Yue, HE Lu-ying, WANG Yan-jiao*, TANG Xing
(School of Pharmacy, Shenyang Pharmaceutical University, Shenyang 110016, China)
ObjectiveTo prepare stable aripiprazole (APZ) suspensions by a combined anti-solvent/wet ball milling method.MethodsThe recrystallized particles prepared by anti-solvent method were milled to obtain particles which d50ranged from 1.9 μm to 2.2 μm and the particle size was measured by laser diffraction. Different cryoprotectants were evaluated with regard to the particle size distribution after reconstruction of the lyophilized powder with the fresh formulations as reference.ResultsA particle size distribution (span) 1.942 with d50of 2.109 μm was obtained after wet-ball milling for 15 min. Similar particle size was obtained when mannitol was used as a cryoprotectant compared with the freshly prepared suspension.ConclusionsA combined anti-solvent/wet ball milling approach can be used to prepare stable aripiprazole injectable suspension when mannitol was used as cryoprotectant.
pharmaceutics; suspensions; wet ball milling; anti-solvent; aripiprazole; cryoprotectant
R94
:A
(本篇责任编辑:赵桂芝)
(2015)06-0189-07
10.14146/j.cnki.cjp.2015.06.001
2015-03-31
钟月(1990-), 女(汉族), 辽宁鞍山人, 硕士研究生, E-mail zhongyue19900521@163.com; *
王艳娇(1968- ), 女(汉族), 辽宁沈阳人, 副教授, 硕士生导师, 主要从事药剂学研究, Tel. 024-23986343, E-mail Wang53k2002@163.com。
