不同强度耐力运动对大鼠心肌胶原蛋白的影响及MMP-1/TIMP-1的调节作用
2015-03-07王世强马晓雯
王世强,常 芸,马晓雯,王 菲
不同强度耐力运动对大鼠心肌胶原蛋白的影响及MMP-1/TIMP-1的调节作用
王世强1,2,常 芸2,马晓雯2,王 菲2
目的:探讨不同强度耐力运动对大鼠心肌不同部位胶原蛋白的影响,并研究MMP-1/TIMP-1的表达变化,为运动性心律失常的发生机制提供实验依据。方法:72只健康成年雄性SD大鼠随机分为安静对照组、中等强度运动组和大强度运动组,每组24只。分别进行8周、12周和16周运动,每周训练5天,休息2天,每次1 h。运动8周、12周和16周后,24 h内处死取材摘取心脏,分离出右心房、右心室和左心室。天狼星红染色观察心肌间质中胶原蛋白的变化并计算胶原容积分数(CVF)。免疫荧光检测Ⅰ型胶原蛋白的含量。Western Blot检测MMP-1和TIMP-1的蛋白表达,并计算MMP-1/TIMP-1的比值。结果:大强度耐力运动提高了右心房和右心室CVF和Ⅰ型胶原蛋白的表达(P<0.01),且运动时间越长,增加幅度越大,对左心室CVF和Ⅰ型胶原蛋白的表达影响不明显。中等强度运动虽促进了心肌CVF和Ⅰ型胶原蛋白的表达,但无统计学意义。蛋白检测发现,16周的大强度运动对右心室MMP-1表达的影响不明显,却显著提高了右心室TIMP-1的表达(P<0.01),使得MMP-1/TIMP-1(P<0.05)的比值显著降低。中等强度运动对MMP-1和TIMP-1表达的影响不明显。结论:长期大强度耐力运动导致大鼠右心房和右心室胶原容积分数和Ⅰ型胶原蛋白显著增加。12周大强度耐力运动后大鼠右心房发生纤维化,且随运动时间增加,心房纤维化程度增大,右心室的纤维化出现在第16周。心肌纤维化的发生可能与长期大强度耐力运动造成TIMP-1的表达增加、进而引起MMP-1/TIMP-1的比例失调有关。
运动;心肌纤维化;胶原蛋白;基质金属蛋白酶;心脏;鼠;动物实验
运动性心律失常是运动医学和体育科学备受关注的问题。常芸针对我国优秀运动员潜在的心脏隐患的调研也证实,长期从事大强度运动的优秀运动员存在较高的心律失常风险[1]。另外,研究者前期针对运动性心律失常的病理发生机制进行了大量的实验性研究。结果发现,长期大强度运动训练可导致心脏损伤或心律失常,其发生机制与长期大强度运动导致心肌组织能量代谢障碍、心肌炎症反应、离子通道异常和细胞骨架蛋白受损等因素有关,但其病因、病理及发病机制尚不清楚[2]。
近年,人体实验研究表明,长期大强度运动导致胶原蛋白过度增加,一定比例的耐力运动员存在心肌纤维化现象,这可能是引起运动性心肌损伤和心律失常的重要病理改变[21,36]。Chang等的研究结果也证实,4周反复力竭运动能引起大鼠心脏传导系统纤维化的发生[14]。2015年的一篇报道进一步证实,长期大强度运动能诱导小鼠心房纤维化发生,增加小鼠心房纤颤的敏感性[9]。
临床病理研究认为,心肌纤维化是心脏长期受到异常刺激后出现的一种组织学病理变化,结构改变常表现为心肌组织中的成纤维细胞增殖和以胶原蛋白为主的细胞外基质增多,细胞外基质的合成和降解失调,Ⅰ型(Collagen I ,Col-I)、Ⅲ型(CollagenⅢ ,Col-Ⅲ)胶原比例增加,各型胶原比例的失调。心肌纤维化功能性改变表现为心肌僵硬度增加、顺应性减少、收缩力下降,心脏功能逐渐减退。心肌纤维化是心律失常发生的重要物质基础,通过形成折返环、传导延缓和传导阻滞,诱发心律失常[19]。有研究报道,16周的跑台运动使大鼠右心房和右心室胶原蛋白显著增加,导致心肌纤维化[11]。不同周期和不同强度运动对心肌不同部位胶原蛋白变化如何,目前鲜见相关报道。
MMP-1(matrix metalloproteinase-2,MMP-1)是调节心肌胶原蛋白降解的关键酶,可促进胶原蛋白的降解。TIMP-1(tissue inhibitors of metalloproteinase-1, TIMP-1)是MMP-1内源性生理抑制剂,可通过与其可逆结合形成复合物,从而抑制MMP-1的活性。MMP-1主要降解间质中的Ⅰ型和Ⅲ型胶原[31]。生理状态下,MMP-1和TIMP-1保持动态平衡,共同维持心肌胶原蛋白的稳定[32]。有研究表明,在高血压和容量负荷过载的大鼠心肌组织中,存在MMP-1/TIMP-1比例失调的现象[26,33]。不同强度运动对MMP-1/TIMP-1的影响如何,MMP-1/TIMP-1是否介导了过度运动导致的心肌纤维化的发生?目前鲜见报道。
本研究观测了不同强度和不同周期运动的大鼠右心房、右心室和左心室中胶原蛋白、Col-I以及MMP-1/TIMP-1的变化,从而探讨运动性心肌纤维化的发病特点及可能机制,力图进一步阐明运动性心律失常的发生发展机制。
1 材料与方法
1.1 实验对象
8周龄SPF级健康雄性SD大鼠72只,体重为(220±8 g),购自北京维通利华实验动物技术有限公司,许可证号为SCXX(京)2012-0001。所有大鼠均以啮齿类动物普通饲料喂养,在国家体育总局体育科学研究所ABSL-3级动物房饲养,室温为22±2℃,空气湿度为45%~55%,每天光照12 h。
1.2 分组和运动方案

1.3 取材
在运动8周、12周和16周后分别进行取材,每周宰杀24只大鼠,每组8只。迅速取出心脏,切取右心房、右心室和左心室,每块组织分为3份,其中1份经OCT包埋用于做冰冻切片,1份组织经多聚甲醛固定后用于制作石蜡切片,另外1份放入-80℃冰箱用于做Western blot。
1.4 天狼星红染色
为观察心肌间质的纤维化程度,采用纤维化评价典型染色方法苦味酸-天狼星红对大鼠的右心房、右心室和左心室胶原纤维进行染色。组织经脱水、透明、切片、脱蜡至水后入苦味酸-天狼猩红饱和溶液(购于北京普洛瑞斯生物公司)中15 min,经脱水透明后,中性树胶封片,400倍镜摄取图像。每组8个样本,每个样本随机选取4个视野,采用Image-Pro Plus 6.0图像分析软件通过灰度值调节区分胶原和非胶原面积进行半定量分析,得出胶原面积与视野总面积的比值,即胶原容积分数(Collagen Volume Fraction,CVF)。
1.5 免疫荧光检测胶原蛋白Ⅰ蛋白表达
冰冻切片入丙酮固定后PBS冲洗,山羊血清封闭30 min,滴加一抗(兔抗CollagenⅠ、1∶500,购于美国Abcam公司)后4℃过夜,PBS冲洗后滴加FITC标记的二抗(1∶200,购于美国Abcam公司),PBS冲洗后甘油封片,200倍镜检。在相同拍摄条件下摄取,每个样本随机摄取4张图像,采用Image-Pro Plus 6.0图像分析软件对目标蛋白荧光强度进行定量,以阴性对照样本中的荧光强度作为参照,荧光强度用积分灰度表示(Integrated Optical Density,IOD)。
1.6 Western Blot法检测心肌组织MMP-1和TIMP-1的蛋白表达
提取总蛋白后,用BCA法测定并调整蛋白浓度一致,加入上样缓冲液沸水中10 min使蛋白变性。120 V恒压SDS-PAGE电泳1 h后,200 mA恒流转膜2 h。5%脱脂奶粉(购于美国BD公司)封闭1 h,一抗(Anti-MMP-1和Anti-TIMP-1稀释比例都为1∶1 000,分别购于美国SantaCruz和Abcam公司)置于摇床4℃过夜。TBST洗涤3次后,加HRP标记的二抗(1∶5 000,购于北京欣博盛公司),室温摇床孵育1 h。TBST洗膜3次,滴加ECL化学发光试剂(购于美国Millipore),室温2 min,滤纸吸干后置于保鲜膜内封存,置于暗匣内,X光片曝光约1~5 min,显影液中显影2 min,定影数十秒,条带用Image J1.46软件进行图像分析。内参为β-actin(购于北京欣博盛公司),计算目的蛋白与内参蛋白条带的积分光密度(IOD)。
1.7 统计学分析
所得数据用 GraghPad Prism 6.0软件转换作图。所有数据均用SPSS 18.0进行分析处理,结果采用平均数±标准差表示,采用多因素方差分析组间差异。
2 结果
2.1 大鼠胶原分数的变化
结果如表1、图1和图2所示。8周运动后,与C组相比,M组和H组大鼠右心房、右心室和左心室CVF均有增加,但均不具有显著性差异,其中,H组大鼠CVF增加幅度较大。
表 1 本研究大鼠心肌组织CVF变化情况一览表
Table 1 Change of Myocardium CVF of rats (%)
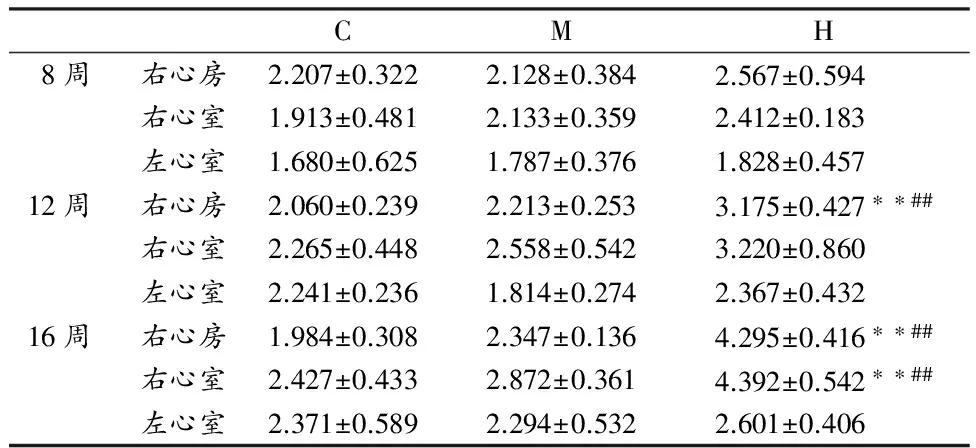
CMH8周右心房2.207±0.3222.128±0.3842.567±0.594 右心室1.913±0.4812.133±0.3592.412±0.183左心室1.680±0.6251.787±0.3761.828±0.45712周右心房2.060±0.2392.213±0.2533.175±0.427∗∗##右心室2.265±0.4482.558±0.5423.220±0.860左心室2.241±0.2361.814±0.2742.367±0.43216周右心房1.984±0.3082.347±0.1364.295±0.416∗∗##右心室2.427±0.4332.872±0.3614.392±0.542∗∗##左心室2.371±0.5892.294±0.5322.601±0.406
注: **P<0.01,与C组比较;##P<0.01,与M组比较;n=8。

图 1 本研究大鼠右心室心肌组织天狼星红染色示意图(×400)Figure 1. Sirius Red Dyeing Results in Rat Right Ventricle(×400)注:红色代表胶原纤维。n=8。
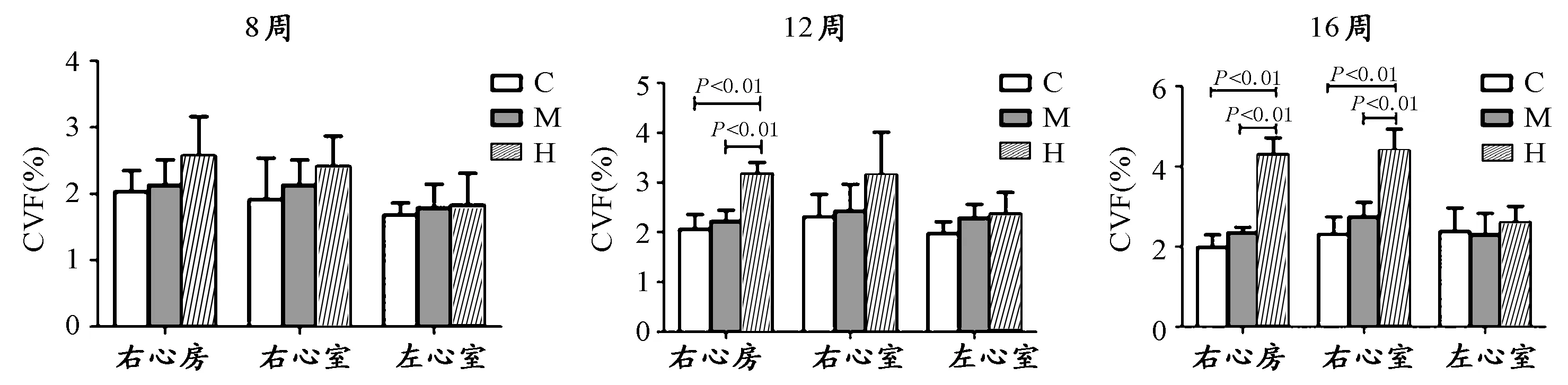
图 2 本研究大鼠心肌CVF示意图Figure 2. CVF of Rat Myocardium(n=8)
12周运动后,M组大鼠右心房和右心室CVF低于C组,而左心室CVF高于C组,但均无显著性差异。H组右心房CVF显著高于C组和M组(P<0.01),分别增加0.54倍和0.43倍。与C组相s比,H组右心室和左心室CVF虽然也有增高趋势,但均无显著性差异。
16周运动后,M组大鼠右心房和右心室CVF低于C组,而左心室CVF高于C组,但均无显著性差异。H组右心房CVF显著高于C组和M组(P<0.01),分别增加1.16倍和0.83倍。H组右心室CVF显著高于C组和M组(P<0.01),分别增加1.78倍和1.53倍。
综上所述,和C组相比,M组对心肌CVF无明显变化,而H组显著促进了右心房和右心室CVF的增加,随时间延长,CVF增加幅度越大。
2.2 大鼠Col-I的动态变化
免疫荧光染色结果如图3和图4所示。与C组相比,8周中等强度运动对右心房、右心室和左心室Col-I的表达均无显著影响。H组右心房Col-I的表达显著高于C组(P<0.05),右心室和左心室Col-I的表达也高于C组,但均无统计学意义。

图 3 本研究大鼠右心室I型胶原蛋白(Col-I)免疫荧光染色结果(×200)Figure 3. Immunofluorescence of Collagen in Rat Right Ventricle(×200)注:绿色代表Col-I。
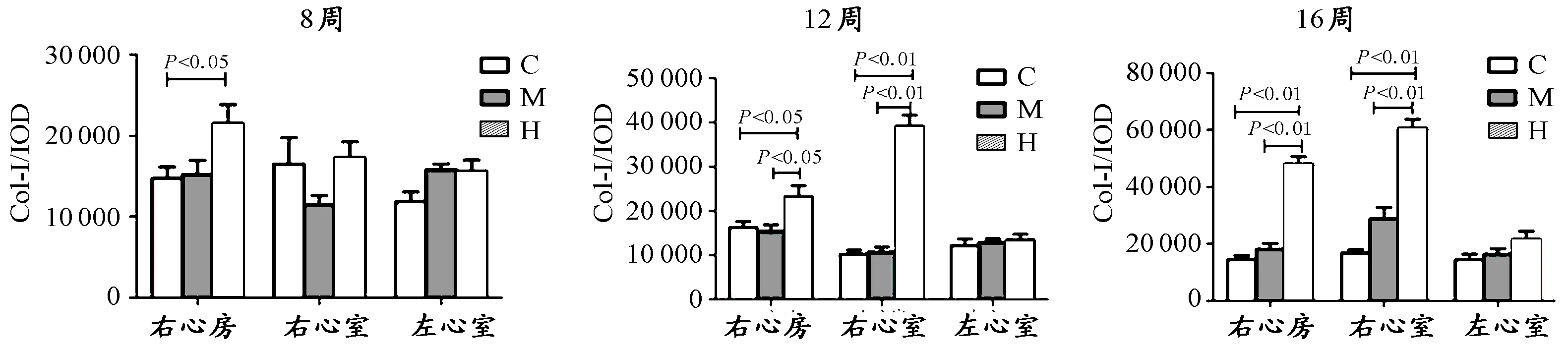
图 4 本研究I型胶原蛋白(Col-I)积分光密度示意图Figure 4. Integrated Optical Density of CollagenⅠ(n=8)
12周中等强度运动对右心房、右心室和左心室Col-I的表达均无显著影响。12周H组右心房Col-I的表达均显著高于C组与M组(P<0.05)。12周H组右心室Col-I的表达均显著高于C组与M组(P<0.01),而左心室Col-I的表达和C组无明显差异。
16周中等强度运动对右心房、右心室和左心室Col-I的表达均高于C组,但均无显著性差异。16周H组右心房和右心室Col-I的表达均显著高于C组与M组(P<0.01),而对左心室胶原蛋白无明显影响。
综上所述,和C组相比,中等强度运动对心肌Col-I的表达无明显改变,而H组显著促进了右心房和右心室Col-I的表达,而对左心室Col-I的表达影响不显著。
2.3 MMP-1和TIMP-1的变化
为进一步研究MMP-1和TIMP-1在运动性心肌纤维化中的作用,采用Western Blot检测16周大鼠右心室MMP-1和TIMP-1蛋白的表达情况,并计算其比值。
结果如图5所示,与C组相比,M组运动对MMP-1和TIMP-1无明显影响。而16周大强度运动促进了MMP-1的表达,但无统计学意义。H组TIMP-1显著高于C组和M组(P<0.01)。计算其比值发现,和C组相比,H组MMP-1/TIMP-1的比值低于C组和M组(P<0.05)。

图 5 16周运动后大鼠右心室MMP-1、TIMP-1及MMP-1/TIMP-1的比值变化Figure 5. Expression of MMP-1 and TIMP-1 of Right Ventricle after 16 Weeks and Ratio of MMP-1/TIMP-1(n=8)
3 讨论
运动员心律失常发生率高于常人已是普遍认可的事实,是影响运动员体能、健康以及正常训练比赛的重要原因。为了进一步揭示运动性心律失常的病理变化与发生机制,预防和降低运动性心律失常的发病风险和发病率,更好地保护运动员生命健康,规避运动场上心血管意外的发生,有必要深入开展运动性心肌损伤纤维化病理与发病机制的研究,力图为运动性心肌心律失常发生机制的阐释提供实验依据。研究表明,反复大强度训练或力竭运动导致心肌细胞氧自由基增多、能量代谢失调、离子通道障碍、细胞过度凋亡受损等病理现象综合诱发了运动性心肌损伤和心律失常的发生[37]。人体[12]和动物[11]研究均有证据显示,长期大强度耐力运动造成心肌损伤和心肌纤维化现象的发生,可能是造成运动心律失常的主要病理改变。Wilson等研究了12名高水平耐力运动员,发现50%的运动员存在一定程度的心肌纤维化[38]。有研究报道,长期疲劳训练后,大鼠心室肌胶原纤维出现过度增生、扭曲和局部溶解现象[6]。胶原蛋白(主要是Col-I)的合成增加、降解减少导致胶原过度沉积是造成心肌纤维化发生的主要病理变化。因此在本研究中,观察了运动性心肌纤维化发生过程中胶原蛋白的动态变化,以及降解胶原蛋白的关键酶MMP-1及其抑制剂TIMP-1的变化。
天狼星红染色结果发现,和C组相比,8周、12周和16周中等强度运动对大鼠右心房、右心室胶原和左心室CVF均有增加,但均不具有显著性差异。12周大强度运动后,右心房CVF显著高于C组和M组,右心室和左心室CVF也高于C组但无统计学意义。16周大强度耐力运动后,右心房和右心室CVF均显著高于C组和M组,左心室CVF无明显改变。结果提示,M组运动没有造成大鼠心肌纤维化病变,12周大强度耐力运动后大鼠右心房发生纤维化,且随运动时间的延长,心房纤维化程度增大,右心室的纤维化出现在第16周。Benito等发现,16周大强度运动诱导大鼠右心室而非左心室发生纤维化[11],与本研究结果一致。这提示,右心房和右心室可能是运动性心肌损伤的易发部位。这也与近年的人体实验研究结果一致,即大强度运动造成心肌病变的主要部位为右心室而非左心室。Ector等也发现,具有心律失常的耐力运动员右心室收缩末期容积显著高于没有心律失常的耐力运动员[16]。La等发现,3~11 h的耐力运动后,运动员血液肌钙蛋白I(cTnI)和B型钠尿肽显著增加,这与右心室射血分数的降低成正相关,与左心室射血分数没有相关性[21]。大负荷训练时,运动员右心室收缩末期压力的增加值远大于左心室,认为这可能是耐力运动员右心室容易受损的重要原因[23,24]。
Col-I占心肌总胶原蛋白的85%以上,是构成心肌间质的主要成分。研究发现,与胶原蛋白的含量变化一致,不同强度的耐力运动对心肌不同部位Col-I的表达不同,且具有时间依赖性。结果显示,12周和16周的大强度运动导致右心房和右心室Col-I明显增加,且随着时间延长,增加的幅度越大,而中等强度运动对心肌Col-I没有明显影响。与动物研究结果一致,La等测量27名耐力运动员进行一次超长耐力运动后即刻的射血分数后发现,运动员左心室的射血分数没有显示变化,而右心室的射血分数显著降低[22]。以往研究表明,衰老[20]、糖尿病[27]和肥胖[13]等长期慢性炎症反应都会诱导Col-I的过度表达,表现为心肌舒缩功能下降,心肌顺应性降低。另外,Col-I的过度增加也会影响心肌细胞间的电传导,造成传导阻滞诱发心律失常。
研究证实,炎症因子可通过促进胶原蛋白的表达参与心肌纤维化的发病过程。研究表明,TNF-α等炎症因子是引起Col-I表达的重要因素[34]。外源性注射TNF-α抑制剂可降低Col-I的过度表达,缓解心肌纤维化的程度[35]。研究者前期研究表明,反复力竭运动后,大鼠心脏传导系统TNF-α[3]和ICAM-1[5]等炎症因子会出现不同程度升高,诱发炎症反应。Aschar-Sobbi等的研究发现,6周力竭游泳运动诱导了心房TNF-α的高表达和心房纤维化,注射TNF-α抑制剂和敲除TNF-α基因的小鼠则抑制了炎症反应和心房纤维化[9]。研究者前期研究还发现,力竭运动后4~24 h心脏窦房结ADAMTS-1显著低表达,ADTMTS-1的降低可通过促进TGF-β1的表达促进Col-I的表达,诱导心肌间质纤维化的形成[7]。以上研究提示,长期大强度耐力运动诱发体内炎症反应,引起心肌胶原蛋白的过度增加,导致心肌纤维化的形成。
研究者进一步研究了调节胶原代谢酶系的变化情况。MMP-1是降解胶原蛋白的关键酶,TIMP-1是其生理性抑制剂,MMP-1/TIMP-1在正常动物体内保持动态平衡,其对维持胶原蛋白合成和降解的动态平衡具有重要意义[40]。MMP-1的异常表达参与了许多心血管疾病的发病过程,MMP-1的表达增加和活性过度增强,TIMP-1的表达也相应增加, MMP-1/TIMP-1的比例失调,导致胶原蛋白的合成和降解之间的平衡受到破坏,导致心肌纤维化的发生[30]。研究表明,在异丙肾上腺素诱导的心衰大鼠模型中, MMP-1表达与TIMP-1的表达升高,两者的比值增加[17]。在“两肾一夹”(用银钳夹住左肾动脉,使其狭窄)造成的肾性高血压大鼠模型中,左室心肌MMP-1与TIMP-1 mRNA的表达均增加,两者的比值显著升高[4]。Wright等研究发现,衰老诱导心肌纤维化模型大鼠心肌组织的MMP-1和TIMP-1显著高表达,MMP-1/TIMP-1平衡受到破坏[39]。本研究中发现,16周的大强度运动使大鼠右心室TIMP-1的蛋白显著增加,MMP-1变化不明显,M组运动对MMP-1和TIMP-1的表达影响不明显。计算其比值发现,16周大强度运动后,右心室MMP-1/TIMP-1的比值显著低于C组和M组,造成MMP-1/TIMP-1显著降低,MMP-1/TIMP-1平衡失调。TIMP-1可通过抑制MMP-1的活性,抑制胶原蛋白的降解,促进纤维化的形成。有研究显示,TNF-α和IL-1β可诱导细胞分泌TIMP-1[28]。可以推测,TIMP-1的高表达可能与长期高强度运动引起的体内TNF-α、IL-1β等炎性因子的增高有关。
本研究通过建立长期大强度耐力运动大鼠模型,观察到反复大强度运动诱发心肌纤维化,这可能是过度运动造成心肌反复损伤、修复最终导致的结果。美国运动医学学者研究也指出,运动强度与心脏患病风险存在U型关系,过度运动反而会增加心脏患病风险[29]。这提醒,虽然“运动是良药”,但也要适度。本研究进一步发现,反复大强度运动造成心脏损伤的部位为心房和右心室,而非左心室。国外研究指出,长期耐力运动对右心室的重塑的时间要早于左心室,重塑的程度也大于左心室[8]。通过非侵入手段在耐力运动员心脏上进行的观察也证实了这一点[15,18]。这提示,在以后进行的运动员心脏疾病筛查与诊断时,除了关注左心室,更应该关注右心室和心房的健康情况,这对于我们及时发现和预防运动员心脏发生意外具有重要价值。
本研究还发现,长期大强度运动大鼠心肌存在TIMP-1的高表达、MMP-1/TIMP-1的比例失调现象,其可能是心肌胶原过度增生沉积,心纤维化发生的重要调节机制。Lindsay等在耐力运动员血浆中也发现,胶原合成标志物PICP和TIMP-1的表达显著高于正常对照组[25]。因此可以推测,使用某些药物干预如氯沙坦,抑制TIMP-1的表达,使MMP-1/TIMP-1的表达回归于平衡,将有助于缓解大强度运动造成的胶原蛋白的过度增加,有助于抑制和预防心肌纤维化发生。因此,本动物实验研究对人类运动性心律失常的治疗靶点和干预措施选,提供了实验依据和借鉴思路,但对于干预措施的应用仍有一段距离,还需要进一步的研究与临床观察。使用哪些干预措施可以缓解过度运动造成的心肌损伤和纤维化,将是本课题组进一步研究的方向。
本研究发现,长期大强度运动导致胶原蛋白尤其是Col-I的含量过度增加,且随着运动时间的延长而增加幅度变大,最终导致右心室和右心房心肌纤维化的发生。胶原蛋白的过度增加会影响心肌舒缩性能和心肌细胞间的电传导,导致传导阻滞,诱发心律失常,这可能是运动性心律失常发生的重要病理基础。胶原蛋白的过度增加可能与心肌组织中的TIMP-1的高表达、MMP-1/TIMP-1的失衡有关。
4 小结
1.长期大强度耐力运动导致大鼠右心房和右心室胶原蛋白含量显著增加,CVF显著增高,其中,Col-I的增加更加明显。12周大强度耐力运动后大鼠右心房发生纤维化,且心房纤维化程度随时间增加而增大,而右心室的纤维化出现在第16周。过度增加的胶原纤维势必影响心肌收缩性和心电传导,构成运动性心律失常的病理基础。
2.16周长期大强度耐力运动可使大鼠右心室TIMP-1的表达显著增加,进而引起MMP-1/TIMP-1的比值降低,使胶原蛋白的降解减少,这可能是造成心肌纤维化发生的重要机制。
[1]常芸.运动员心脏的医务监督[M].北京:北京体育大学出版社,2009:203-207.
[2]常芸.运动员心脏的热点问题与研究进展[J].体育科学,2010,30(10):70-79.
[3]常芸,杨红霞.力竭运动后大鼠心脏传导系统 TNF-α的变化及其在运动性心律失常发生中的作用[J].体育科学,2012,32(7):32-38.
[4]黄帧桧,陈莉,柏松,等.葛根素联用氯沙坦对肾性高血压大鼠心肌 MMP-1/TIMP-1 比值的影响[J].中成药,2014,36(3):462-467.
[5]彭泽胄,常芸.力竭运动后不同时相大鼠心肌细胞间粘附因子-1的变化[J].中国运动医学杂志,2010,29(3):291-294.
[6]王友华,田振军.不同强度动训练对大鼠心室肌胶原纤维和 Cx43,Cx45 影响的实验研究[J].北京体育大学学报,2009,32(6):47-50.
[7]杨红霞,常芸.力竭运动后不同时相大鼠心脏窦房结ADAMTS-1的变化[J].中国运动医学杂志,2011,30(5):437-441.
[8]ARBAB-ZADEH A,PERHONEN M,HOWDEN E,etal.Cardiac remodeling in response to 1 year of intensive endurance training[J].Circulation,2014,130(24):2152-2161.
[9]ASCHAR-SOBBI R,IZADDOUSTDAR F,KOROGYI A S,etal.Increased atrial arrhythmia susceptibility induced by intense endurance exercise in mice requires TNFalpha[J].Nat Commun,2015,6.DOI:10.1038/ncomms7018.
[10]BEDFORD T G,TIPTON C M,WILSON N C,etal.Maximum oxygen consumption of rats and its changes with various experimental procedures[J].J Appl Physiol Respir Environ Exe Physiol,1979,47(6):1278-1283.
[11]BENITO B,GAY-JORDI G,SERRANO-MOLLAR A,etal.Cardiac arrhythmogenic remodeling in a rat model of long-term intensive exercise training[J].Circulation,2011,123(1):13-22.
[12]BREUCKMANN F,MOHLENKAMP S,NASSENSTEIN K,etal.Myocardial late gadolinium enhancement:prevalence,pattern,and prognostic relevance in marathon runners[J].Radiology,2009,251(1):50-57.
[13]CAVALERA M,WANG J,FRNGGOGIANNIS N G.Obesity,metabolic dysfunction,and cardiac fibrosis:pathophysiological pathways,molecular mechanisms,and therapeutic opportunities[J].Transl Res,2014,164(4):323-335.
[14]CHANG Y,YU T,YANG H,etal.Exhaustive exercise-induced cardiac conduction system injury and changes of cTnT and Cx43[J].Int J Sports Med,2015,36(1):1-8.
[15]D'ANDREA A,LA GERCHE A,GOLIA E,etal.Physiologic and pathophysiologic changes in the right heart in highly trained athletes[J].Herz,2015,40(3):369-378.
[16]ECTOR J,GANAME J,VAN DER MERWE N,etal.Reduced right ventricular ejection fraction in endurance athletes presenting with ventricular arrhythmias:a quantitative angiographic assessment[J].Eur Heart J,2007,28(3):345-353.
[17]FENG W,LI W,LIU W,etal.IL-17 induces myocardial fibrosis and enhances RANKL/OPG and MMP/TIMP signaling in isoproterenol-induced heart failure[J].Exp Mol Pathol,2009,87(3):212-218.
[18]JONGMAN J K,ZAIDI A,MUGGENTHALER M,etal.Relationship between echocardiographic right-ventricular dimensions and signal-averaged electrocardiogram abnormalities in endurance athletes[J].Eur,2015,17.
[19]KONG P,CHRISTIA P,FRANGOGIANNIS N G.The pathogenesis of cardiac fibrosis[J].Cell Mol Life Sci,2014,71(4):549-574.
[20]KWAK H B.Aging,exercise,and extracellular matrix in the heart[J].J Exe Rehabil,2013,9(3):338-347.
[21]LA G A,BURNS A T,MOONEY D J,etal.Exercise-induced right ventricular dysfunction and structural remodelling in endurance athletes[J].Eur Heart J,2012,33(8):998-1006.
[22]LA G A,CONNELLY K A,MOONEY D J,etal.Biochemical and functional abnormalities of left and right ventricular function after ultra-endurance exercise[J].Heart,2008,94(7):860-866.
[23]LA G A,HEIDBUCHEL H,BURNS A T,etal.Disproportionate exercise load and remodeling of the athlete's right ventricle[J].Med Sci Sports Exe,2011,43(6):974-981.
[24]LA G A,ROBERTS T,CLAESSEN G.The response of the pulmonary circulation and right ventricle to exercise:exercise-induced right ventricular dysfunction and structural remodeling in endurance athletes (2013 Grover Conference series)[J].Pulm Circ,2014,4(3):407-416.
[25]LINDSAY M M,DUNN F G.Biochemical evidence of myocardial fibrosis in veteran endurance athletes[J].Brit J Sports Med,2007,41(7):447-452.
[26]LOPEZ B,GONZALEZ A,DIEZ J.Role of matrix metalloproteinases in hypertension-associated cardiac fibrosis[J].Curr Opin Nephrol Hypertens,2004,13(2):197-204.
[27]LORENZO O,RAMIREZ E,PICATOSTE B,etal.Alteration of energy substrates and ROS production in diabetic cardiomyopathy[J].Mediat Inflamm,2013,2013:461967.
[28]NEE L E,MCMORROW T,CAMPBELL E,etal.TNF-alpha and IL-1beta-mediated regulation of MMP-9 and TIMP-1 in renal proximal tubular cells[J].Kidney Int,2004,66(4):1376-1386.
[29]PATIL H R,O'KEEFE J H,LAVIE C J,etal.Cardiovascular damage resulting from chronic excessive endurance exercise[J].Missouri Med,2012,109(4):312-321.
[30]PEI Z,MENG R,LI G,etal.Angiotensin-(1-7) ameliorates myocardial remodeling and interstitial fibrosis in spontaneous hypertension:Role of MMPs/TIMPs[J].Toxicol Lett,2010,199(2):173-181.
[31]SPINALE F G.Myocardial matrix remodeling and the matrix metalloproteinases:Influence on cardiac form and function[J].Physiol Rev,2007,87(4):1285-1342.
[32]SBINALE F G,VILLARREAL F.Targeting matrix metalloproteinases in heart disease:Lessons from endogenous inhibitors[J].Biochem Pharmacol,2014,90(1):7-15.
[33]VOLOSHENYUK T G,GARDNER J D.Estrogen improves TIMP-MMP balance and collagen distribution in volume-overloaded hearts of ovariectomized females[J].Am J Physiol Regul Integr Comp Physiol,2010,299(2):R683-693.
[34]WANG J H,SU F,WANG S,etal.CXCR6 deficiency attenuates pressure overload-induced monocytes migration and cardiac fibrosis through downregulating TNF-alpha-dependent MMP9 pathway[J].Int J Clin Exp Pathol,2014,7(10):6514-6523.
[35]WESTERMANN D,VAN LINTHOUT S,DHAYAT S,etal.Tumor necrosis factor-alpha antagonism protects from myocardial inflammation and fibrosis in experimental diabetic cardiomyopathy[J].Basic Res Cardiol,2007,102(6):500-507.
[36]WHYTE G,SHEPPARD M,GEORGE K,etal.Post-mortem evidence of idiopathic left ventricular hypertrophy and idiopathic interstitial myocardial fibrosis:Is exercise the cause?[J].Brit J Sports Med,2008,42(4):304-305.
[37]WILHELM M,ROTEN L,TANNER H,etal.Atrial remodeling,autonomic tone,and lifetime training hours in nonelite athletes[J].Am J Cardiol,2011,108(4):580-585.
[38]WILSON M,O'HANLON R,PRASAD S,etal.Diverse patterns of myocardial fibrosis in lifelong,veteran endurance athletes[J].J Appl Physiol (1985),2011,110(6):1622-1626.
[39]WRIGHT K J,THOMAS M M,BETIK A C,etal.Exercise training initiated in late middle age attenuates cardiac fibrosis and advanced glycation end-product accumulation in senescent rats[J].Exp Gerontol,2014,50:9-18.
[40]ZHANG L,LI X,Bi L J.Alterations of collagen-I,MMP-1 and TIMP-1 in the periodontal ligament of diabetic rats under mechanical stress[J].J Periodontal Res,2011,46(4):448-455.
Effects of Endurence Exercise of Different Intensity on Cardiac Collagen of Rats and Regulation of MMP-1/TIMP-1
WANG Shi-qiang1,2,CHANG Yun2,MA Xiao-wen2,WANG Fei2
Objective:To explore whether sustained intensive exercise induces myocardial fibrosis through observing the dyanamics of collagen expression,and discuss the change MMP-1/TIMP-1 expression,thus provide experimental evidence for clarifiying the mechanism of exercise- induced arrhythmia.Method:72 SD rats were divided into control group (C),moderate intensity group (M) and high instensity group (H) with 24 animals in each group.M and H group were conditioned to run 4,8,and 16 weeks,5 days/weeks,1h/day.Rats were euthanized to obtain hearts within 24h after exercise.Right atrium,Right ventricle and Left ventricle were collected.Cardiac collagen were quantified by CVF which is calculateed through by sirius red.Collagen expression were quantified by Immunofluorescence.MMP-1 and TIMP-1 expression were detected by Western Blot.Results:Increasing CVF and collagen expression along time were noted in right atrium and right vetricule by intensity endurance exercise(P<0.01).No differences were observed in left ventricle and M group.In further reserch,enhanced TIMP-1 expressed were noted (P<0.01),but only slight increase of MMP-1 in right ventricle after 16 weeks of intensive exercise.As a result,the ratio of MMP-1/TIMP-1 were decreased (P<0.05).We could not find difference of MMP-1 and TIMP-1 in M group compared to C group.Conclusion:Long-term intensity exercise promotes excessive expression of collagen in right atrium and right ventricle,thus leads to impaired right ventricular founction and myocardial fibrosis.Possible mechanism maybe involve overexpression TIMP-1,imbalance of MMP-1/TIMP-1 ratio induced by long-term extensive exercise.
exercise;myocardialfibrosis;collagen;MMP;heart;rat;animalexperiment
2015-03-19;
2015-07-25
国家体育总局体育科学研究所基本科研业务经费资助(14-01)。
王世强(1987-),男,山东济宁人,在读博士研究生,主要研究方向为运动心脏生理和病理,E-mail:suswsq@163.com;常芸(1957-),女,内蒙古呼和浩特人,研究员,博士,博士研究生导师,主要研究方向为运动员心脏病生理与医务监督,Tel:(010)87182526,E-mai:changyun@ciss.cn;马晓雯(1989-),女,北京人,在读硕士研究生,主要研究方向为运动心脏生理和病理;王菲(1990-),女,江苏扬州人,硕士,主要研究方向为运动心脏生理和病理。
1.上海体育学院 运动科学学院,上海 200438;2.国家体育总局体育科学研究所,北京 100061 1.Shanghai University of Sport,Shanghai 200438,China;2.China Institute of Sport Science,Beijing 100061,China.
1002-9826(2015)05-0060-07
10.16470/j.csst.201505010
G804.7
A
