梅花PmAP2基因的克隆及表达1)
2015-03-06徐宗大郝瑞杰杨炜茹
徐宗大 郝瑞杰 杨炜茹
(花卉种质创新与分子育种北京市重点实验室(北京林业大学),北京,100083) (城乡生态环境北京实验室(北京林业大学))
程堂仁 王佳 张启翔
(国家花卉工程技术研究中心(北京林业大学)) (城乡生态环境北京实验室(北京林业大学))
责任编辑:任 俐。
花发育一直是观赏植物研究的重点,前人通过拟南芥等模式植物的研究,提出了植物花器官发育的ABC模型、ABCE模型及四因子模型[1-3]。在拟南芥中,A功能基因包括APETALE1(AP1)和APETALE2(AP2),它们控制着萼片和花瓣的发育[4]。其中AP2基因编码属于AP2/ERF家族的转录因子,除参与花分生组织建立和花器官发育外,AP2基因还调控了种子的发育[5-6]。此外,AP2基因在营养器官中也有表达,但其突变体对营养器官的表型没有影响[7]。
梅花(Prunus mume Sieb.et Zucc.)是蔷薇科(Rosaceae)李属(Prunus)重要的观赏花木与果树,为中国十大传统名花之一。在长期的栽培及人工育种过程中,梅花形成了单瓣、重瓣、台阁、飞瓣、多萼片、多雌蕊等花型[8]。这些丰富的花型既增加了梅花的观赏价值,也为研究植物花器官发育提供了良好的材料。然而,对梅花花器官发育基因的相关研究鲜见报道,梅花花发育的分子机理尤其是不同花型形成的机理尚不明确。鉴于AP2基因在植物花器官发育尤其是萼片和花瓣发育中具有重要的功能,本研究对梅花AP2基因进行了克隆,并对其在梅花不同器官(营养器官和花器官)、不同花型(单瓣、重瓣、台阁)品种中的表达模式进行研究,以期明确PmAP2基因在梅花花器官发育及花型形成中的功能,为通过分子生物学手段改良梅花花型奠定基础。
1 材料与方法
试验于2014年在花卉种质创新与分子育种北京市重点实验室(北京林业大学)进行。以‘三轮玉蝶’(Prunus mume‘Sanlun Yudie’)花蕾为试材,提取总RNA用于基因克隆;取‘三轮玉蝶’根、茎、叶、萼片、花瓣、雄蕊、雌蕊、未成熟果实等材料进行基因的组织特异性表达分析;以单瓣品种‘江梅’(Prunus mume‘Jiangmei’)、重瓣品种‘三轮玉蝶’和台阁品种‘素白台阁’(Prunus mume‘Subai Taige’)的花蕾为材料,研究基因在不同花型梅花花蕾的表达差异。所有材料液氮速冻后-80℃保存。
总RNA提取及第一链cDNA合成:将试验材料在液氮中研成粉末后,采用百泰克公司的RNApure高纯总RNA提取试剂盒提取总RNA。经琼脂糖凝胶电泳和紫外分光光度法检测RNA质量后,以2μg总RNA为模板,采用TIANScript cDNA第一链合成试剂盒合成第一链cDNA。操作方法参照试剂盒说明书进行。
PmAP2基因克隆:以拟南芥AP2蛋白序列(NP_195410.1)为种子,在梅花基因组蛋白库中进行本地BLAST搜索,将同源性最高的序列作为候选基因。根据基因核苷酸序列设计引物,扩增基因的编码区(CDS)。以梅花cDNA为模板进行RT-PCR扩增,引物序列见表1。PCR反应程序为94℃预变性5 min;94℃变性30 s,58℃退火30 s,72℃延伸2 min,30个循环;72℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳后,采用Promega Gel extraction kit DNA凝胶回收试剂盒回收目的片段,连接到pMD18-T(Takara)载体上,转化大肠杆菌Top10,挑取阳性克隆经PCR验证后,交由中美泰和生物技术有限公司测序。
PmAP2基因序列分析:将克隆得到的序列提交到Interprto网站(https://www.ebi.ac.uk/interpro/)上进行保守结构域分析;采用DNAMAN软件对PmAP2蛋白与其他物种AP2蛋白进行比对分析;用EXPASy的ProtParam程序(http://web.expasy.org/protparam/)分析PmAP2蛋白的相对分子质量、理论等电点以及疏水性;将克隆得到的核苷酸序列提交到psRNATarget网站(http://plantgrn.noble.org/psRNATarget/?function=2)上进行miRNA靶位点预测;采用clustalX[9]进行多序列比对,利用MEGA6软件采用N-J方法构建系统进化树[10],bootstrap值设为1 000次。
实时荧光定量RT-PCR:分别提取样品的总RNA,反转录成cDNA,作为real-time RT-PCR的模板。反应采用20μL体系,即cDNA 2μL,SYBR Premix Ex Taq(Takara)10μL,上下游引物(10μmol·L-1)各0.4μL,ddH2O 7.2μL。反应程序为95℃预变性30 s;95℃变性5 s,60℃延伸30 s,40个循环。扩增产物特异性通过溶解曲线进行确定,试验设置3次生物学重复和3次技术重复。结果与分析采用2-ΔΔCt法,以梅花PP2A基因作为内参基因[11],引物序列见表1。

表1 梅花PmAP2基因克隆及表达所用引物序列
2 结果与分析
2.1 PmAP2基因的克隆与序列
以梅花花蕾cDNA为模板进行PCR扩增,经连接、转化、测序后,得到长为1 647 bp的CDS序列(图1)。BLAST分析表明,该基因与多种植物AP2基因有较高的同源性,其中与桃AP2基因的相似性最高,为96%,与苹果AP2基因的相似性为82%。CDS编码一个由548个氨基酸组成的蛋白质,其相对分子质量为57.75 kD,理论等电点为6.04,为亲水性蛋白。Interpro分析表明,此蛋白含有AP2蛋白特有的两个保守的AP2结构域,并且在第一个AP2结构域上游有一个核定位信号,这些特征与其他物种AP2蛋白一致(图1)[12-13]。将该基因命名为PmAP2,Genebank登录号为KP405836。将得到的CDS序列提交到植物miRNA靶基因预测网站psRNATarget进行序列分析,发现在3’端有一个miR172结合位点(图1黑框中序列),说明PmAP2的表达可能受miR172的调控。
2.2 蛋白质多序列比对及系统进化
采用DNAMAN将得到的PmAP2蛋白与其他植物AP2蛋白进行多序列比对发现,11种植物的AP2蛋白的一致性为50.81%。核定位信号、两个AP2保守结构域(及其之间区域)、miRNA172结合位点这三部分序列在不同物种间保守性较高,而其余序列在不同物种间保守性较低(图2)。核定位信号的同源性最高,所有植物的核定位信号序列均为KKSRRGPRSR。两个AP2结构域之间的序列同源性也非常高,说明这部分序列在连接两个结构域行使功能方面有重要作用。MiR172结合位点在比对的裸子植物(银杏)、单子叶植物(玉米)和被子植物 AP2序列中都存在,且保守性也很高。

图1 PmAP2基因CDS序列及推导的氨基酸序列
为进一步了解梅花与其他物种AP2蛋白的进化关系,利用MEGA6构建了梅花与其他17种植物AP2蛋白的系统进化树(图3)。根据系统进化树,18种植物的AP2蛋白可以分为3组。两种单子叶植物(小麦和玉米)单独聚为一组;3种裸子植物:银杏、黑松和欧洲云杉聚为一组;其余的双子叶植物的AP2蛋白为一组。在双子叶植物进化枝中,梅花与另外两种蔷薇科植物桃和苹果的亲缘关系最近,这3种植物的AP2蛋白先聚为一组,然后与其他双子叶植物的基因聚为一组。系统进化树与物种进化较为一致。
2.3 梅花AP2基因的表达模式
以梅花PP2A基因为内参,对PmAP2在不同组织(根、茎、叶、萼片、花瓣、雄蕊、雌蕊、外/中(果皮)、内果皮和种子)中的表达模式进行了研究。如图4a所示,PmAP2在梅花营养器官和生殖器官中均有表达,说明PmAP2广泛参与到梅花各种器官的发育。PmAP2在花瓣中表达量最高,其次为雌蕊和内果皮,而在营养器官(根、茎、叶)中的相对表达量较低,说明PmAP2在梅花生殖生长过程中发挥重要的作用。
梅花的花型非常丰富,但关于这些花型形成的机理尚缺乏相应的研究。鉴于AP2基因在花器官决定及花发育过程中有非常重要的作用,文中对PmAP2在单瓣、重瓣和台阁梅花中的表达模式进行了研究,以期为揭示梅花不同花型的形成机理奠定基础。如图4b所示,PmAP2在最原始的单瓣品种‘江梅’的表达量最低,而在花型最复杂的台阁品种‘素白台阁’的表达量最高,二者相差将近一倍(图4b)。其在重瓣品种‘三轮玉蝶’中的表达量居中。这表明随着花型复杂程度的增加,PmAP2的表达量呈上升的趋势,PmAP2可能参与了梅花复杂花型的形成。
3 结束语
本研究从梅花花蕾中成功分离出花器官决定基因PmAP2。序列同源性分析表明该基因与其他蔷薇科物种(桃和苹果)AP2基因的同源性非常高。该基因编码的蛋白具有AP2蛋白的典型特征:有两个高度保守的AP2结构域和一个完全保守的核定位信号[14]。这说明此基因属于AP2基因家族,且具有转录因子的特征。此外,蛋白序列同源性分析表明,除高度保守的两个AP2结构域(及其之间序列)、核定位信号和miR172靶位点这三部分序列外,不同物种的AP2基因保守性较低,说明AP2基因发生了种属特异的进化过程,从而导致不同物种AP2基因序列上的差异;而高度保守区域的存在说明这些区域在AP2正常功能发挥方面有着重要的作用,因而在进化过程中保存下来。例如,miR172靶位点在较原始的裸子植物(银杏)、单子叶植物和双子叶植物中都存在,说明miR172调控AP2表达是一种原始的调控机制,并且在维持AP2正常功能方面发挥着重要的作用,因而在长期的物种进化中保存了下来。
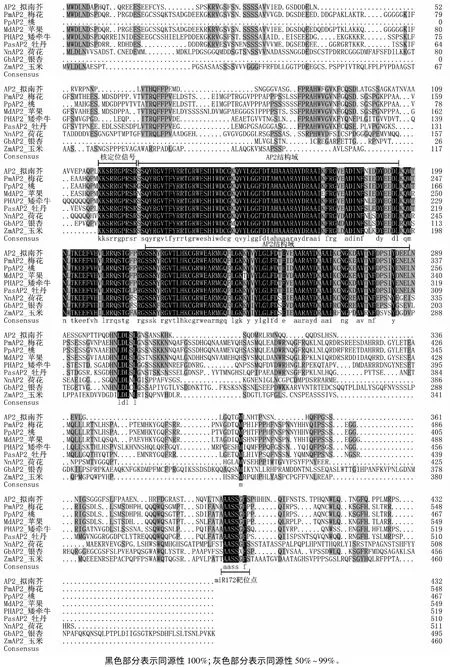
图2 梅花与其他物种AP2基因的多序列比对

图3 梅花与其他物种AP2系统进化树
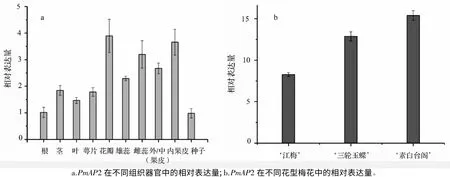
图4 PmAP2表达模式
在花器官发育的ABC模型中,AP2基因行使A类基因的功能,参与了萼片和花瓣的决定。除此之外,两个A类基因(AP1和AP2)还参与了植物的成花转变和早期的花序分生组织建立[1,15-16]。在拟南芥和其他物种中,AP2在四轮花器官及营养生长组织中均有表达[6,13,17-19]。荧光定量PCR结果显示,PmAP2在梅花营养器官及四轮花器官中也均有表达,与前人研究结果基本一致[6,13,17-19]。花瓣的表达量最高,说明AP2在花瓣发育中发挥重要的作用。Jofuku et al.[6]研究表明,AP2基因在拟南芥种子发育尤其是种皮的发育中发挥重要作用。矮牵牛的三个AP2基因在成熟的胚乳中高表达,但在胚中不表达[20]。本研究发现PmAP2在梅花外果皮、中果皮(果肉)和内果皮的表达量都非常高,说明PmAP2还参与了梅花果实的发育,AP2基因对果实发育的调控机制在不同物种中是相似的。此外,文中还研究了PmAP2在不同花型梅花中的表达模式,结果表明,随着花型复杂程度的增加,PmAP2的表达量也在增加。这意味着AP2基因很可能参与了梅花复杂花型的形成。台阁花型是梅花中比较奇特的一类花型,是由于雌蕊被另外一朵花取代而形成的[21]。形态解剖表明,台阁的上位花是在原本应该分化雌蕊的位置分化出了萼片,进而分化出完整的上位花。由此推测,很可能是在原本应该C类基因表达的部位,A类基因特异表达,从而分化出上位花的萼片。因此,PmAP2在台阁花型梅花中的大量表达可能与台阁花上位花形成有关。
本研究克隆了梅花中的AP2基因,并对其表达模式进行了分析,为进一步研究梅花花发育的调控机理及花型形成与进化奠定了基础。
[1]Weigel D,Meyerowitz E M.The ABCs of floral homeotic genes[J].Cell,1994,78(2):203-209.
[2]Coen E S,Meyerowitz E M.The war of the whorls:genetic interactions controlling flower development[J].Nature,1991,353:31-37.
[3]TheiBen G,Saedler H.Plant biology:floral quartets[J].Nature,2001,409:469-471.
[4]Causier B,Schwarz-Sommer Z,Davies B.Floral organ identity:20 years of ABCs[J].Seminars in Cell&Developmental Biology,2010,21(1):73-79.
[5]Okamuro J K,Caster B,Villarroel R,et al.The AP2 domain of APETALA2 defines a large new family of DNA binding proteins in Arabidopsis[J].Proceedings of the National Academy of Sciences,1997,94(13):7076-7081.
[6]Jofuku K D,Den Boer B G,Van Montagu M,et al.Control of Arabidopsis flower and seed development by the homeotic gene APETALA2[J].The Plant Cell,1994,6(9):1211-1225.
[7]戴思兰.园林植物遗传学[M].北京:中国林业出版社,2004.
[8]陈俊愉.中国梅花品种图志[M].北京:中国林业出版社,2010.
[9]Larkin M A,Blackshields G,Brown N P,et al.Clustal W and Clustal X version 2.0[J].Bioinformatics,2007,23(21):2947-2948.
[10]Tamura K,Stecher G,Peterson D,et al.MEGA6:Molecular evolutionary genetics analysis version 6.0[J].Molecular Biology and Evolution,2013,30(12):2725-2729.
[11]Wang Tao,Hao Ruijie,Pan Huitang,et al.Selection of suitable reference genes for quantitative real-time polymerase chain reaction in Prunus mume during flowering stages and under different abiotic stress conditions[J].Journal of the American Society for Horticultural Science,2014,139(2):113-122.
[12]Liu Zhaolei,Gu Chunsun,Chen Fadi,et al.Identification and expression of an APETALA2-Like gene from Nelumbo nucifera[J].Applied Biochemistry and Biotechnology,2012,168(2):383-391.
[13]任磊,王雁,周琳,等.牡丹PsAP2基因的克隆及表达[J].林业科学,2011,47(9):50-56.
[14]Kim S,Soltis P S,Wall K,et al.Phylogeny and domain evolution in the APETALA2-like gene Family[J].Molecular Biology and Evolution,2006,23(1):107-120.
[15]Shannon S,Meeks-Wagner D R.Genetic Interactions that regulate inflorescence development in Arabidopsis[J].The Plant Cell,1993,5(6):639-655.
[16]Kunst L,Klenz J E,Martinez-Zapater J,et al.AP2 gene determines the identity of perianth organs in flowers of Arabidopsis thaliana[J].The Plant Cell,1989,1(12):1195-1208.
[17]宋长年,房经贵,王晨,等.基于EST库的枳APETALA2基因cDNA克隆及其表达分析[J].园艺学报,2009,36(6):799-806.
[18]宿红艳,周盛梅,王磊,等.草莓APETALA2同源基因的克隆及表达分析[J].西北植物学报,2006,25(10):1937-1942.
[19]周盛梅,宿红艳,王磊,等.苹果apetala2同源基因的克隆和转化研究[J].园艺学报,2006,33(2):239-243.
[20]Maes T,van de Steene N,Zethof J,et al.Petunia AP2-like genes and their role in flower and seed development[J].The Plant Cell,2001,13(2):229-244.
[21]陈俊愉.中国梅花研究的几个方面[J].北京林业大学学报,1995,17(S1):1-6.
