白藜芦醇在大鼠体内的吸收代谢分析
2015-03-06彭晓琳郝丽萍孙秀发陈忠伟
彭晓琳,徐 健,郝丽萍,孙秀发,陈忠伟
(1 南山区慢性病防治院慢非科,深圳 518054;2深圳市慢性病防治中心,深圳 518020;3华中科技大学同济医学院营养与食品卫生系,武汉 430030)
白藜芦醇(resveratrol,Res)属于非黄酮类多酚化合物,化学名称为3,5,4'-三羟基二苯乙烯(3,5,4'-trihydroxystilbene),又称芪三酚。已有研究表明,白藜芦醇具有抗癌、抗心血管疾病、抗突变、抗菌、抗炎、抗氧化、诱导细胞凋亡及雌激素调节等药理活性[1]。植物化学物的生物利用度及其在体内代谢、转化等方面的研究是确定植物化学物生物效应的重要基础。目前,有关白藜芦醇在动物及人体内的吸收和代谢的研究报道较少,因此,明确白藜芦醇在体内的吸收代谢情况是当前研究的重点。本研究利用高效液相色谱和气相色谱-质谱联用方法,系统地研究了大鼠灌饲白藜芦醇后,白藜芦醇在体内的代谢情况,为深入探讨其健康生物学效应和制订人体推荐摄入量奠定基础,也为提高白藜芦醇在体内的生物利用度及应用于临床提供实验依据。
1 材料和方法
1.1 器材
Waters 1525 binary HPLC 色谱泵(美国)及荧光检测器;Hypersil C18(250mm ×4.6mm ×5μm)液相色谱柱及相同填充颗粒的C18保护柱;气相色谱-质谱(GCMS)联用仪(Agilent GC HP 6890/MS HP 5975);SPE C18小柱,N2 吹干仪。
1.2 试剂
白藜芦醇及白藜芦醇苷标准品(美国Sigma 公司):纯度99%、四蒸水、乙酸乙酯(分析纯)、乙醇(分析纯)、甲酸(分析纯)、正庚烷(分析纯)、衍生化试剂BSTFA、乙腈(色谱纯)、甲醇(色谱纯)、冰乙酸(色谱纯)。
1.3 实验动物
雄性Wistar 大鼠10 只,体重180~200 g (湖北省动物中心提供)。实验前禁食10h,照常饮水。
1.4 实验方法
1.4.1 标准曲线浓度系列配制
准确称取白藜芦醇及反式白藜芦醇苷各2.0mg,置于15mL 真空离心管中,分别用10mL 甲醇溶解并充分混匀,制成标准储备液,然后按1∶1 比例混匀,依次稀释配制成10、5、2.5、1、0.5、0.25、0.1、0.05mg/L混合标准浓度系列。然后吸取该混合系列各浓度20μL按选定的HPLC 色谱条件进样检测,以峰面积积分值×105为横坐标(X)、混合标准液浓度为纵坐标(Y)绘制标准曲线。
1.4.2 代谢学色谱条件
(1)HPLC 测定
色谱柱:美国Hypersil ODS-C18(4.6mm ×250mm,5μm);柱温:35℃;流动相A (甲醇:乙酸:水=10∶2∶88)、B (甲醇:乙酸:水=90∶2∶8);流速1.0mL/min;检测波长为λex=330nm、λem=374nm;进样量20μL;梯度洗脱:0min,85% A、15% B;5min,65%A、35% B;8min,65% A、35% B;15min,50% A、50%B;25min,30%A、70%B,待该梯度完成后间隔10min 后使系统回到初始状态再继续进样。
(2)GC-MS 测定
色谱条件:进样口温度280℃,柱温采用程序升温,初温100℃,保持2min 后,以10℃/min 速度升至300℃,恒温 10min,载气为纯氦气,流速为110mL/min。
质谱条件:接口温度280℃,El 离子源,电子能量70 eV,离子源温度230℃,四极杆温度106℃,电子倍增器电压1 400V,质量扫描范围30~550。
1.4.3 动物给药方案
动物适应性喂养1w 后,分装到10 个代谢笼中饲养。实验前禁食12h,按50mg/(kg·bw)剂量灌胃给以白藜芦醇。灌胃白藜芦醇后0min、10min、30min、1h、3h、5h、7h、24h、48h 从大鼠内眦静脉取血,静脉血样置于含肝素钠的抗凝管中,2 000g 离心10min,按1.4.1步骤处理待测。
1.4.4 品预处理
(1)血浆
100μL 血浆分别加入加100μL 甲酸水溶液(pH=3.5)和300μL 乙腈,漩涡震荡1min,然后4 000g 离心10min,将上清转入另一管中,40℃氮气吹干。再将残渣重悬于100μL 流动相中,取一定体积进行HPLC 检测。进行GC-MS 分析时,则需进行衍生化处理,在残渣中加入一定体积2-三甲基甲硅烷基三氟乙酰胺(BSTFA)60℃处理30min 后待测。
(2)尿样
将得到的鼠尿通过C18柱,然后用乙醇萃取,萃取液用N2吹干仪于45℃吹干。剩下的油性残渣溶解在流动相中待测。如是进行GC-MS 分析,则需进行衍生化,同前。
2 结果与分析
2.1 白藜芦醇与白藜芦醇苷HPLC 图谱

图1 标准品(A)及样品(B)中白藜芦醇及其苷类的HPLC 图谱
2.2 HPLC 检测
2.2.1 标准曲线绘制
如图2 所示,以峰面积×105为横坐标,标准品的浓度为纵坐标绘制标准曲线,白藜芦醇及其糖基化物在0~10mg/L 浓度范围内线性较好,白藜芦醇的回归方程为y=0.050 7x-0.050 6 (R2=0.999 5)、白藜芦醇苷的回归方程为y=0.031 4x-0.076 8 (R2=0.999 6)。
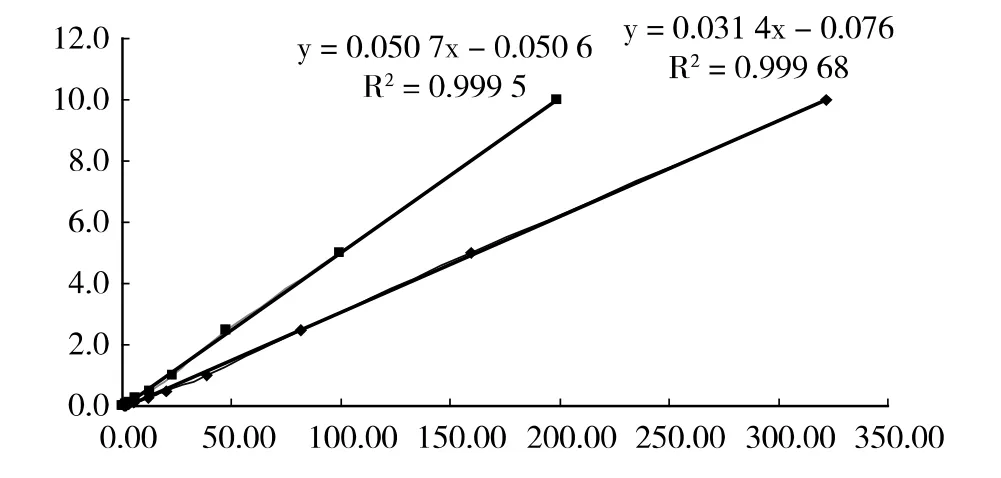
图2 白藜芦醇及白藜芦醇苷标准曲线绘制
2.2.2 白藜芦醇代谢
(1)血浆HPLC 检测
如图3 所示,白藜芦醇进入体内可迅速转换为其糖基化衍生物,摄入后10min 血液中即可检测到白藜芦醇苷,浓度约为10mg/L,3h 后达到高峰,血液中可含23.78mg/L 糖基化苷,5h 后代谢趋缓,到24h 时几乎代谢完毕;而白藜芦醇则在摄入后1h 达到高峰,但其含量不到同时段内其糖基化物的1/3,且在3h 后血浆中含量逐渐趋于零。

图3 大鼠灌饲白藜芦醇后血浆中白藜芦醇及白藜芦醇苷浓度-时间效应
(2)尿液HPLC 检测
如图4 所示,白藜芦醇原型及其糖基化衍生物主要在白藜芦醇摄入后24h 内从尿液排泄。24h 内约排出4.26mg 白藜芦醇原型、0.32mg 白藜芦醇糖基化衍生物。24~48h 之间仅排出白藜芦醇原型物质0.03mg、白藜芦醇衍生化物约0.01mg。

图4 大鼠灌饲白藜芦醇后尿液中白藜芦醇及白藜芦醇苷浓度-时间效应
(3)血浆GC-MS 检测
机体摄入白藜芦醇1h 后,血浆中代谢产物明显增加,3h 达到高峰,种类最多,含量也最高,与HPLC 法分析所得结果具有一致性。
3 讨论
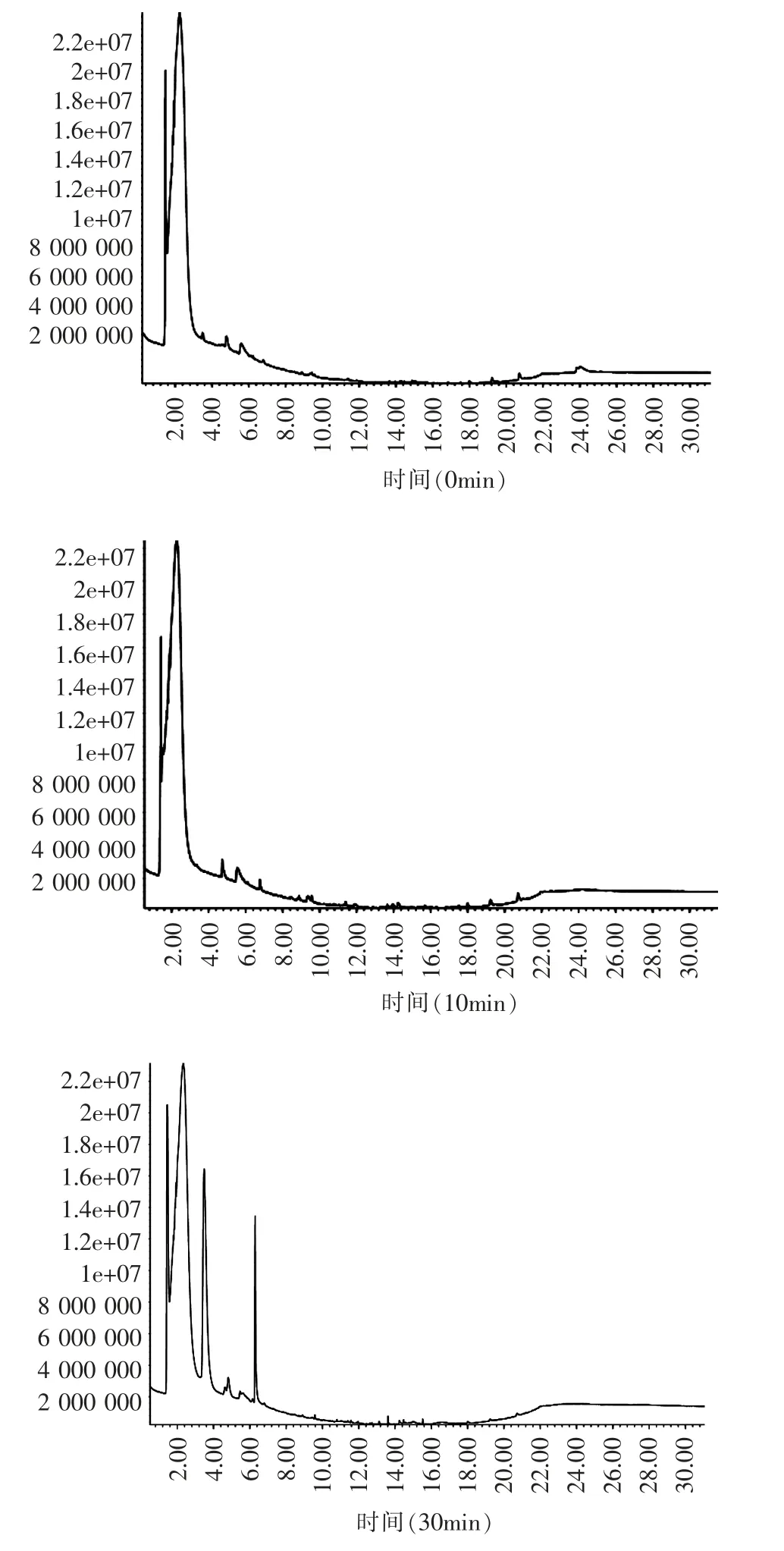
图5 GC-MS 法分析不同时间血浆中白藜芦醇及其代谢物情况
研究显示,植物化学物的功效学是与其生物利用度及其在体内的代谢途径,代谢物的组织分布、转化及排泄等方面密切相关的。本研究发现,白藜芦醇摄入60min 后,血浆中白藜芦醇原型即已出现峰值,但其含量不高;而白藜芦醇糖基化衍生物3h 后才达到最高,其含量是前者的5 倍,说明白藜芦醇口服摄入后,主要以糖基化形式进入血浆进行代谢。有研究者报道[2~5],经腹腔注射白藜芦醇后不到10min,血浆中白藜芦醇含量即消除了一半,4~8h 后血浆中白藜芦醇浓度又急骤上升,发生了肠肝循环。本研究通过口服摄入白藜芦醇则未观察到这一现象,说明白藜芦醇的摄入方式是影响其生物利用度的关键因素之一。通过气质联用分析发现,白藜芦醇经口摄入3h 后,血浆中的代谢产物含量及种类均达到最多,这进一步验证了白藜芦醇在血浆中的代谢情况,如前述HPLC 分析结果所示,血浆中白藜芦醇苷在白藜芦醇摄入后3h 达到峰值,即白藜芦醇进入体内后,主要以其各种代谢产物的形式存在。
本研究还发现,尿液中白藜芦醇和白藜芦醇苷含量与血浆中完全相反,白藜芦醇经口摄入(约7~8g)24h后,大量白藜芦醇原型可经尿液排泄,累计排泄率超过摄入量的一半,而白藜芦醇糖基化苷则仅有仅有白藜芦醇原型水平的十几分之一,不到总摄入量的4%。说明白藜芦醇在体内可能主要以糖基化物发挥生物学功效,白藜芦醇原型在机体内的生物利用率相对较小。研究证明,白藜芦醇排泄与摄入的是纯品还是食物也有关,饮用葡萄汁(主要为白藜芦醇糖甙形式)后,白藜芦醇的累积排泄量只有给予同样剂量的纯品的1/10[4],说明白藜芦醇的摄入形式会对研究结果产生很大的影响,食物中因含有多种化合物可能会干预白藜芦醇的吸收。
由此看来,在不同的种属、不同的纯度及食物来源等情况下,白藜芦醇的代谢情况是存在明显差异的,在进行白藜芦醇的某一特殊功效研究时,有必要根据具体的种属及受试物来评价白藜芦醇的这一生物学作用,这样对其应用于临床及确定治疗剂量具有重要的实践意义。鉴于纯品的吸收量和速度都远远超过食物,如果白藜芦醇对机体确实是有益而无害的,那么,食用白藜芦醇保健品将是预防和治疗血管性疾病的重要手段之一。
[1]余慧琳.白藜芦醇的生理功能及其应用前景[J].生物学通报,2005,40(11):12-13.
[2]Juan M E,Alfaras I,Planas J M.Determination of dihydroresveratrol in rat plasma by HPLC [J].J Agric Food Chem,2010,58(12):7472-7475.
[3]Juan M E,Maijo M,Planas J M.Quantification of transresveratrol and its metabolites in rat plasma and tissues by HPLC [J].J Pharm Biomed Anal,2010,51(2):391-398.
[4]Wenzel E,Somoza V.Metabolism and bioavailability of trans-resveratrol [J].Mol Nutr Food Res,2005,49(5):472-481.
[5]Andriambeloson E,Kleschyov A L,Muller B,et al.Nitric oxide production and endothelium-dependent vasorelaxation induced by wine polyphenols in rat aorta [J].Br J Pharmacol,1997,120(6):1053-1058.
