甘灵茶抗氧化成分的提取工艺研究
2015-03-06邵素娟段振华
万 鹏,颜 颢,邵素娟,段振华
(海南大学食品学院,海口 570228)
灵芝(Ganoderma lucidum)外形呈伞状,菌盖肾形、半圆形或近圆形,为多孔菌科真菌灵芝的子实体。我国最早的药学专著《神农本草经》将灵芝列为上品,有紫、赤、青、黄、白、黑六种,被称之为:“上上之药,方中妙品”[1]。灵芝多糖GLA、GLB、GLC 对超氧阴离子自由基(O-2 ·)的产生和红细胞脂质过氧化均有抑制作用,并对羟基自由基(·OH)有清除作用,具有超氧化物歧化酶样活性,是灵芝抗氧化、延缓衰老的重要因素[2-4]。
甘灵茶的原料来自于甘草和灵芝,接种过灵芝的甘草布满了灵芝菌丝体,通过灵芝菌丝的分解,将甘草里难以被人吸收的物质转化成易被人体吸收的成分,因而营养、保健与药用价值得到了更大的提高。本文以甘灵茶为原料,从中提取抗氧化成分,以甘灵茶提取液清除DPPH 的效果为评价指标,研究甘灵茶中抗氧化成分的提取技术,并对提取液中的多酚和多糖进行测定,旨在为甘灵茶的开发利用提供参考。
1 材料与方法
1.1 试验材料
甘灵茶,海南全仙禾生物科技有限公司提供;96%DPPH,上海源叶生物科技有限公司;95%乙醇、氢氧化钠、盐酸、福林酚、碳酸钠、无水葡萄糖、苯酚、浓硫酸均为国产分析纯。
1.2 仪器及设备
EL204 型电子天平,梅特勒—托利多仪器(上海)有限公司;A11BS 型高速组织捣碎机,IKA 集团;HHS26S 型电热恒温水浴锅,江苏金坛市大地自动化仪器厂;PHS-3C 型pH 计,上海精密科学仪器有限公司;722 可见分光光度计,上海奥普勒有限公司;101-2 型电热鼓风恒温干燥箱,常州市华普达教学仪器有限公司。
1.3 溶液配制
1.3.1 蒽酮试剂的配制 精确称取蒽酮2.000g,用98%浓硫酸溶解并定容至1 000mL。
1.3.2 DNS 试剂的配制 精确称取6.5g 3,5-二硝基水杨酸溶于少量热水,移入1000mL 容量瓶,加入2moL/L 氢氧化钠溶液325mL,再加入丙三醇45g,摇匀,定容至1000mL。
1.4 DPPH 清除率的测定方法[5-6]
称取DPPH 试剂7.9mg,用乙醇溶液溶解,定量转入100mL 容量瓶中,并定容至刻度,摇匀得浓度为79.0mg/L DPPH 储备液(2.0×10-4mol/L)置于冰箱中冷藏备用。利用DPPH 自由基的溶液特征紫红色团的吸收峰,用分光光度法分别测定各样品提取液在波长517nm 处吸收值。按表1 加反应液。

表1 试样加样表
将Ai所表示的样品溶液在室温下避光反应一定时间(30min)后,在517nm 处,以调零管为基准,先测定每个条件下空白对照组的吸收值(A0),再平行测定该条件下三次吸收值(Ai),求得清除率的平均值。DPPH 清除率的计算公式为(1)式:
DPPH 清除率(%)=1-Ai/A0×100 (1)
1.5 多酚的测定方法[7]
标准曲线的测定;采用福林—酚法。精密称取20mg 没食子酸标准品,蒸馏水溶解并定容至200mL 分别吸取0.0、0.1、0.2、0.3、0.4、0.5mL 标准品溶液,各补水至0.5mL。然后加入10%FC 试剂2.5mL,充分摇匀。反应5min 后加入溶液7.5%Na2CO3溶液5mL,50℃水浴锅中反应5min。室温避光保存1h。于波长760nm 处测定吸光度。标准曲线回归方程结果为:Y=5.398 6X+0.020 2,R2=0.995 4,Y:吸光度;X:没食子酸质量浓度(mg/mL)。
样品测定;吸取甘灵茶提取液0.5mL,按上述步骤操作测定吸光度,以标准曲线回归方程和用量计算甘灵茶提取液多酚得率见(2)式。

1.6 多糖的测定方法[8]
1.6.1 总糖标准曲线的制作
采用蒽酮—硫酸法。精确量取0.0、0.2、0.4、0.6、0.8、1.0mL 葡萄糖标准液(100mg/mL)于6 支试管中,再分别加入蒸馏水至总体积为1mL,摇匀后分别加入5mL 蒽酮试剂,混匀后置于沸水浴中加热6min,取出冷却至室温,以空白管为对照,在620nm 波长处测定吸光度。以吸光度为横坐标,葡萄糖浓度为纵坐标,绘制标准曲线。线性回归方程为:y=192.56x-0.386 7,R2=0.999 9。
样品测定:吸取甘灵茶提取液1mL,按上述步骤操作测定吸光度,以线性回归方程和用量计算甘灵茶提取液总糖含量。
1.6.2 还原糖标准曲线的制作
采用DNS 法。分别精密吸取0.0、0.2、0.4、0.6、0.8、1.0、1.2、1.4mL 葡萄糖标准液(1 000mg/L),加入8 个25mL 容量瓶中,加水至总体积为2.5mL,再分别加入3mL DNS 试剂,混匀后置于沸水浴中加热5min,取出后立即冷却至室温,加水定容至25mL,摇匀后,以空白管为对照,在540nm 处测定吸光度。以吸光度为横坐标,葡萄糖浓度为纵坐标,绘制标准曲线。线性回归方程为:y=4326.2x +101.01,R2=0.999 7。
样品测定:吸取甘灵茶提取液2.5mL,按上述步骤操作测定吸光度,以线性回归方程和用量计算甘灵茶提取液还原糖含量。
1.6.3 多糖含量计算
多糖含量=总糖含量-还原糖含量
1.7 试验方法
1.7.1 单因素试验
(1)提取温度的确定:在蒸馏水pH 为7.0、提取时间为15min、甘灵茶用量为3%的情况下,提取温度分别为40、50、60、70、80℃条件下,以提取液清除DPPH 的能力为指标,确定最佳提取温度。
(2)pH 的确定:在提取温度为60℃,提取时间为15min、甘灵茶用量为3%的情况下,溶剂(蒸馏水)pH 分别为2.5、4.5、6.5、8.5、10.5 的条件下,以提取液清除DPPH 的能力为指标,确定最佳pH。
(3)提取时间的确定:在提取温度为60℃、蒸馏水的pH 为6.5、甘灵茶用量为3%的情况下,提取时间分别为5、15、25、35、45、55min,以提取液清除DPPH 的能力为指标,确定最佳提取时间。
(4)甘灵茶用量的确定:在提取温度为60℃、蒸馏水的pH 为6.5、提取时间为15min 的情况下,甘灵茶用量分别为1%、2%、3%、4%、5%时,以提取液清除DPPH 的能力为指标,确定最佳用量。
1.7.2 测定甘灵茶提取液DPPH 清除率[9]
在单因素试验的基础上,以提取温度、溶剂pH、提取时间、甘灵茶用量为因素,DPPH 清除率为指标,设计了四因素三水平的正交试验,各因素水平见表2。
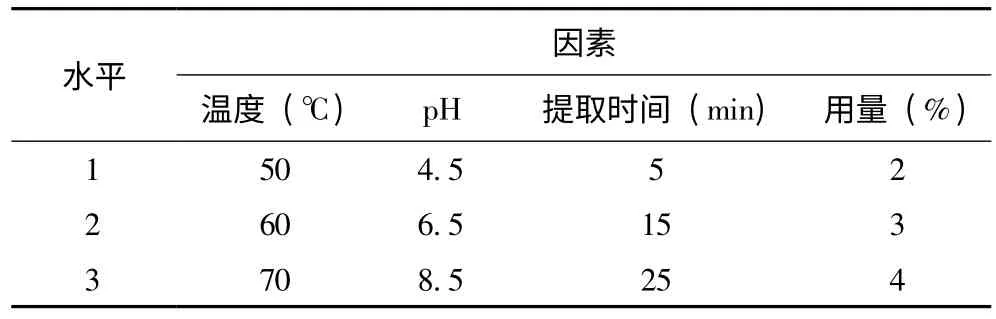
表2 正交试验设计
2 结果与讨论
2.1 温度对甘灵茶提取液的抗氧化性影响
在蒸馏水pH 为7.0、提取时间为15min、甘灵茶用量为3%的情况下,分别测定40、50、60、70、80℃等5 个不同温度条件下的甘灵茶提取液的DPPH 清除率,结果见图1。
从图1 可知,随着温度的升高,DPPH 清除率呈现先上升后下降然后趋于平稳的变化趋势。温度在50~60℃的范围内,曲线的斜率最大,即DPPH 清除率值增加最快,当温度高于60℃时,曲线下降后趋于平稳。因而提取温度以60℃最佳。原因可能是随着温度的升高,抗氧化物质如多酚和多糖等渗出、扩散速率加快,从而DPPH 清除率升高,但温度高于60℃,DPPH 清除率反而下降,这是由高温对抗氧化物质活性不利。

图1 不同提取温度对甘灵茶提取液DPPH 清除率的影响
2.2 溶剂pH 值对甘灵茶提取液的抗氧化性影响
在提取温度为60℃、提取时间为15min、甘灵茶用量为3%的情况下,测定了pH 分别为2.5、4.5、6.5、8.5、10.5 时甘灵茶提取液的DPPH 清除率。由图2 可知,随着pH 的升高,曲线开始相差不大,随后呈先升后降的趋势,当pH 为6.5 时,甘灵茶提取液的DPPH 清除率最高。原因可能是是pH 过高或过低都会影响甘灵茶抗氧化物质的活性,因而取pH 为6.5 最适宜。
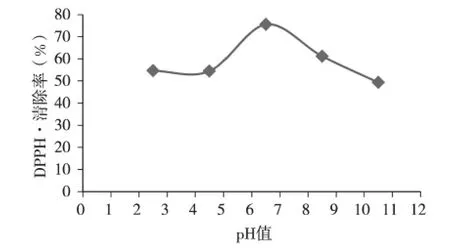
图2 不同提取pH 值对甘灵茶提取液DPPH 清除率的影响
2.3 提取时间对甘灵茶提取液的抗氧化性影响
在提取温度为60℃、蒸馏水的pH 为6.5、甘灵茶用量为3%的情况下,测出提取时间分别为5、15、25、35、45、55min 的条件下对甘灵茶提取液的DPPH 清除率的影响,结果见图3。

图3 不同提取时间对甘灵茶提取液DPPH 清除率的影响
由图3 可知,随着提取时间的增加,曲线呈先升后降的趋势,当提取时间为15min 时,甘灵茶提取液的DPPH 清除率最高。原因可能是时间过长多酚类等活性物质的结构发生改变,如由于多酚类羟基的氧化、偶联作用,多酚羟基数量减少,抗氧化能力相应降低[10],导致DPPH 清除率下降。
2.4 甘灵茶用量对甘灵茶提取液的抗氧化性影响
在提取温度为60℃、蒸馏水的PH 为6.5、提取温度为60℃的情况下,测出甘灵茶用量分别为1%、2%、3%、4%、5%时甘灵茶提取液的DPPH 清除率,结果见图4。
由图4 可知,随着甘灵茶用量的增加,曲线呈先升后降的趋势,当甘灵茶的用量为3%时,甘灵茶提取液的DPPH 清除率最高。原因可能是随着甘灵茶用量的增加,抗氧化活性物质的溶出、扩散速率加快,从而促进提取液中多酚、多糖等成分的提高,因此DPPH 清除率升高。当甘灵茶用量继续增加时,在同样的提取时间下用量大的甘灵茶浸泡不够彻底,不利于原料中多酚、多糖的溶出,使DPPH 清除率下降。因此,甘灵茶用量取3%最佳。
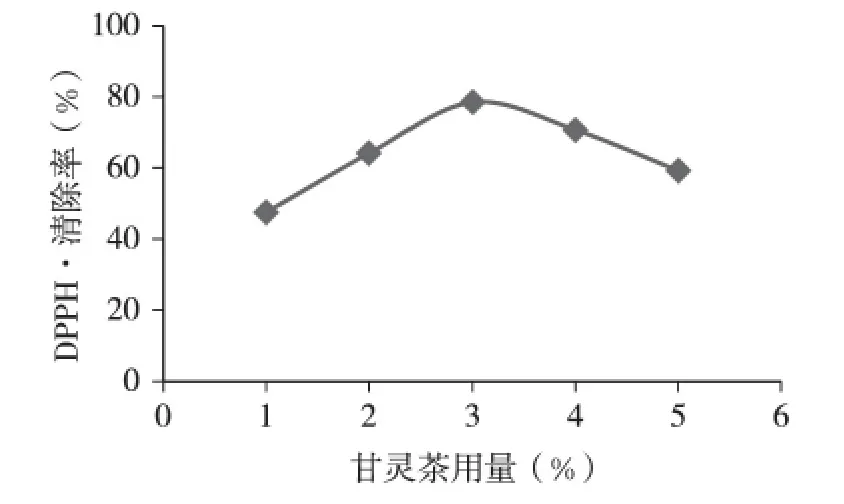
图4 不同甘灵茶用量对甘灵茶提取液DPPH 清除率的影响
2.5 甘灵茶提取液的正交试验
根据上述单因素试验结果,对提取温度,提取pH,提取时间,甘灵茶用量进行了正交试验,试验结果及方差分析结果分别见表3 和表4。可以看出各因素对甘灵茶提取液影响顺序为B >D >A >C,即提取pH 的影响最大,甘灵茶用量其次,提取温度次之,提取时间的影响最小。从正交试验结果看,提取温度应选水平3 较好,提取时间选水平3 较好。但是方差分析结果表明只有提取pH 和甘灵茶用量2 个因素的影响显著,加上节能和提取速率的考虑,决定提取温度选水平2、提取时间选水平1 较好。综上,最佳提取工艺为A2B3C1D2。即pH 为8.5、甘灵茶用量为3%、温度60℃、时间15min,在此条件下DPPH 清除率为86.24%。
多酚具有较强的清除自由基、抗氧化活性[7,11]。最近的研究表明,灵芝多糖对细胞的抗氧化作用十分明显[12]。为此,对提取液中的多酚和多糖分别进行了测定,发现多酚含量为0.187mg/mL,多糖含量为0.244mg/mL。因此,这些成分对DPPH 清除率的提高起着重要的作用。
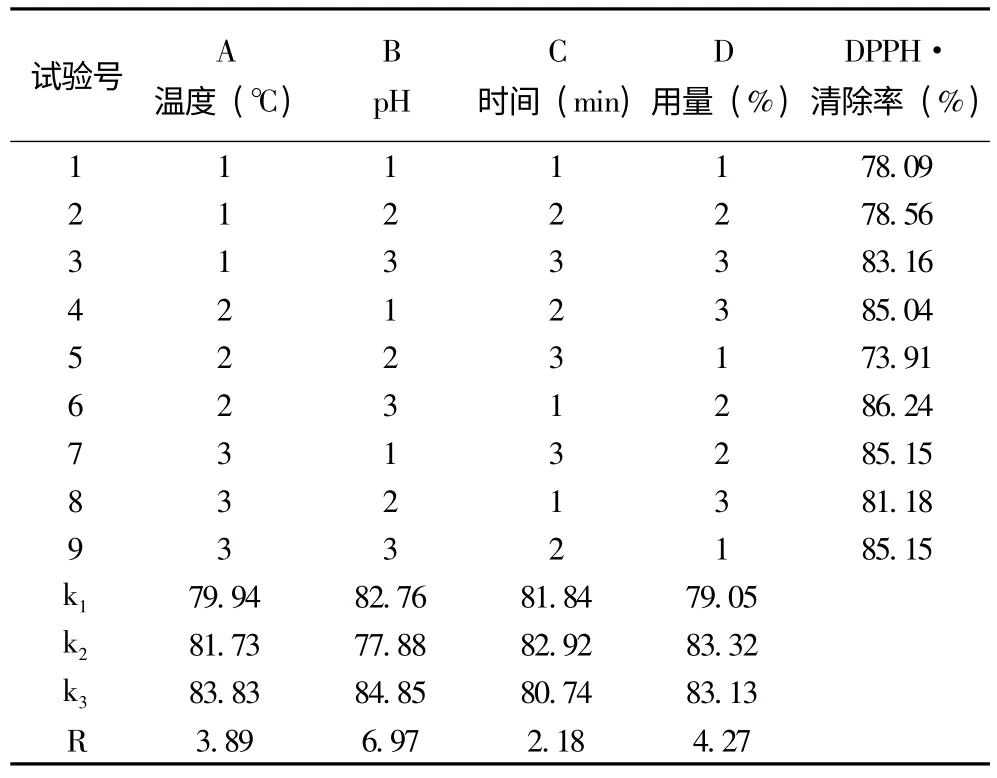
表3 甘灵茶提取液正交试验结果
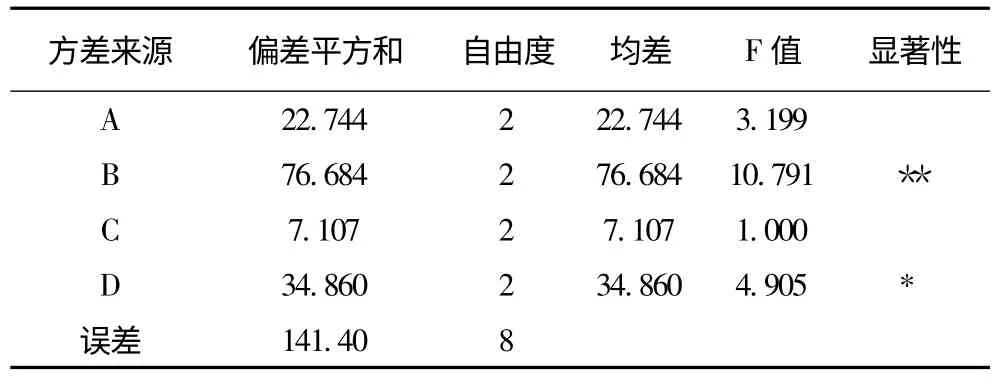
表4 方差分析结果
3 结论
通过单因素试验和正交试验,确定了抗氧化性高的甘灵茶提取液的提取工艺,最佳工艺为提取温度为60℃、溶剂pH 值为8.5、提取时间为15min、甘灵茶用量为3%。在此条件下DPPH 清除率为86.24%,提取液中的多酚含量为0.187mg/mL,多糖含量为0.244mg/mL。
[1]林兰.糖尿病中西医结合诊疗规范[M].北京:军事医学科学出版社,2010,28-31.
[2]李荣芷,何云庆.灵芝多糖抗衰老机理的探讨[J].老年学杂志,1992,3:184-186.
[3]林志彬.灵芝抗氧化清除自由基作用的研究[J].菌物研究,2014,2:63-70.
[4]王新.灵芝多糖的提取及抗氧化活性研究[D].江苏大学,2007.
[5]王萍,梁坤,杨顶成.苹果皮提取物中抗氧化物质的研究[J].食品工业科技,2007,8:97-99.
[6]韦海胜,常虹,段振华,刘小兵.牡蛎肉酶解液的抗氧化工艺研究[J].食品科技,2012,6:150-153.
[7]刘怡彤,等.超声波辅助提取黄秋葵多酚和多糖的工艺研究[J].食品工业科技,2013,21:247-249.
[8]李强,等.蒽酮—硫酸法和3,5-二硝基水杨酸法测定杜仲水提液多糖含量[J].食品工业科技,2010,10:370-371.
[9]段振华,汪菊兰,王美蓉.超声波辅助制备鱼鳔寡肽的研究[J].中国食物与营养,2008,6:27-29.
[10]陈金娥,丰慧君,张海容.红茶、绿茶、乌龙茶活性成分抗氧化性研究[J].食品科学,2009,3:65.
[11]唐守勇,王文渊,张芸兰,等.竹叶中黄酮和茶多酚的高压脉冲电场提取[J].中国食物与营养,2014,20(12):54-57.
[12]毛健,马海乐.灵芝多糖的研究进展[J].食品科学,2010,1:297.
