大鼠原代神经细胞放射性损伤敏感性与ROS含量关系及依达拉奉的保护作用
2015-03-06田立桩朱文霞刘玉虎吴信笃赵福贵
高 晨,田立桩,朱文霞,刘玉虎,吴信笃,赵 昱,赵福贵
兰州军区兰州总医院1安宁分院神经外科;2神经外科;3安宁分院创伤外科,甘肃兰州 730070
大鼠原代神经细胞放射性损伤敏感性与ROS含量关系及依达拉奉的保护作用
高 晨1,田立桩2,朱文霞3,刘玉虎1,吴信笃1,赵 昱1,赵福贵1
兰州军区兰州总医院1安宁分院神经外科;2神经外科;3安宁分院创伤外科,甘肃兰州 730070
目的:探讨大鼠原代神经细胞培养体系放射性损伤敏感性与ROS含量关系以及依达拉奉的保护作用。方法:X射线单次照射来源于大鼠海马的原代神经元、星形胶质细胞以及星形胶质细胞-神经元共培养体系,对比评价正常培养或依达拉奉干预与否条件下细胞死亡、凋亡以及活性氧(ROS)含量变化。结果:X射线照射引起原代神经元培养体系ROS含量及细胞死亡率明显升高。共培养体系细胞损伤较轻,星形胶质细胞培养体系则无明显损伤。依达拉奉通过清除ROS可以阻止细胞死亡。结论:放射损伤后,原代神经元培养体系ROS含量明显增高,导致神经元凋亡失调。依达拉奉通过清除ROS逆转这一病理过程而产生神经元保护作用,值得临床推广。
共培养;放射性损伤;活性氧;依达拉奉;神经保护
头颈部肿瘤的有效治疗手段之一是放射治疗,在杀伤肿瘤细胞的同时,随之而来的放射性脑损伤也是目前各种放疗手段均不能完全避免的副损伤。近年来影像诊断技术的进步使得放射性脑损伤的检出率逐渐增加,成为不可忽视的医源性损伤原因之一[1]。研究表明,中枢神经系统各类细胞在射线照射后反应不尽相同。星形胶质细胞出现反应性增生[2],小胶质细胞增殖并释放出炎症介质[3],少突胶质细胞产生放射性脱髓鞘改变[4]并伴随凋亡增加[5],而血管内皮细胞肥大导致血管壁增厚[6]。神经元在放射性损伤后出现大量凋亡[7],尤其是海马神经元对放射线更为敏感,损伤后出现海马依赖性进行性功能损害,在学习、记忆和空间信息处理等方面发生缺陷,其确切的机制尚不明确。以往研究表明,脑损伤后增殖的星形胶质细胞通过神经内分泌及毒素清除作用而保持内环境稳定并促进神经元修复[8],而脑损伤所致神经元凋亡失调的重要机制之一是活性氧簇(reactive oxygen species,ROS)的爆发[9]。新型自由基清除剂依达拉奉(3-甲基-1-苯基-2-吡唑啉-5-酮,EDA),通过清除自由基,抑制脂质过氧化,从而抑制脑细胞、血管内皮细胞、神经细胞的氧化损伤,在颅脑损伤的临床救治中显示出良好的疗效。本研究分别建立大鼠海马原代神经元、星形胶质细胞以及星形胶质细胞-神经元共培养体系,对比检测不同培养体系对放射性损伤的敏感性。随后通过原代细胞ROS含量检测,进一步探讨放射性脑损伤可能机制以及依达拉奉的脑保护作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 胚胎海马组织取自18 d胎鼠大脑,数量30只,用以建立原代海马神经元培养体系及星形胶质细胞-神经元共培养体系。乳鼠海马组织取自出生24 h内SD乳鼠大脑,数量10只,用以建立原代海马星形胶质细胞培养体系。所有实验动物均来源于兰州大学实验动物中心 [SCXK(甘)-0295],动物实验经过医院伦理委员会书面同意,具备动物实验资格,并严格遵循国际动物实验指南。
1.1.2 主要试剂及仪器 除特别声明以外,细胞培养所需试剂均购自Gibco公司;胎牛血清购自Hy-clone公司;阿糖胞苷、GlutaMax培养基补充物、多聚赖氨酸及L-谷氨酸均购自Sigma公司;DAPI购自Roche公司;依达拉奉购自南京先声东元制药有限公司,批号:H20031342;DCFH-DA试剂盒购自江苏碧云天生物技术研究所;AnnexinV异硫氰酸荧光素(fluorescein isothiocyanate,FITC) 试 剂 盒 购 自Pharmingen公司。
制冰机(Scotsman,意大利);直热式CO2培养箱(Thermo,美国);C2共聚焦显微镜(Nikon,日本);超净工作台(苏州净化设备仪器厂);低温离心机(Ep-pendorf,德国);细胞爬片(Thermo,美国);尼龙网(BD,美国);培养板及培养皿(Nunc,美国);流式细胞仪(Beckman,美国)。
1.2 方法
1.2.1 建立大鼠原代海马星形胶质细胞-神经元共培养体系 75%医用乙醇浸泡处死胎鼠,在超净台的无菌环境下冰浴开颅整块地取出脑组织,显微镜下钝性分离留取海马部位,仔细剥离弃去脑膜、血管等其余部位。将全部海马组织放入玻璃培养皿中用4℃冰汉克斯平衡盐溶液(HBSS缓冲液)反复冲洗,随后用眼科剪刀将其剪成1 mm3大小的组织块,加入用HBSS缓冲液稀释的0.25%胰蛋白酶2 mL及脱氧核糖核酸酶Ⅰ,37℃培养箱消化30 min,HBSS缓冲液终止消化3次。组织悬液经过200目尼龙网过滤后收集滤液。滤液离心后转移至含有5%胎牛血清的Neurobasal-A培养基中 (含有0.5 mmol·L-1的L-谷氨酸,0.5 mmol·L-1的GlutaMax培养基补充物,100 U·mL-1青霉素+100 μg·mL-1链霉素,0.02%的B27血清补充物)利用巴斯德移液管吹打3次,充分混匀,再经过孔径为80 μm的尼龙网过滤。细胞悬液在室温下1000 r·min-1离心3 min,弃去上清液,利用不含胎牛血清的Neurobasal-A培养基重悬,显微镜下用细胞计数板调整细胞浓度至1.5×106cells/mL,随后种植于多聚赖氨酸包被的培养皿及细胞爬片上,放置在37℃,5%CO2,95%空气,湿度维持在85%的恒温培养箱中培养。细胞种植4~6 h后更新全部细胞培养基,随后显微镜下观察细胞生长状况,每3~4天更新一半细胞培养基。在种植后的第4天,培养基中加入1.5 mmol·L-1亮氨酸甲酯去除小胶质细胞。培养3周后,细胞用于后续试验。
1.2.2 建立大鼠原代海马神经元培养体系 高纯度的大鼠原代神经元培养体系建立与星形胶质细胞-神经元共培养体系相同的胎鼠海马细胞悬液。细胞悬液浓度、种植程序与星形胶质细胞-神经元共培养体系相同。在细胞种植后72 h,通过在培养基内加入10 mmol·L-1的胞嘧啶阿糖胞苷及降低培养基中血清浓度来抑制星形胶质细胞的生长。培养3周后,细胞用于后续试验。
1.2.3 建立大鼠原代星形胶质细胞培养体系 高纯度的大鼠原代星形胶质细胞来源于出生24 h SD乳鼠大脑海马组织,细胞分离、纯化、种植程序与星形胶质细胞-神经元共培养体系建立过程相同。不同的是细胞种植于含有10%的胎牛血清的DMEMF12培养基中,细胞悬液浓度与前述培养体系一致。种植1 h后更新全部细胞培养基以去除成纤维细胞,随后每3~4天更新一半细胞培养基。在种植后的第4天,培养基中加入1.5 mmol·L-1亮氨酸甲酯去除小胶质细胞。细胞需要经过至少两次消化后传代,但需保持传代前后细胞种植密度一致。培养3周后应用于后续实验。
1.2.4 细胞纯度鉴定 利用免疫荧光三标技术鉴定不同原代神经细胞培养体系的细胞纯度。各体系随机选取细胞爬片5张,于24孔板中在室温下通过4%的多聚甲醛(pH 7.4的PBS溶媒)固定30 min。用PBS溶解1%牛血清蛋白(BSA)+0.3%Triton X-100,在室温下振荡器上缓慢封阻非特异性结合并破膜1 h。PBS清洗15 min。用一抗稀释液配制1∶1000神经元抗核抗体(NeuN,兔源多克隆抗体,Ab-cam公司,美国)和 (或)1∶500胶质纤维酸性蛋白(GFAP,小鼠源单克隆抗体,CST公司,美国),每孔中加入约500 μL,4℃缓慢振荡器孵育过夜。PBS清洗15 min。用PBS配制荧光二抗1∶100 FITC(康为世纪,北京)和1∶100异硫氰酸罗丹明(TRITC,康为世纪,北京),室温下缓慢振荡器孵育2 h。PBS清洗15 min。再次室温下避光孵育,PBS配制1∶2000的4′,6-二脒基-2-苯基吲哚 (4′,6-diamidino-2-phenylindole,DAPI)10 min。PBS清洗15 min后将细胞爬片盖于载玻片上,60%甘油PBS封片,荧光显微镜 (尼康Ti-S,日本)下观察并进行图像采集。FITC激发/发射波长480 nm/535 nm,TRITC激发/发射波长535 nm/610 nm。
利用Images J软件进行图像分析,每组细胞选择10个不同的400倍视野计数不同荧光着染细胞数,取其平均值计算细胞比例。
1.2.5 细胞分组 各原代神经细胞培养体系分别随机分为对照组(Control group):始终进行正常培养;放射损伤组(X-ray group):通过X线照射造成细胞放射性损伤;放射性损伤+依达拉奉组(X-ray+EDA group):细胞接受X线照射后给予依达拉奉干预处理。
1.2.6 细胞放射性损伤[7]采用Varian 2100C型直线加速器,剂量率4 Gy·min-1的6 MV X射线造成细胞放射性损伤。射线从细胞贴壁面垂直入射,并加垫1.0 cm厚有机玻璃板,照射总剂量为30 Gy。照射完毕后继续正常培养,72 h后继续后续实验。
1.2.7 依达拉奉干预处理[4]细胞照射接受X射线照射后,在培养基中加入100 mol·L-1依达拉奉进行干预处理,继续正常培养,72 h后继续后续实验。
1.2.8 细胞死亡率测定 利用细胞存活/死亡荧光分析试剂盒(英国Invitrolife公司)对比检测细胞死亡率。该试剂盒通过乙啡啶同源二聚体着染死亡细胞核DNA在528 nm激发波长下显示红色荧光,通过钙黄绿素-AM着染细胞质在494 nm激发波长下显示绿色荧光。按照说明书将试剂稀释后加入细胞爬片所在的24孔板内,每孔中加入约500 μL,室温下避光孵育30 min。然后将细胞爬片盖于载玻片上,60%甘油PBS封片,荧光显微镜(尼康Ti-S,日本)下观察并进行图像采集。
利用Images J软件进行图像分析,每组细胞选择10个不同的200倍视野计数不同荧光着染细胞数,取其平均值,计算细胞死亡率。
1.2.9 细胞凋亡检测 利用NeuN/DAPI免疫荧光双标在荧光显微镜下观察细胞凋亡情况,并计算凋亡率。各组细胞爬片在24孔板中室温4%的多聚甲醛固定30 min,PBS清洗15 min。室温下避光孵育,PBS配制1∶2000的DAPI 10 min。荧光显微镜下观察凋亡细胞形态。
1.2.10 ROS检测[10]采用双乙酸双氯双氢荧光素(CM-H2DCF-DA)法检测接种于培养皿上的各组原代神经细胞培养体系的ROS含量。各原代培养体系的不同组细胞分别制作单细胞悬液,每个样品收集10×103个细胞。检测2′,7′-二氯荧光素(DCF)荧光强度,间接测定细胞内活性氧水平。
1.3 统计学方法
本研究数据资料采用SPSS13.0统计软件包进行分析。计量资料采用均数±标准差(±s)表示。不同组样本均数间的两两比较采用单因素方差分析(One-way ANOVA)。根据各组总体方差齐同与否,选择Bonferroni法或Tamhane's T2法修正结果,以P<0.05为差异有统计学意义。
2 结 果
2.1 各原代神经细胞培养体系细胞纯度测定(见图1,见表1)
体外培养3周后,利用GFAP/NeuN/DAPI免疫荧光三标技术鉴定不同原代神经细胞培养体系细胞纯度。来源于胎鼠海马组织的原代星形胶质细胞-神经元共培养体系中神经元比例>50%,星形胶质细胞比例>45%;同样来源于胎鼠海马组织的原代神经元培养体系中,神经元纯度>80%;来源于乳鼠海马组织的原代星形胶质细胞培养体系中,星形胶质细胞纯度>95%。各培养体系细胞形态正常,生长状态良好,符合进一步实验要求。

图1 各原代神经细胞培养体系免疫荧光染色结果(200×)
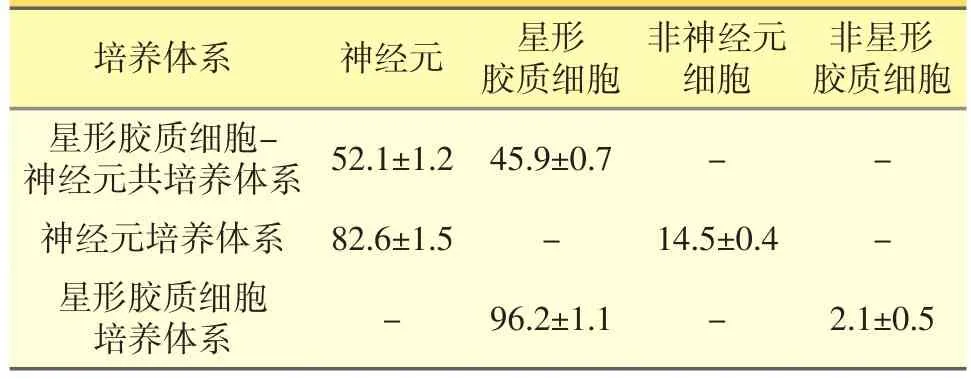
表1 各原代神经细胞培养体系细胞纯度测定结果(%)
2.2 各原代神经细胞培养体系细胞死亡率检测(见图2,见表2)
各原代神经细胞培养体系分别随机分为对照组、放射损伤组、放射损伤+依达拉奉组以后进行相应处理,随后利用细胞存活/死亡荧光分析试剂盒对比检测细胞死亡率。如图2所示,红色荧光显示为死亡细胞核,而绿色荧光显示为正常存活细胞胞体。各培养体系对照组细胞死亡率均不超过20%。体系内比较,共培养体系经过放射线照射后,细胞死亡率升高达到32.0%±4.0%。经过依达拉奉干预治疗后,细胞死亡率迅速恢复至17.0%±1.8%,达到正常水平,放射损伤组与其它两组比较差异均有统计学意义(P<0.05);单纯神经元的放射性损伤甚为明显,细胞死亡率明显升高至68.0%±5.2%。依达拉奉干预治疗效果依旧明显,细胞死亡率恢复至25.0%± 3.6%,基本达到正常水平。放射损伤组与其它两组比较差异均有统计学意义(P<0.05);星形胶质细胞培养体系对放射线损伤不敏感,体系内不同组间细胞死亡率比较无明显差异(P>0.05)。体系间比较,细胞种植密度相同情况下,射线照射以后神经元培养体系细胞死亡率明显高于共培养体系及星形胶质细胞培养体系,差异均具有统计学意义(P<0.05),表明神经元培养体系对放射性损伤最为敏感。依达拉奉干预治疗后各培养体系间细胞死亡率已无统计学差异,表明依达拉奉治疗收到了良好效果。
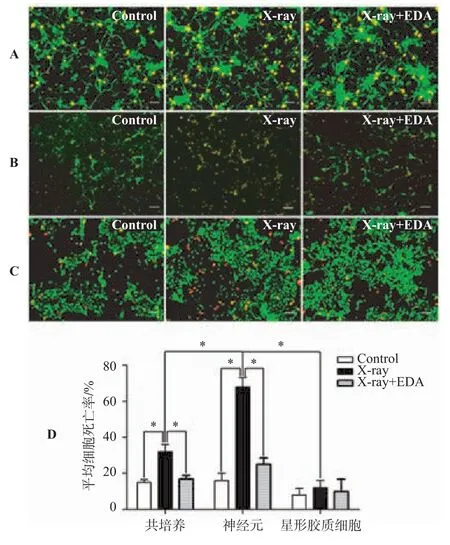
图2 各原代神经细胞培养体系细胞存活/死亡分析试剂盒检测结果(200×)
表2 各原代神经细胞培养体系细胞死亡率测定结果(±s,%)
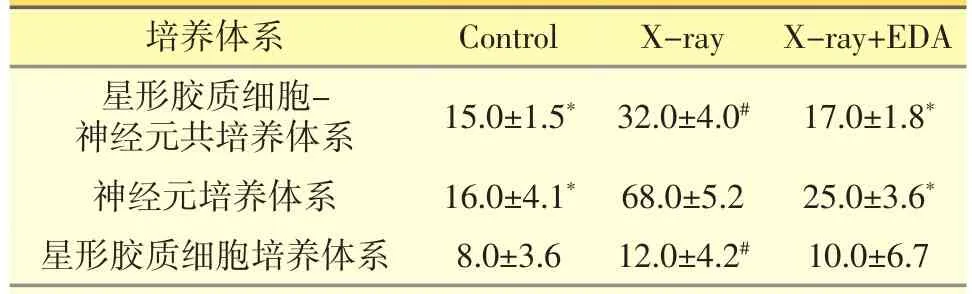
表2 各原代神经细胞培养体系细胞死亡率测定结果(±s,%)
注:*体系内与X-ray组比较,P<0.05;#体系间与神经元培养体系比较,P<0.05。
培养体系Control X-ray X-ray+EDA星形胶质细胞-神经元共培养体系15.0±1.5*32.0±4.0#17.0±1.8*神经元培养体系16.0±4.1*68.0±5.2 25.0±3.6*星形胶质细胞培养体系8.0±3.6 12.0±4.2#10.0±6.7
2.3 神经元培养体系细胞凋亡检测(见图3)
各原代神经细胞培养体系间的细胞存活/死亡荧光分析结果表明,放射线照射致伤的细胞以原代神经元为主,星形胶质细胞对放射线损伤并不敏感。据此,利用NeuN/DAPI免疫荧光双标技术,对比了正常培养及放射性损伤后72 h原代神经元培养体系凋亡情况。结果表明,射线照射以后培养体系中64%的神经元出现凋亡情况,而正常培养状态下凋亡率仅为6%。凋亡神经元在显微镜下显示为蓝色高亮、固缩、不规则形状及碎裂的异常细胞核形态。以上结果也表明,神经元的放射性损伤是以异常凋亡为主要表现的。

图3 原代神经元培养体系凋亡检测结果(400×)
2.4 各原代神经细胞培养体系ROS含量检测(见表3)
表3 各原代神经细胞培养体系细胞ROS含量测定结果(±s)

表3 各原代神经细胞培养体系细胞ROS含量测定结果(±s)
注:*体系内与X-ray组比较,P<0.05;#体系间与神经元培养体系比较,P<0.05。
培养体系Control X-ray X-ray+EDA星形胶质细胞-神经元共培养体系42.6±7.2*79.8±10.4#46.5±8.1*神经元培养体系38.9±10.3* 103.6±8.8 48.3±10.6*星形胶质细胞培养体系40.3±9.6 43.9±5.6#41.5±9.3
各原代神经细胞培养体系的对照组、放射损伤组、放射损伤+依达拉奉组细胞ROS含量变化趋势与细胞死亡率变化趋势相一致。如表3所示,体系内比较,共培养体系及神经元培养体系经过放射线照射后,细胞活性氧含量均有明显升高,依达拉奉干预治疗后恢复至正常水平,体系内放射损伤组与其它两组比较差异均有统计学意义(P<0.05)。星形胶质细胞培养体系经过不同处理后活性氧含量无明显差异(P>0.05)。体系间比较,仅放射性损伤组体系间有统计学差异(P<0.05),神经元培养体系ROS含量高于其它两种培养体系。其余两组细胞体系间无明显差异。
3 讨 论
3.1 放射性脑损伤机制
放射治疗已成为头颈部肿瘤及血管病变的重要治疗手段;但射线造成的放射性脑损伤也成为限制放疗剂量、影响疗效的重要因素[11]。目前放射性脑损伤发病机制主要包括:①血管损伤:主要发生在小血管和中等血管,以动脉为主,血脑屏障因而遭到破坏,最终导致脑缺血性梗死及毛细血管扩张症[12];②胶质损伤:放射性损伤后星形胶质细胞反应性肥大、增生,少突胶质细胞损伤甚为明显,导致神经髓磷脂代谢紊乱、严重者出现凝固坏死和白质空腔形成[13];③自身免疫损伤:照射后神经胶质细胞释放抗原,引起过敏反应,同样导致血管损伤和闭塞,进一步导致损伤区域凝固性坏死和白质广泛脱髓鞘改变;④海马、小脑及皮质的神经干细胞损伤;⑤细胞因子表达异常[14]。
3.2 原代神经细胞培养体系对放射性损伤敏感性及与ROS含量变化关系
本研究重点关注了体外培养状态下,神经元及星形胶质细胞对放射损伤的敏感性差异及与细胞ROS含量变化关系。实验结果表明,单纯神经元对放射性损伤最为敏感,星形胶质细胞-神经元共培养体系敏感性明显降低,单纯星形胶质细胞则对放射损伤不敏感。细胞死亡以神经元凋亡为主要表现形式。细胞ROS含量可以间接反映细胞氧化性损伤程度。检测结果表明,各组细胞ROS含量差异与上述放射性损伤敏感性变化趋势一致,说明氧化应激损伤是细胞放射性损伤的重要原因之一。ROS是一类分子的集合体,生理状况下作为细胞内氧化还原信使,传递调控胞内信号,其生成和清除保持着动态平衡。应激状态将打破这一平衡。具体导致损伤机制涉及多条信号转导通路,包括活化死亡受体通路、线粒体凋亡通路、c-Jun氨基末端激酶(c-Junterminal kinase,JNK)介导的凋亡信号通路以及破坏细胞内谷胱甘肽相关的氧化还原平衡等,最终都将引起细胞凋亡失调[15]。
3.3 共培养体系中星形胶质细胞对神经元的保护作用
本研究结果表明,共培养状态下神经元死亡率较单纯神经元培养有明显降低。这表明共培养体系中星形胶质细胞的存在可能对神经元产生了部分保护作用,从而降低了其对放射线的敏感性。我们推测这一保护作用的机制是星形胶质细胞缓解了射线照射后血管损伤引起的脑能量代谢障碍。研究表明,胶质细胞与神经元之间相互作用贯穿于大脑发育和功能的各个方面,其中首当其冲的就是脑的能量代谢[16]。星形胶质细胞-神经元乳酸穿梭假说(astrocyte-neuron lactate shuttle hypothesis,ANLSH)的提出,赋予了星形胶质细胞应激状态下作为神经元能量来源的角色,这是大脑能量代谢特殊性的具体体现[17],对于维护大脑自稳态至关重要。ANLSH得以实现的主要载体是单羧酸转运体,由此构成了应激状况下星形胶质细胞对神经元内生性保护作用的分子基础[18]。
3.4 依达拉奉对神经元放射性损伤的保护作用
本研究应用依达拉奉对放射损伤后原代神经细胞进行干预治疗,结果表明依达拉奉通过清除细胞内异常增多的ROS,减轻细胞损伤,逆转凋亡失调,有效降低了神经元的死亡率。近年来神经细胞膜代谢研究中发现了自由基的毒害作用,自由基清除剂的神经保护功能由此成为研究热点。依达拉奉是一种新型的自由基清除剂,其神经保护机制如下:①体内的依达拉奉阴离子与自由基的不配对电子配对,使自由基失去作用,阻断了自由基连锁反应[19];②依达拉奉清除羟基基团,抑制黄嘌呤氧化酶和次黄嘌呤氧化酶的活性,刺激前列环素生成,减少白三烯产生,降低羟自由基的浓度[20];③依达拉奉阻断内质网应激相关蛋白的表达,对神经元起到保护作用[21];④依达拉奉提高超氧化物歧化酶活性,减少丙二醛产生,抑制脂质过氧化,减轻细胞氧化损伤[22];⑤依达拉奉调控凋亡相关基因表达而产生凋亡抑制作用[23];⑥依达拉奉抑制皮质神经元线粒体孔的开放而减少细胞色素C的释放,抑制由其触发的凋亡程序[24]。
神经系统放射性损伤是临床放射治疗常见的副损伤之一。如何有效地提高肿瘤对放疗敏感性并尽可能降低副损伤效应是临床治疗中亟待解决的问题。自由基清除剂的应用为临床提供了新的治疗思路。另外,针对本研究中涉及的星形胶质细胞对神经元保护作用的分子机制的深入研究,有助于从机体内源性保护机制方面探寻新的脑保护治疗方案。
[1]尹华锦.放射性脑病的诊治研究现状[J].泸州医学院学报,2010,32(6):658-61.
[2]Kaya M,Palanduz A,Kalayci R,et al.Effects of lipopolysaccharide on the radiation-induced changes in the blood-brain barrier and the astrocytes[J].Brain Res, 2004,1019(1-2):105-12.
[3]李华杰,田 野,包仕尧.神经胶质细胞在早期放射性脑损伤中的变化与作用 [J].中华放射医学与防护杂志,2003,23(4):305-7.
[4]Tian Y,Shi Z,Yang S,et al.Changes in myelin basic protein and demyelination in the rat brain within 3 months of single 2-,10-,or 30-Gy whole-brain radi-ation treatments[J].J Neurosurg,2008,109(5):881-8.
[5]Li TQ,Wong CS.Radiation-induced apoptosis in the neonatal and adult rat spinal cord[J].Radiat Res,2000, 154:268-76.
[6]林曰增.脑放射损伤的影像学研究进展 [J].国外医学·放射医学核医学分册,2000,24(4):148-51.
[7]陈 勇,刘来昱,孙爱民,等.依达拉奉对原代培养大鼠海马神经元放射性损伤的保护作用[J].中华肿瘤防治杂志,2010,17(10):721-7.
[8]刘晓民,徐德生,李彦和,等.大鼠正常脑组织伽玛刀照射后GFAP表达的实验研究 [J].临床神经外科杂志,2007,4(1):35-8.
[9]Crack PJ,Taylor TM.Reactive oxygen species and the modulation of stroke[J].Free Radic Biol Med,2005,38 (11):1433-44.
[10]高 晨,周海燕,荔志云,等.颅眶联合伤后视网膜神经节细胞活性氧含量与凋亡研究 [J].中国微侵袭神经外科杂志,2013,18(10):468-71.
[11]Ku GY,Ilson DH.Esophagogastric cancer:Targeted agents[J].Cancer Treat Rev,2010,36(3):235-48.
[12]Mǜnter MW,Karger CP,Reith W,et al.Delayed vascular injury after single high-dose irradiation in the rat brain:histologic,immunohistochem ical and angiographic stuies[J].Radiology,1999,212(2):475-82.
[13]Valk PE,Dillon WP.Radiation injury of the brain[J]. Am J Roentgend,1991,12(1):45-62.
[14]Belka C,Budach W,Kortmann RD,et al.Radiation induced CNS toxicity-molecular and cellular mecha-nisms[J].Br J Cancer,2001,85:1233-9.
[15]Bonde C,Noraberg J,Noer H,et al.Ionotropic gluta-mate receptors and glutamate transporters are involved in necrotic neuronal cell death induced by oxygenglucose deprivation of hippocampal slice cultures[J]. Neuroscience,2005,136(3):779-94.
[16]Barres BA.What is a glial cell?[J].Glia,2003,43(1): 4-5.
[17]Magistretti PJ.Neuron-glia metabolic coupling and plasticity[J].J Exp Biol,2006,209(Pt 12):2304-11.
[18]Cortes-Campos C,Elizondo R,Llanos P,et al.MCT expression and lactate influx/efflux in tanycytes in-volved in glia-neuron metabolic interaction[J].PLoS One,2011,6(1):e16411.
[19]Tanaka M.Pharmacological and clinical profile of the free radical scavenger edaravone as a neuroprotevtive a-gent[J].Nippon Yakarigaku Zasshi(S),2002,119(5):301-8.
[20]Shichinohe H,Kuroda S,Yasuda H,et al.Neuropro-tective effects of the free radical scavenger Edaravone (MCI-186)in mice permanent focal brain ischemia[J]. Brain Res,2004,1029(2):200-6.
[21]龙 浩,凡 进,陈 琦,等.依达拉奉通过抑制内质网应激途径对谷氨酸刺激神经元损伤的保护作用[J].江苏医药,2013,39(12):1374-6.
[22]蒋 杰,陈亦江,陈 亮,等.依达拉奉对心脏瓣膜置换术患者脑损伤的影响[J].南京医科大学学报(自然科学版),2006,26(7):570-3.
[23]Roh MI,Murakami Y,Thanos A,et al.Edaravone,an ROS scavenger,ameliorates photoreceptor cell death after experimental retinal detachment[J].Invest Oph-thalmol Vis Sci,2011,52(6):3825-31.
[24]薛 晶,韩 冬,邓 方,等.依达拉奉对脑缺血再灌注损伤保护作用机制的研究 [J].中风与神经疾病杂,2009,26(1):18-20.
Relationship between the Radiation Injury Sensitivity and the ROS Content in Rat Primary Neural Cell Cultures and the Neuroprotective Effects of Edaravone
GAO Chen1,TIAN Li-zhuang2,ZHU Wen-xia3,LIU Yu-hu1,WU Xin-du1,ZHAO Yu1,ZHAO Fu-gui1
1Department of Neurosurgery,AnNing Branch Hospital;2Department of Neurosurgery;3Department of Trau-matology,AnNing Branch Hospital,Lanzhou General Hospital of Lanzhou Military Command,Lanzhou,Gan-su 730070,China
Objective:To study the relationship between the radiation injury sensitivity and the reactive oxygen species (ROS)content in rat primary neural cell cultures and the neuroprotective effects of edaravone.Methods:A single-dose x-ray exposure protocol was used in primary cultures of neurons, astrocytes,and astrocytes-neurons derived from rat hippocampus,with or without edaravone treatment.Cell death,apoptosis and the content of ROS were evaluated.Results:X-ray resulted in significantly raised cell death rate and ROS content in the neuronal cultures.However,the cells injury was lighter in the astrocyte-neuron co-cultures and not significant in the astrocyte cultures.Edaravone inhibits the cell death by eliminating ROS.Conclusion:The content of ROS in neuronal cultures increased significantly after the radiation injury,resulted in apoptosis imbalance of neurons.Edaravone prevents this pathological process by eliminating ROS and thus has a protective effect on neurons,the drug is worth clinical promotion.
Co-culture;Radiation injury;Reactive oxygen species;Edaravone;Neuroprotection
R964
A
1673-7806(2015)03-211-06
高晨,男,主治医师,外科学博士,主要研究方向:颅脑损伤规范化诊疗 E-mail:gc2006418@163.com
2014-12-02
2015-03-10
