SPR技术检测血小板抗体及其临床应用的研究*
2015-03-05伍昌林周雪敏何建安顾大勇邵超鹏
伍昌林,周雪敏,何建安,顾大勇,朱 奕,邵超鹏
(1.广东省深圳市第二人民医院输血科 518035;2.广东省深圳市福田区慢病防治院 518048;3.广东省深圳市检验检疫局保健中心 518045)
输注血小板可预防和治疗血小板减少或血小板功能缺陷引起的出血,但患者多次输血后,易产生血小板相关抗体,导致血小板输注无效(PTR)[1]。目前,检测血小板抗体与交叉配合试验主要是固相法、MAIPA 法和FCM 法等,这些方法或者试剂昂贵,成本较高,增加了患者的负担;或者检测时间较长,步骤较多,对结果可靠性产生一定影响[2],同时该方法指示红细胞的保存期短,易造成试剂浪费等。表面等离子体共振(surface plasmon resonance,SPR)技术是应用非标记光学生物传感器技术,不需要对被测物进行标记使其可以测量生物活性分子的反应动力学,适用于高通量生物活性分子特别是小分子的筛选,微量未知物的分析,以及在线样品检测,具有高灵敏度、高通量、非标记、样品和试剂耗量小等优点[3-6]。因此,作者研究基于SPR 的非标记技术在血小板抗体筛选与配型中的初步应用,并以经典的参考法单克隆抗体特异性血小板抗原固定术(MAIPA)进行对比分析。
1 资料与方法
1.1 一般资料 2012年5月至2013年4月在深圳市第二人民医院多次输注血小板的患者106例[至少2次输注血小板,其中,特发性血小板减少性紫癜(idiopathic thrombocytopenic purpura,ITP)患者34例,白血病患者46例,骨髓增生异常综合征(MDS)8例,其他病例18例],其中,男55例,女51例,年龄8~63岁,中位年龄34.5岁。患者血小板计数均小于20×109/L或大于20×109/L 且小于100×109/L,但有明显出血倾向。
1.2 标本采集处理与血小板计数 分别在血小板输注前和输注后1、24h采集患者外周静脉血2 mL,进行血小板计数,并计算血小板增加值(corrected count index,CCI)。CCI=输注后血小板增加值×体表面积(m2)/输入血小板总数,体表面积=0.006 1×身高(cm)+0.012 8×体质量(kg)-0.015 29。以1hCCI>7.5或24hCCI>4.5为有效,否则为输注无效。供者的单采血小板由血液中心提供,每袋容量约200 mL 左右,含血小板大于或等于2.5×1011/袋。
1.3 主要仪器与试剂 SPR 分析仪(美国GWC 公司,SPRimager®Ⅱ型),MAIPA 试剂盒(美国,Immucor公司),BYL 型离心机(长春博研公司),SPR 检测芯片(批号20130124,广州高通生物技术有限公司)。通用型O 型血小板冻干粉(批号20120923)、血小板抗体阳性血清(批号20120916,阳性对照)购自长春博德公司。芯片活化液EDC/NHS:1-乙基-3-(3-二甲基氨丙基)-碳化二亚胺(EDC,0.4mol/L)和N-羟基琥珀酰亚胺(NHS,0.1mol/L)、pH=7.4的缓冲液PBS(流动相)及再生液甘氨酸(10 mmol/L,pH =2.0),封闭液乙醇胺(1mmol/L,pH=8.5),健康人AB型血清(阴性对照)、非特异性蛋白NS1对照血清由本室提供。
1.4 SPR 技术检测血小板抗体条件摸索与方法建立
1.4.1 血小板在SPR 芯片表面固定的影响因素 影响SPR芯片表面血小板固定的因素:主要是离子强度,溶液的pH 值及蛋白抗原的浓度等。本研究是在一定的离子强度下,将血小板抗原进行倍比稀释后,分别点样芯片,根据不浪费样品,又能保证达到一定的固定量的原则,确定血小板抗原的稀释度。本研究选用不同pH 值(分别为4.0、4.5、5.0、5.5、6.0)的10 mmol/L醋酸盐缓冲溶液作为血小板的固定液,探索pH 值对血小板抗原固定的影响,确定最佳pH 值。
1.4.2 血小板在SPR 芯片表面固定的方法 血小板抗原的固定:根据前期条件探索,采用氨基耦联法在SPR 传感芯片表面固定相应的通用型血小板抗原,检测相应的血小板抗体。具体的方法:(1)SPR 芯片活化:先室温下分别溶解0.393 9g EDC(0.4mmol/L)和0.430g NHS(0.1mmol/L),配制成10 mL EDC/NHS 活化液,将SPR 芯片置于活化液中活化30 min,流水冲洗;(2)血小板抗原点样:用pH 值为6.0 的10 mmol/L乙酸盐与甘油配制10%的甘油点样液,将通用型血小板抗原用点样液作5倍稀释处理后,取0.5μL 混合液点样于芯片表面相应的位置,室温下固定1h;(3)芯片表面封闭:将点样好的SPR 芯片,固定后,安装在SPR 分析仪上,用PBS液调选最佳共振角(由最小角至最大角调试,再确定最佳的共振角约为70~100 之间),基线平稳后,用封闭液乙醇胺处理10 min,封闭芯片未反应的活化表面。完成后用再生液处理,去除物理吸附的物质和封闭液,然后可上样检测。
1.4.3 芯片表面的再生试剂与再生效果 进行抗原抗体反应试验时,先将待检血清用PBS溶液稀释后,注入芯片上,每测一个样本后,用再生液再生芯片,然后进行下一次测定,结果用BIAevaluation软件分析。芯片的表面再生原理是利用一定浓度的酸、碱或者是高离子强度的溶液脉冲来洗脱抗原与抗体间的结合,从而达到传感芯片的再生。关于采用再生试剂中本研究尝试采用了10 mmol/L NaOH,1∶300稀释的磷酸、pH=2.0的甘氨酸作为再生试剂,确定最佳的再生试剂类型。
1.4.4 血小板抗原与抗体之间的结合及性能分析 (1)SPR技术性能分析:运用上述探索的条件及固定的SPR 芯片,将阳性对照血清、阴性对照血清、患者样本等作相应的检测,分析SPR 技术的稳定性、敏感度、特异性,SPR 分析仪检测的数据运用BIAevaluation软件分析;(2)对比研究:运用SPR 技术与MAIPA 法(具体操作按产品说明书进行)同时对106 例多次输注血小板的患者进行血小板抗体筛选,比较2种方法的差异性,并分析它们的性能。
1.5 SPR 芯片技术在抗体筛选与配型中的初步应用 对患者采用SPR 技术作配合性试验,选择配合型血小板输注,并跟踪分析临床疗效。具体检测方法:将已知的O 型通用血小板(抗原)固定在芯片上,检测患者血清中是否有相关抗体;同样将血液中心供应的机采血小板洗涤后稀释,取微量(0.5μL)点样于芯片上,检测血小板抗体阳性患者的血清是否存在SPR信号的改变,若无信号改变,说明它们是配型相合,否则为配型不相合。运用该技术对10例血小板抗体阳性患者选择配合的血小板进行输注,并进行临床跟踪分析,研究患者临床血小板输注的有效性。
1.6 统计学处理 采用SPSS 16.0软件进行分析处理,计数资料比较用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 血小板固定浓度的条件摸索结果 采用乙酸缓冲溶液稀释血小板,分别稀释5、10、20、50、100倍。结果表明随着点样的浓度增加检测分析物(含血小板抗体血清)信号值增加,稀释到10 倍后,点样物的浓度对检测信号影响不明显(图1),因此,后续的实验中,确定点样的血小板浓度均采用10 倍稀释度。
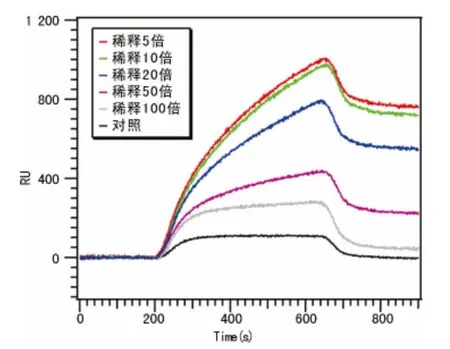
图1 血小板固定浓度的条件优化结果
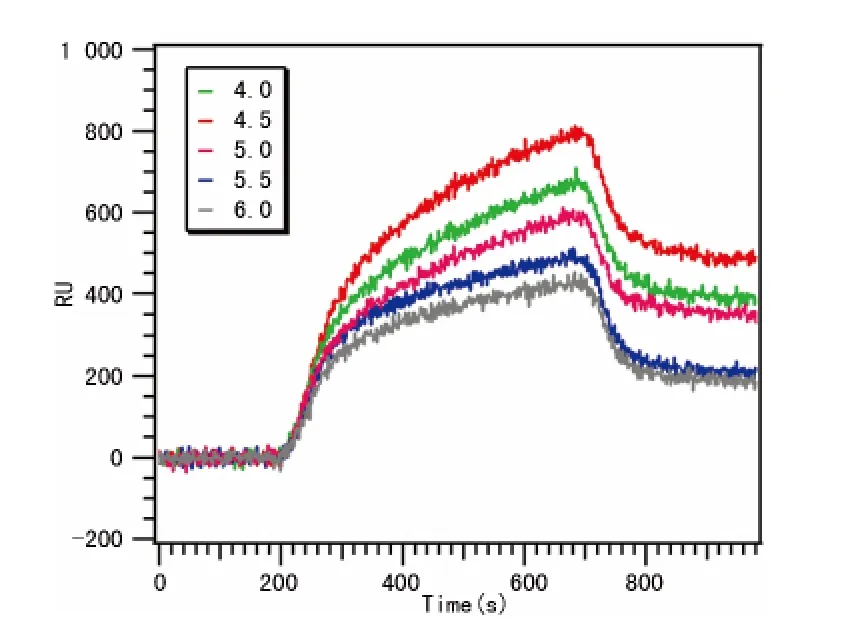
图2 点样液pH 值的条件优化结果
2.2 点样液pH 值的条件摸索结果 分别采用系列pH 值(分别为4.0、4.5、5.0、5.5、6.0)的乙酸缓冲溶液作为点样液稀释血小板。通入分析物(含血小板抗体血清)结果表明在pH=4.5的乙酸缓冲溶液时具有较强的检测信号(图2)。因此,在后续的实验中均采用pH=4.5的乙酸缓冲溶液作为点样液固定血小板。
2.3 SPR 芯片检测血小板抗体的再生试剂与再生效果 在NaOH 的缓冲溶液中,高分子链部分水解,导致基线往下漂移,而采用1∶300稀释的磷酸基线没有回到原始基线水平即再生彻底。在采用pH=2.0的甘氨酸再生后基线基本回到初始值水平,而且再生后探针仍然保持较高的生物活性。故本文采用了pH=2.0的甘氨酸作为再生试剂。在SPR 芯片上将试剂血小板抗原(包括较多的血小板抗原位点)点样于不同的位置,进行阳性对照血清的检测分析后,再用pH=2.0的甘氨酸作为再生试剂,重复3次检测,每次检测信号均可回到基线,结果良好(图3)。
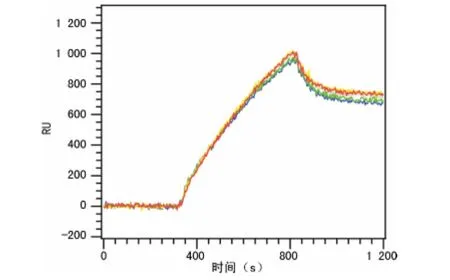
图3 SPR 芯片检测阳性血清后的再生效果(n=3)
2.4 SPR 芯片分析血小板抗体阳性血清的检测限 在同一张芯片上点样试剂血小板抗原,并选择相应的7个区域,其中,1个为空白对照点,另外6个为样本检测点,分别取标准对照阳性血清5、10、20、30、40、60μL,对应的浓度分别为50、100、200、300、400、600ng/mL;以2μL/s的流速进样检测,由BIAevaluation分析软件处理,去除空白对照值后作图如下,对应的RU 值如a、b、c、d、e、f曲线所示,具有较好的灵敏度,最低检测限为50ng/mL左右(图4)。
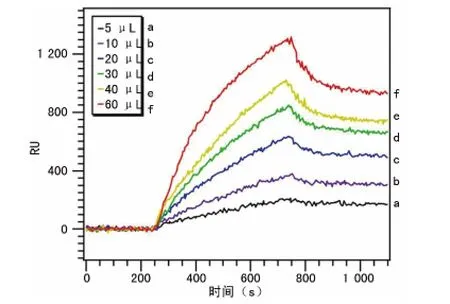
图4 SPR 芯片检测不同浓度的血小板抗体阳性血清的结果
2.5 SPR 芯片的特异性响应结果 在同一张芯片上点样试剂血小板抗原与非特异性NS1抗原,其中,1个点样为空白对照点,其余各点为样本检测点,将此点样好的芯片在SPR 仪上分别检测血小板抗体阳性对照血清与NS1 抗体阳性对照血清,检测血小板抗体阳性对照血清与NS1抗体阳性对照血清时,该芯片特异性较好(图5)。本研究表明SPR 芯片能特异检测血小板抗体(图5)。
2.6 SPR 芯片技术与MAIPA 法筛选血小板抗体对比分析 对106例临床多次输注血小板的患者血清,分别用SPR 芯片技术和MAIPA 法检测,结果见表1;经χ2检验,χ2=0.333,P=0.564,2种方法比较差异无统计学意义。SPR 法的灵敏度为91%,特异性为97.9%,总一致性为97.2%(表1)。
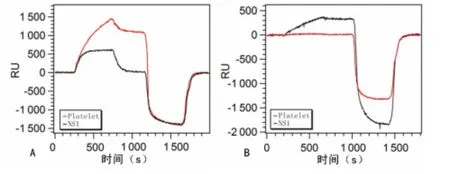
图5 SPR 芯片检测2种不同阳性对照血清的信号结果
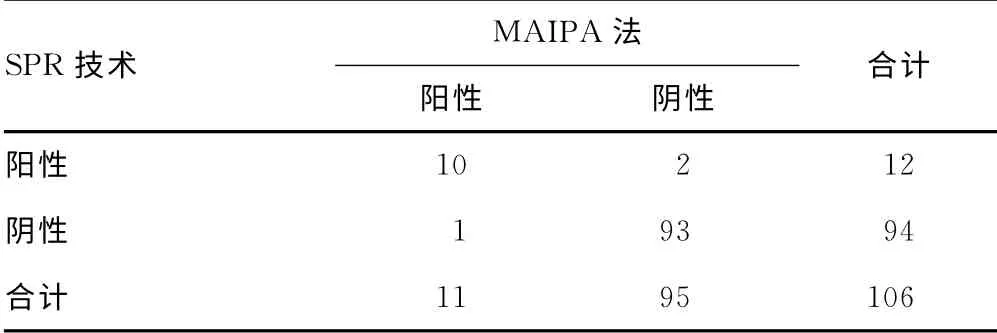
表1 2种血小板抗体检测方法的结果比较(n=106,n)
2.7 SPR 芯片技术检测血小板抗体的初步应用 将A、B、O同型的供者血小板样本,经洗涤后稀释,按照上述血小板点样的条件与方法,点样于SPR 芯片上,然后根据前面的检测方法,分析患者的血清样本与供者机采血小板的相容性。本研究对SPR 技术检测的其中10例血小板抗体阳性患者,进行交叉配合试验,从多位血小板供者中选择配合型血小板输注,经过临床随访分析,其中,8例患者1h血小板增加值CCI>7.5,24hCCI>4.5,为输注有效,并且患者状态良好,另外2例因有其他基础疾病。说明SPR 技术可初步应用于临床血小板的抗体筛选与配型(图6)。
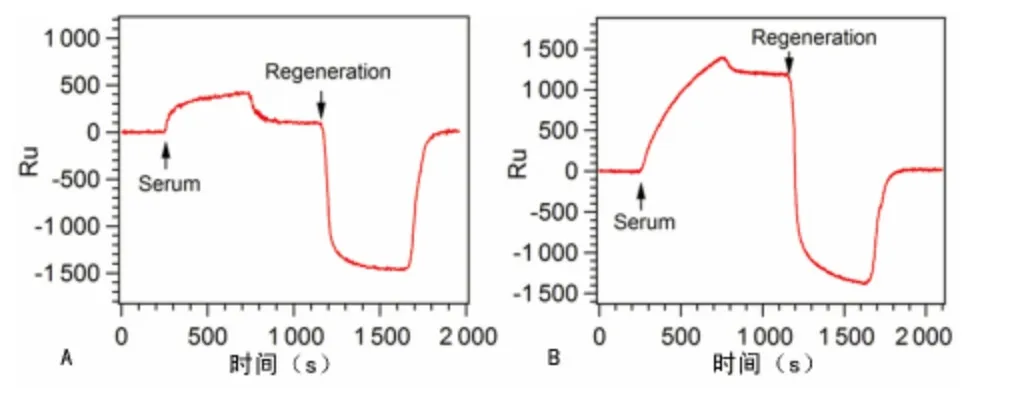
图6 供者血小板与患者血清交叉配合试验结果
3 讨 论
如何有效输注血小板,提高临床疗效是研究的热点课题。由于建立已知HLA 和HPA 基因位点的供者库,规模大,费用昂贵,耗时长,暂时无法全面实施,因此,选择供受者相同的HLA、HPA 的血小板进行输注目前难以实施。如果直接通过配合试验选择与受者相合的血小板,需要一种简便适用的检测方法[7-8]。目前,国内外临床上检测血小板抗体与配型的方法主要是固相凝集法、酶标法、荧光法等,虽然这些方法可检测血小板抗体,并可进行血小板配型。但是,该方法也存在较多的问题,需要改进或开发新的检测方法[9-11]。目前,临床上常用MAIPA 法、固相凝集法等,但有一定的缺陷,该方法指示红细胞的保存期短,易造成试剂浪费;检测的步骤多,影响因素较多,如ELISA 法,易出现假阴性或假阳性;该方法进行临床检测时需要较多混合的O 型血小板,但血小板表面抗原的复杂性,抗原谱不明确,易造成抗体的漏检。因此,需要进一步改进研究或采用新的检测方法。
SPR 技术不需要对被测物进行标记的优点使其可以测量生物分子在无修饰条件下的反应动力学[12]。因此,SPR 技术适用于高通量生物分子的直接筛选与在线样品检测。作者将SPR 技术引入血小板抗体的检测与配型的研究上,取得了较好的预期成果,充分体现了SPR 技术快速、非标记、高通量、高灵敏度的特点[9]。经初步研究发现,SPR 技术检测血小板抗体的稳定性、灵敏度与特异性均较好,同时与MAIPA 法检测血小板抗体的结果进行了对比研究,它们阳性与阴性结果的一致性均在95%以上,总有效率也是95%以上。本研究运用SPR技术配型的血小板输注给10例抗体阳性的患者,经临床随访分析效果良好,其中,8例患者1h血小板增加值CCI>7.5,24hCCI>4.5,另外2例患者因有其他疾病,影响了血小板输注的有效率。
SPR技术不需指示细胞,克服了MAIPA 法等指示细胞保存期短的问题,另外MAIPA 法操作步骤多、时间长、易出现假阳性等;SPR 技术可批量点样,大量检测,速度更快;直接检测时,无需标记与指示,影响因素少,结果更稳定。此外,SPR 技术成熟后,运用机器点样,一张芯片将检测更多样本,同时能再生处理,多次重复使用,检测的经济成本将更低。
但是,SPR 技术使用的血小板谱抗原作为点样抗原,抗原谱的复杂性,可能存在抗原谱不全面,可能会出现血小板稀有抗体漏检的问题。随着基因组学与蛋白组学的发展,血小板抗原的全面检测,该问题将会解决;此外SPR 技术的自动化点样、检测与分析的研发也有待加强。作者相信SPR 技术成熟后,临床应用将更加简便,直接筛查血小板抗体、通过配合试验选择与受血者相合的血小板显得更加容易[13-15],该技术将应用于临床日常检测工作中。
[1] Hatakeyama N,Hori T,Yamamoto M,et al.Platelet transfusion refractoriness attributable to HLA antibodies produced by donor-derived cells after allogeneic bone marrow transplantation from one HLA-antigen-mismatched mother[J].Pediatr Transplant,2011,15(8):E177-182.
[2] Giannoli C,Nguyen TK,Dubois V.HLA and transfusion:new approaches with LuminexTMtechnology[J].Transfus Clin Biol,2011,18(2):218-223.
[3] 刘儒平,王程,徐万帮,等.基于生物素-亲和素放大的SPR 传感器检测大肠杆菌研究[J].传感技术学报,2013,26(6):522-524.
[4] Dudak FC,Boyaci IH.Rapid and label-free bacteria detection by surface plasmon resonance(SPR)biosensors[J].Biotechnol J,2009,4(7):1003-1011.
[5] 李莹,顾大勇,钟金钢,等.基于表面等离子体共振的基因芯片制备与检测[J].生物医学工程学杂志,2009,26(3):653-656.
[6] He JN,Zhao F,Wu CL,et al.Development of a smart dynamic surface chemistry for surface plasmon resonancebased sensors for the detection of DNA molecules[J].J Mater Chem B,2013,1(40):5398-5402.
[7] Leroux D,Canépa S,Viskov C,et al.Binding of heparindependent antibodies to PF4 modified by enoxaparin oligosaccharides:evaluation by surface plasmon resonance and serotonin release assay[J].J Thromb Haemost,2012,10(3):430-436.
[8] Imoto S,Kawamura K,Tokumine Y,et al.Acute non-hemolytic transfusion reactions and HLA class I antibody:advantages of solid phase assay compared with conventional complement-dependent assay[J].Transfus Med,2010,20(2):95-103.
[9] 徐长根.微柱凝胶法检测血小板抗体[J].临床检验杂志,2002,20(5):272.
[10] Bub CB,Martinelli BM,Avelino TM,et al.Platelet antibody detection by flow cytometry:an effective method to evaluate and give transfusional support in platelet refractoriness[J].Rev Bras Hematol Hemoter,2013,35(4):252-255.
[11] Nguyen XD,Goebel M,Schober M,et al.The detection of platelet antibodies by simultaneous analysis of specific platelet antibodies and the monoclonal antibody-specific immobilization of platelet antigens:an interlaboratory comparison[J].Transfusion,2010,50(7):1429-1434.
[12] Bakchoul T,Kubiak S,Krautwurst A,et al.Low-avidity anti-HPA-1aalloantibodies are capable of antigen-positive platelet destruction in the NOD/SCID mouse model of alloimmune thrombocytopenia[J].Transfusion,2011,51(11):2455-2461.
[13] Socher I,Andrei-Selmer C,Bein G,et al.Low-avidity HPA-1aalloantibodies in severe neonatal alloimmune thrombocytopenia are detectable with surface plasmon resonance technology[J].Transfusion,2009,49(5):943-952.
[14] Rodius S,Chaloin O,Moes M,et al.The talin rod IBS2alpha-helix interacts with theβ3integrin cytoplasmic tail membrane-proximal helix by establishing charge complementary salt bridges[J].J Biol Chem,2008,283(35):24212-24223.
[15] Hayashi T,Amakishi E,Matsuyama N,et al.Detection of anti-human platelet antibodies against integrinα2β1using cell lines[J].Blood Transfus,2014,12(Suppl 1):S273-280.
