非小细胞肺癌EGFR基因突变与ERCC1、TYMS mRNA表达相关性的研究*
2015-03-05谭群友王如文陶绍霖康珀铭周景海
张 全,谭群友,王如文,陶绍霖,康珀铭,邓 波,周景海,李 坤,钱 凯,蒋 彬
(第三军医大学大坪医院野战外科研究所胸外科,重庆400042)
肺癌是最常见的恶性肿瘤,肺癌病理类型中非小细胞肺癌(NSCLC)占75%~80%[1]。ⅠB~ⅢA 期的NSCLC 以手术治疗为主,并在术后根据肿瘤分期进行辅助化疗[2]。但部分NSCLC根治性切除后的辅助化疗效果欠佳。近年来,临床上开展的分子靶标检查能够判别患者个体差异,为NSCLC 的化疗和靶向治疗的药物选择提供科学指导,在NSCLC 治疗中的作用越来越受到重视。
IPASS研究发现表皮生长因子受体(EGFR)突变患者使用铂类化疗效果比野生型患者好[3]。台湾大学Wu等[4]发现EGFR 突变患者使用培美曲塞化疗相对于野生型患者有更高的有效率。目前认为,核苷酸切除修复交叉互补基因1(ERCC1)和胸苷酸合成酶(TYMS)分别是铂类和培美曲塞化疗的作用靶点,那么,EGFR 突变是否与ERCC1 和TYMS mRNA 具有相关性呢?本研究将对此进行探讨。
1 资料与方法
1.1 一般资料 选择2013年2~12月本科室收治的ⅠB~ⅢA 期的NSCLC患者97 例。其中,腺癌60例(61.8%),鳞癌29例(29.8%),其他8例,包括腺鳞癌6例、大细胞癌2例;男67例,女30例;年龄33~82岁;有吸烟史55例(56.7%),无吸烟史42例(43.3%)。
1.2 方法
1.2.1 标本采集 组织标本来自手术中切取或经皮肺穿刺获得的肿瘤组织,并经病理检查确诊。标本用10%甲醛固定后,由广州益善生物公司检测中心检测分析。
1.2.2 基因突变检测 使用SurPleRx-xTAG70plex液相芯片技术进行EGFR(E18、E19、E20、E21)基因突变检测。主要步骤:从固定样本中提取DNA;进行多重PCR 扩增;使用EXO-SAP对PCR 反应产物进行消化处理;进行等位基因特异引物延伸反应;将扩增产物与交联特异探针微球进行杂交反应;再将杂交后产物放入Luminex仪,读取数据[5]。
1.2.3 mRNA 表达水平检测 ERCC1、TYMS mRNA 表达使用分支DNA-液相芯片方法定量检测。分支DNA 液相芯片技术是省略RNA 抽取、逆转录和纯化等步骤,完成对mRNA表达水平的检测。在对样本裂解后,经过微球捕获,探针的多位点配对、级联增大的方法完成信号的放大,使用液相芯片对结果进行读数。
1.3 结果判定标准
1.3.1 EGFR 基因突变结果判定 首先,对液相芯片各突变型位点Cut-Off值进行确定,然后对样本检测每一突变型磁珠荧光值与Cut-Off值进行比较,进而判定检测样本的阴(阳)性。当检测样本的所有突变型磁珠荧光值均大于Cut-Off值,判断该样本为突变阳性;相反,则判断为阴性[6]。
1.3.2 ERCC1、TYMS mRNA 表达结果判定 检测结果以高、中、低表示,表达水平大于或等于75%为高表达,70%~<75%为中偏高表达,40%~<70%为中表达,25%~<40%为中偏低表达,小于25%为低表达。各mRNA 基因表达水平的高低,反映化疗耐药的高低,表达水平越低,化疗的药物敏感性越高。因此,根据基因检测结果,把mRNA 表达水平的高表达、中偏高表达及中表达记为ERCC1(+)、TYMS(+),低或中偏低表达记为ERCC1(-)、TYMS(-)。
1.4 统计学处理 采用SPSS 13.0软件进行分析处理,EGFR 突变情况采用描述性统计分析方法,EGFR 突变与ERCC1、TYMS mRNA 表达相关性分析采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 EGFR 基因突变情况 在97例检测样本中,发现EGFR基因突变29例,突变率为30%。其中,大部分集中在21号外显子 的 点突 变(48.3%,14/29)和19 号 外 显 子 的 缺 失 突 变(37.9%,11/29);其余为18号外显子突变2例(6.8%,2/29),20号外显子突变2例(6.8%,2/29),18号外显子与20号外显子共同突变1例(3.4%,1/29)。EGFR 基因突变检出率方面,女性(70.0%,21/30)显著高于男性(11.9%,8/67),P<0.05;腺癌(48.3%,29/60)显 著 高 于 非 腺 癌(0.0%,0/37),P<0.05;无吸烟史患者(52.3%,22/42)突变率显著高于有吸烟史患者(12.7%,7/55),P<0.05。在肿瘤分期和年龄方面比较差异无统计学意义(P>0.05),见表1。
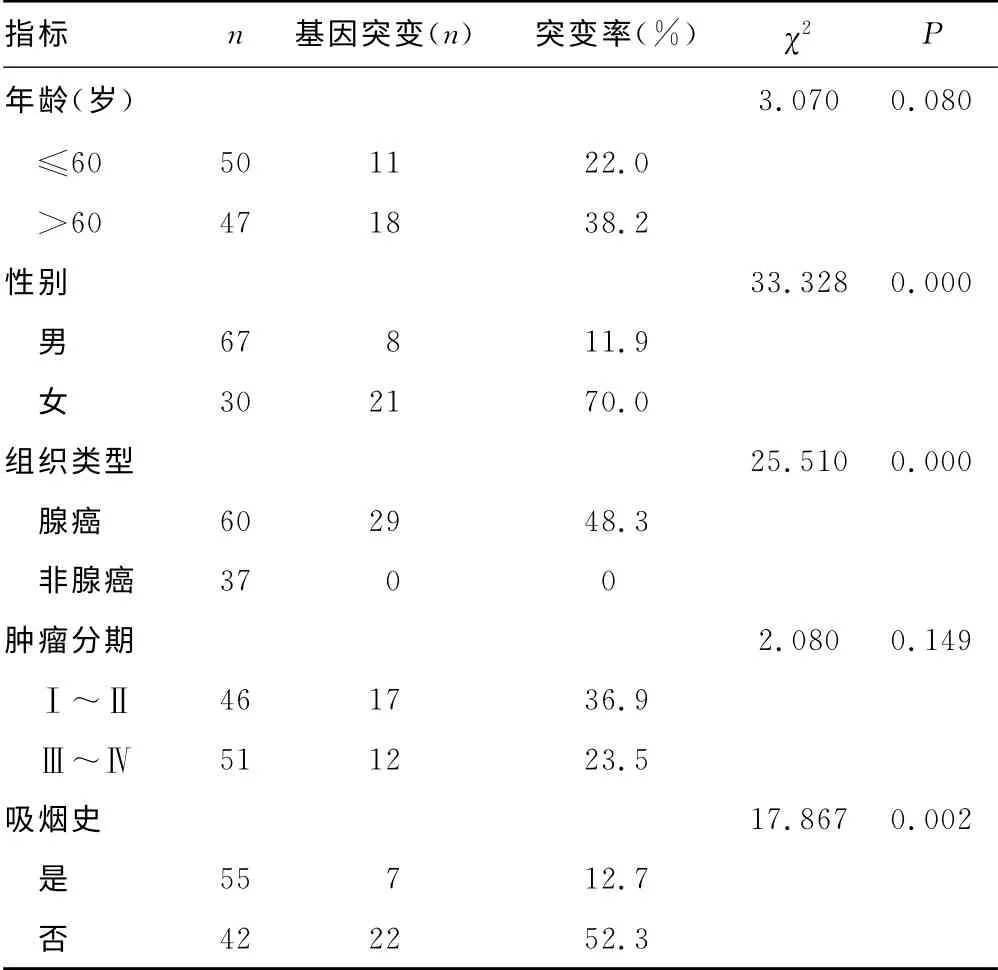
表1 EGFR 基因突变与临床特征之间的关系
2.2 EGFR 突变与ERCC1mRNA 表达的关系 29例EGFR突变病例中,ERCC1阴性表达率62.1%(18/29),阳性表达率37.9%(11/29);68例EGFR 野生型病例中,ERCC1阴性表达率39.7%(27/68),阳性表达率60.2%(41/68)。EGFR 突变与ERCC1表达有相关性(χ2=4.088,P<0.05),见表2。ERCC1基因表达与患者各临床特征间无显著相关性,见表3。
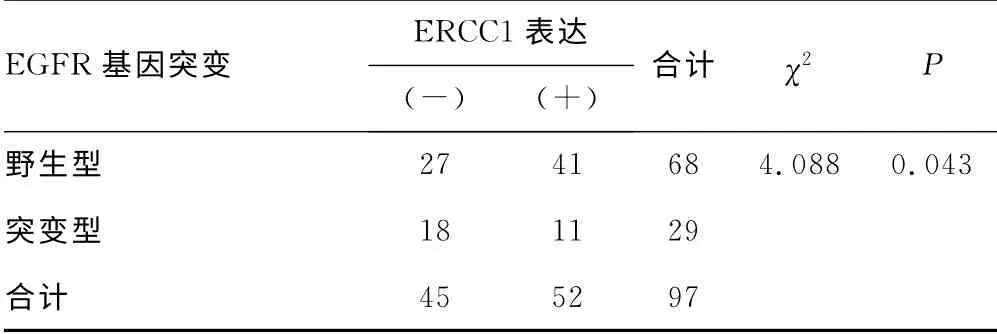
表2 EGFR 基因突变与ERCC1mRNA 表达 水平的关系(n)
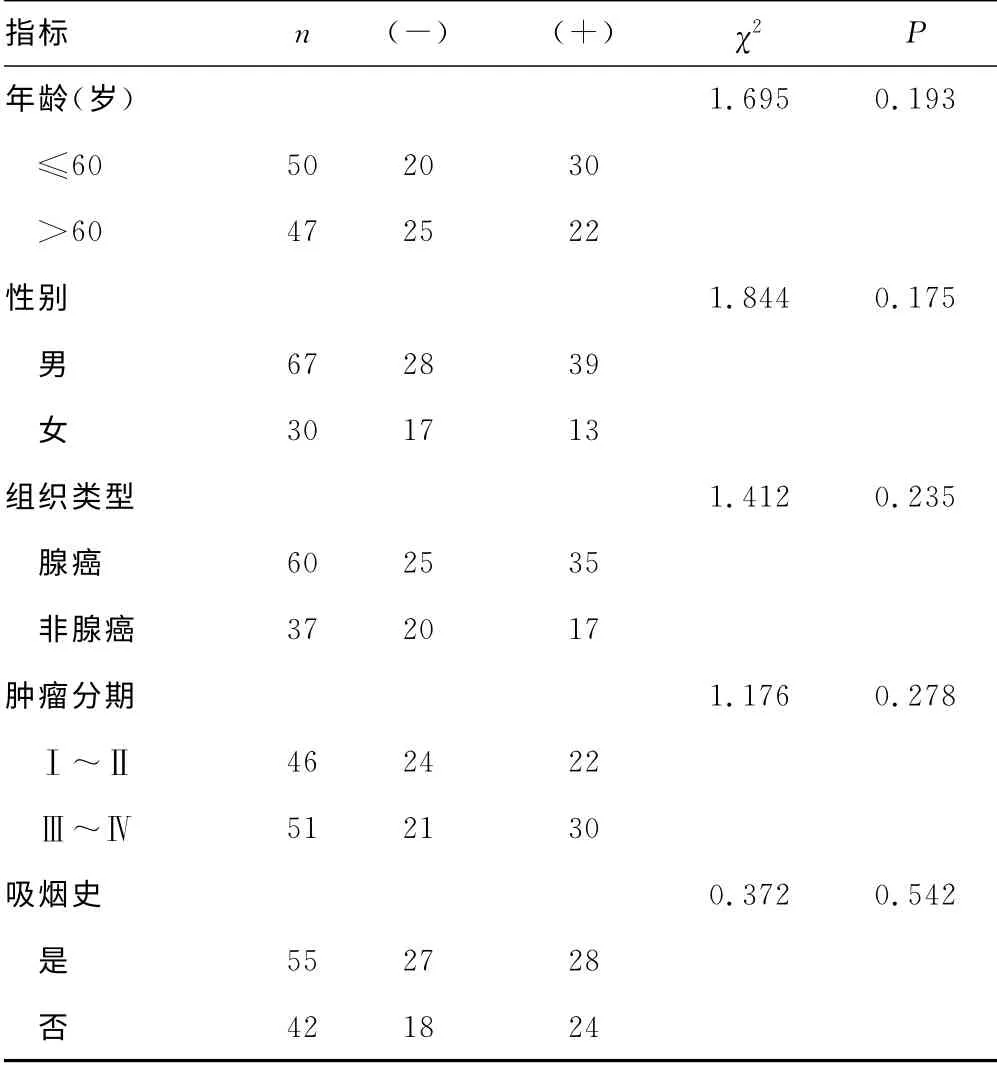
表3 ERCC1mRNA 表达情况与临床特征间的关系(n)
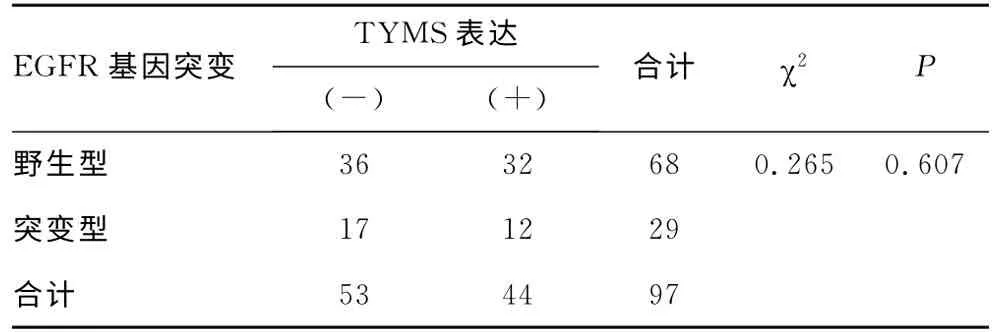
表4 EGFR 基因突变与TYMS mRNA 表达 水平的关系(n)
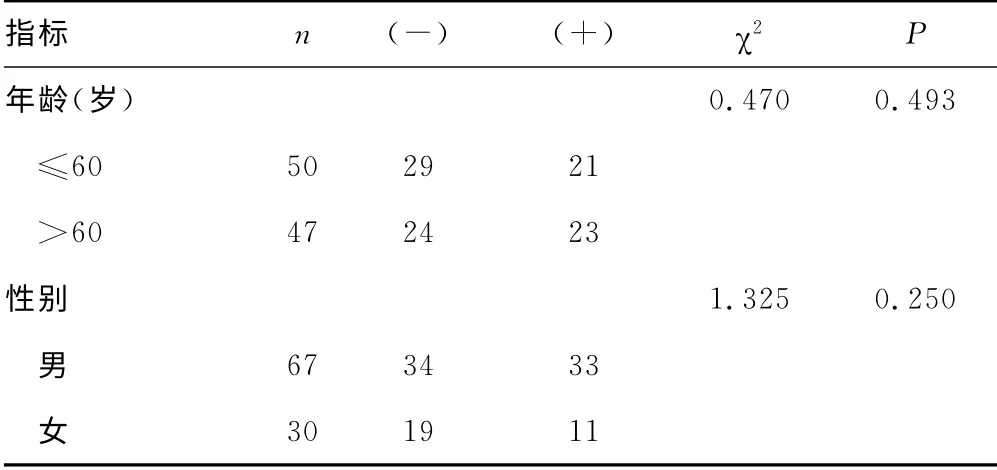
表5 TYMS mRNA 表达情况与临床特征间的关系(n)
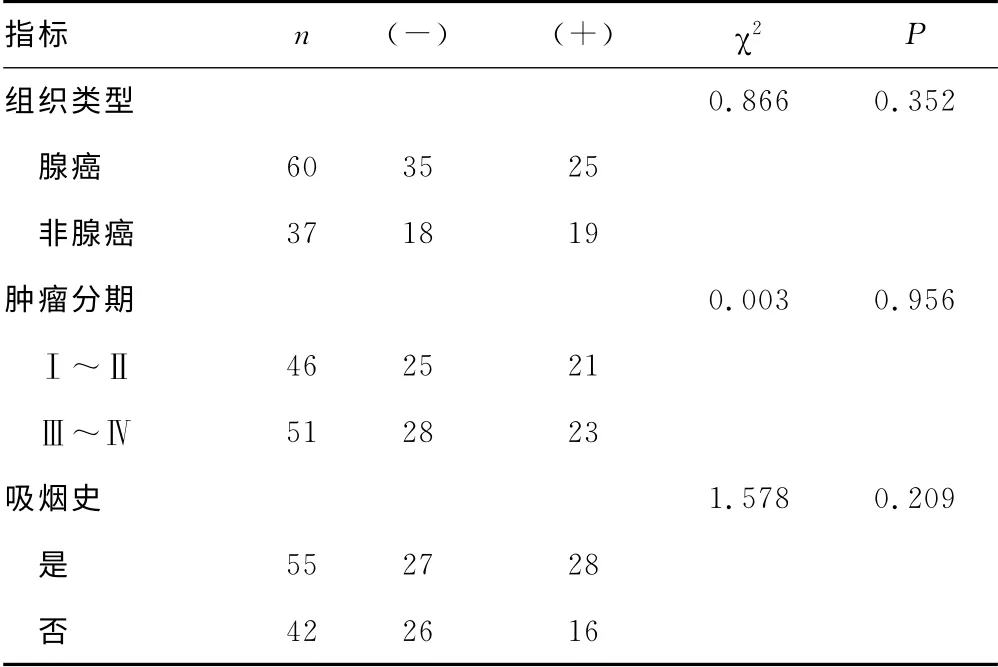
续表5 TYMS mRNA 表达情况与临床特征间的关系(n)
2.3 EGFR 突变与TYMS mRNA 表达的关系 29例EGFR突变病例中,TYMS阴性表达率58.6%(17/29),阳性表达率41.3%(12/29),68例EGFR 突变阴性病例中,TYMS阴性表达率52.9%(36/68),阳性表达率47.1%(32/68)。EGFR 突变与TYMS表达无明显相关性(χ2=0.265,P>0.05),见表4。TYMS mRNA 表达与患者各临床特征间无显著相关性(P>0.05),见表5。
3 讨 论
近年来,随着肿瘤分子生物学和分子遗传学的不断发展,分子靶标基因检测在NSCLC 个体化治疗中的作用越来越受到重视。依托靶标检查进行的肺癌个体化治疗,是通过检查肺癌患者携带的药物疗效相关的靶标基因,按照患者个体的基因检测结果,为肺癌患者制订最佳的治疗方案,从而避免传统治疗的盲目性。本研究通过检查EGFR 突变与ERCC1 和TYMS在NSCLC 患者肿瘤组织中的mRNA 表达水平,并分析其间的相关性,为NSCLC的个体化治疗提供新的思路。
研究显示,靶向治疗只对EGFR 基因突变的患者有效,而对EGFR 基因野生型基本无效,因此,NSCLC 靶向治疗前检测EGFR 基因突变就显得尤为重要[7]。本研究结果显示,EGFR 基因突变率为30%,主要为21号外显子的点突变和19号外显子的缺失,在女性、无吸烟史、腺癌患者EGFR 突变检出率远高于男性、有吸烟史、鳞癌的患者,与IPASS研究报道相符[3]。
ERCC1与铂类化疗药物耐药的发生有关,ERCC1mRNA表达高低与铂类药物化疗效果呈负相关,在使用铂类药物化疗前检测ERCC1mRNA 表达可预测铂类药物化疗的耐药性或敏感 性[8-9]。Kalogeraki等[10]分析了45例NSCLC 的EGFR突变及ERCC1mRNA 表达情况,发现ERCC1低表达者具有更高的总生存率(OS),ERCC1 阳性表达中EGFR 突变率为14.8%,ERCC1阴性表达中EGFR 突变率为33.3%。研究发现,受损的核苷酸切除修复酶可引起细胞DNA 的损害,致使EGFR 突变率升高,ERCC1低表达肺肿瘤细胞DNA 受损修复能力较差,导致EGFR 基因更易出现突变,最终产生的结果是EGFR 基因突变对铂类为基础的化疗药物敏感性更高[11]。本研究显示,EGFR 基因突变与ERCC1mRNA 表达具有显著的相关性,与文献报道一致[10,12-13]。
研究显示,TYMS与培美曲塞的耐药发生相关,低表达的TYMS mRNA 患者使用培美曲塞化疗效果较好,而高表达患者疗效较差;对晚期肺腺癌患者采用培美曲塞单药治疗,EGFR 突 变 组RR 和 中 位PFS均优于野生组[4,14]。为什么EGFR突变组的生存率要优于野生组呢?Giovannetti等[15]研究发现,EGFR 突变的H1650细胞株表达低水平的TYMS酶可能是导致EGFR 突变组生存率较好的原因。但本研究显示,EGFR 基因突变与TYMS基因表达无明显相关性。分析其原因,可能是本研究样本量较小,尚有待今后大样本的研究进一步证实。
本研究发现了非小细胞肺癌EGFR 突变患者中ERCC1阴性表达率较高,由此推断EGFR 突变的NSCLC 使用铂类的化疗效果可能较好。但临床上是否能得出这一结论,还需要对这些患者进行长期随访。
[1] Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2] Ettinger DS,Akerley W,Borghaei H,et al.Non-small cell lung cancer,version 2.2013[J].J Nati Compr Canc Netw,2013,11(6):645-653.
[3] Fukuoka M,Wu YL,Thongprasert S,et al.Biomarker analyses and final overall survival results from a phase Ⅲ,randomized,open-label,first-line study of gefitinib versus carboplatin/paclitaxel in clinically selected patients with advanced non-small-cell lung cancer in Asia(IPASS)[J].J Clin Oncol,2011,29(21):2866-2874.
[4] Wu SG,Yang CH,Yu CJ,et al.Good response to pemetrexed in patients of lung adenocarcinoma with epidermal growth factor receptor(EGFR)mutations[J].Lung Cancer,2011,72(3):333-339.
[5] Xu J,He J,Yang H,et al.Somatic mutation analysis of EGFR,KRAS,BRAF and PIK3CA in 861patients with non-small cell lung cancer[J].Cancer Biomark,2011,10(2):63-69.
[6] Schmitt M,Bravo IG,Snijders PJ,et al.Bead-based multiplex genotyping of human papillomaviruses[J].J Clin Microbiol,2006,44(2):504-512.
[7] Mitsudomi T,Morita S,Yatabe Y,et al.Gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor(WJTOG3405):an open label,randomised phase 3trial[J].Lancet Oncol,2010,11(2):121-128.
[8] Larminat F,Bohr VA.Role of the human ERCC-1gene in gene-specific repair of cisplatin-induced DNA damage[J].Nucleic Acids Res,1994,22(15):3005-3010.
[9] 钟宏,冷雪峰,阳诺,等.非小细胞肺癌组织中ERCC1 mRNA 表达的及其与辅助化疗和预后的关系[J].重庆医学,2014,43(9):1058-1060.
[10] Kalogeraki A,Karvela-Kalogeraki I,Tamiolakis D,et al.ERCC1expression correlated with EGFR and clinicopathological variables in patients with non-small cell lung cancer.An immunocytochemical study on fine-needle aspiration biopsies samples[J].Rev Port Pneumol,2014,20(4):200-207.
[11] Olaussen KA,Fouret P,Kroemer G.ERCC1-specific immunostaining in non-small-cell lung cancer[J].N Engl J Med,2007,357(15):1559-1561.
[12] 李梅芳,欧阳学农,余宗阳,等.非小细胞肺癌EGFR 突变与ERCC1和BRCA1表达相关性的研究[J].中华肿瘤防治杂志,2012,19(18):1393-1396.
[13] Gandara DR,Grimminger P,Mack PC,et al.Association of epidermal growth factor receptor activating mutations with low ERCC1gene expression in non-small cell lung cancer[J].J Thorac Oncol,2010,5(12):1933-1938.
[14] Kotoula V,Krikelis D,Karavasilis V,et al.Expression of DNA repair and replication genes in non-small cell lung cancer(NSCLC):a role for thymidylate synthetase(TYMS)[J].BMC Cancer,2012,12(1):342.doi:10.1186/1471-2407-12-342.
[15] Giovannetti E,Lemos C,Tekle C,et al.Molecular mechanisms underlying the synergistic interaction of erlotinib,an epidermal growth factor receptor tyrosine kinase inhibitor,with the multitargeted antifolate pemetrexed in nonsmall-cell lung cancer cells[J].Mol Pharmacol,2008,73(4):1290-1300.
