循环microRNA在肝细胞肝癌诊断研究中的新进展
2015-03-05综述平审校
陈 义 综述,黄 平审校
(重庆医科大学附属第一医院肝胆外科 400016)
肝细胞肝癌(hepatocellular carcinoma,HCC)是世界范围内广泛分布的排名第5位的最常见的恶性肿瘤。根据对“the Global Burden of Disease Study 2010”的解析,在全球范围内癌症相关死亡的癌症中,肝癌排名第2;根据1990~2010年中国健康状况迅速改变的统计分析,在中国癌症相关死亡的疾病中肝癌仅次于肺癌,排名第2。由于早期诊断困难,只有30%~40%的患者能获得根治性治疗[1]。许多研究表明,在肝细胞肝癌中,microRNA 通常以类似促癌基因和抑癌基因的方式执行其生物学功能,参与肿瘤细胞的增殖、凋亡、肿瘤血管形成、浸润和转移等生物学行为。
近几年,学者通过研究发现,虽然microRNA 很容易降解,但在循环中却能稳定的表达。Chen等[2]研究证实,microRNA能在血清中稳定表达,能抵制核糖核酸酶A 的降解,甚至在pH 为1或13的溶液中保持稳定。基于此类研究的发现,从2010年开始,国内外学者对HCC患者循环中的microRNA 进行研究,取得了一定的成绩,并为HCC 诊断开辟了新的研究方向。
1 HCC和microRNA
随着现代癌症研究的进展,越来越多的证据表明,microRNA 参与癌症发生、发展的进程。多种microRNA 在HCC 的不同阶段均有异常表达,并作为致癌基因或者抑癌基因参与HCC的多种生物学行为,包括HCC的发生、增殖、分化、浸润、凋亡等诸多环节。到目前为止,很多研究都关注HCC 肿瘤组织与癌旁非肿瘤组织或者正常肝组织中microRNA 表达量的异常,并通过重组DNA 技术或者RNA 干扰技术来验证microRNA 的靶基因及其对细胞生物学行为的调节作用。研究最多的为miR-21、miR-122和miR-221等。
1.1 HCC中miR-21 调控机制和作用研究 几乎在所有的HCC患者肿瘤组织中miR-21 表达上调[3-5],证明该microRNA 的表达稳定,这也是很多学者选择对其研究的原因。Zhu等[3]研究指出,表达量增加的miR-21 抑制其靶基因PDCD4的表达,上调其下游信号通路关键分子磷酸化原癌基因c-Jun,基质金属蛋白酶(matrix metalloproteinases,MMP)如MMP-2和MMP-9,促使癌细胞的转移和浸润。Bao等[4]发现miR-21抑制抑癌基因PTEN 和硫酸酯酶-1(hSulf-1)的表达,从而激活PI3 K-protein kinase B(AKT)/extracellular signal regulated kinase(ERK)通路和上皮间质转化(EMT),促进HCC 细胞的增殖和运动。Karakatsanis等[5]研究发现,miR-21 还与HCC预后相关。
1.2 HCC 中miR-122调控机制研究 miR-122一直被学者认为是肝特异性microRNA,占正常肝组织microRNA 表达量的70%[6]。miR-122是研究生物学标记物的理想对象,所以,miR-122备受许多学者青睐。miR-122 在许多学者看来是作为抑癌基因存在的,因此,在HCC 组织中其表达量下降,事实上,现在的研究几乎都支持miR-122在HCC 组织中稳定地表达下调。Xu等[7]研究证明,miR-122在HCC 组织和肝癌细胞株中表达下调,提高miR-122的表达水平可抑制HCC 细胞的生长和促进其凋亡,具体的靶点为Wnt1/β-catenin通路。由于乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)感染是造成HCC的2大危险因素,所以,有学者探查miR-122在HBV 或者HCV 感染的情况下HCC形成过程中的作用。Li等[8]研究指出,HBV mRNA 绑定在miR-122互补区域,隔绝miR-122,使其靶点PBF[pituitary tumor-transforming gene 1(PTTG1)binding factor]基因表达上调,促进HCC 细胞的增殖和浸润。Zhao等[9]研究发现,HCV RNA 能绑定microRNA-122并形成Ago2-HCV-miR-122复合物,稳定HCV 基因并增强HCV 的复制。由于HCV RNA 的绑定作用,miR-122的靶点——癌基因cyclin G1(CCNG1)被释放,促进HCC的形成。
1.3 HCC 中miR-221调控机制研究 miR-221在人体多种癌症中表达量增加,而且稳定性好,如乳腺癌、结直肠癌、胶质母细胞瘤、胰腺癌、膀胱癌、胃癌及甲状腺癌等[10-11]。在HCC组织样本中,约70%的样本呈现出高表达的情况。Rong等[12]通过体外细胞试验研究发现,阻滞miR-221,能抑制HCC 细胞生长,使其停留在G1/S期,促使其凋亡。相似的结果同样被Chen等[13]证实。Rong等[12]同时证实miR-221在有转移的样本中表达量更高,并提示miR-221与较短的复发期相关,其靶基因为CDKN1C/P57和CDKN1B/P27。
2 循环microRNA 作为HCC肿瘤标记物的研究进展
选取HCC 组织标本作为研究对象,不仅对HCC 中microRNA 表达量的差异和作用机制的研究有意义,而且对HCC预后的判断也有意义。然而,对HCC 的术前诊断及手术后效果的术前预判价值不大。
现代HCC 诊断标记物的缺陷及对HCC 早期诊断的不足,迫切需要新的HCC 标记物问世。microRNA 的出现及其与HCC关系为寻找新的灵敏度和特异度都高的肿瘤标记物带来了希望。
从2008年起,许多学者发现,microRNA 能稳定地出现在循环中,2010年开始就有关于HCC 患者循环microRNA 作为肿瘤标记物的报告,从此开启了循环microRNA 对HCC 诊断价值的论证之路。
2.1 单个microRNA 的诊断价值研究 (1)表达量减少的循环microRNA。Luo等[14]研究表明,miR-122a在HCC 患者与健康人群的血清中表达量有差别,且在HCC 患者中表达量下降,经过验证,曲线下面积(AUC)为0.707,灵敏度为70.6%,特异度为67.1%,与AFP比较没有优势,但与HCC 的危险因素(如性别、吸烟史、酗酒、HCC 家族史及HBV 感染)相关。(2)表达量增加的循环microRNA。①有潜在价值作为肝病标记物的循环microRNA。Qi等[15]研究指出,miR-122 在区分HCC和健康人群时,AUC为0.869。取值0.475时,灵敏度和特异度分别为81.6%和83.3%。但不能区别HCC 和HBV感染患者,故只有可能作为肝病诊断的标记物。Gui等[16]用HCC、肝硬化、慢性乙型肝炎、胃癌患者和健康人群血清进行试验,筛查出miR-885-5p具有肝病特异性,临界值为1.06时,区别肝病和控制组,AUC 达0.904,灵敏度为90.5%,特异度为79.2%。建议可把miR-885-5p作为肝病(包括HCC)有潜力的标记物,但并不能把HCC 从肝病中区别出来。②有潜在价值区别HCC 和肝病的循环microRNA,Tomimaru等[17]发现,miR-21单独作为标记物,区分HCC 和健康人群,AUC 为0.953,灵敏度为87.3%,特异度为92%;区分HCC 和慢性肝炎,AUC 为0.773,灵敏度为61.1%,特异度为83.3%。Li等[18]指出,MiR-18a在区分HBV 相关HCC组和健康控制组,AUC为0.881,灵敏度为86.1%,特异度为75.0%;在区分HBV 相 关HCC 组 和 肝 硬 化 组,AUC 为0.775,灵 敏 度 为77.2%,特异度为70.0%。以上一系列研究可以看出,单个microRNA 在区别HCC患者和健康人群时,诊断价值高,但在区别HCC和肝病患者时,诊断价值有限。
2.2 多个microRNA 及microRNA 与其他肿瘤标记物联合的诊断价值研究 基于单个microRNA 在区别HCC 和肝病普遍都存在灵敏度或者特异度不高的问题。许多学者进行多个microRNA 联合诊断,或者与传统HCC 肿瘤标记物进行联合诊断的研究,试图找到更加理想的诊断方法。
2.2.1 microRNA 与传统HCC 肿瘤标记物的联合诊断价值研究 由于miR-21在区别HCC和肝病方面存在的不足,Tomimaru等[17]进一步研究发现,若miR-21与AFP 联合,在区别HCC和对照组时,AUC 为0.971,灵敏度和特异度分别为92.9%和90.0%。Qu等[19]研究表明,miR-16和miR-199a在区别HCC和慢性肝病方面,比传统的标记物AFP、AFP-L3%和DCP 的灵敏度高,miR-16、AFP、AFP-L3%和DCP 的联合灵敏度可达92.4%,特异度为78.5%,并建议把miR-16作为传统标记物的补充。
2.2.2 多个microRNA 联合的诊断价值研究 Liu等[20]指出,联合miR-130b和miR-15b进行临床验证,鉴别HCC,AUC为0.98,灵敏度为98.2%,特异度为91.5%。即使AFP<20 ng/mL,灵敏度也达96.7%。在AFP 不能诊断的HCC 早期阶段,同样能鉴别出HCC。Li等[21]选取HBV 携带者、慢性乙型肝炎、慢性丙型肝炎、HBV 阳性HCC 患者及健康人群血清进行试验,试图找到诊断HBV 感染和HBV 阳性HCC的标记物。结果发现miR-375、miR-92a、miR-10a、miR-223、miR-423、miR-23b/a、miR-342-3p、miR-99a、miR-122a、miR-125b、miR-150和let-7c在HBV 感染者血清中表达量增多,而且还能将HBV 阳性HCC样本从HBV 样本中区分。诊断价值试验证明,联合miR-23b、miR-423、miR-375、miR-23a和miR-342-3p,区别HBV 阳 性HCC 组 和 控 制 组,AUC 达99.9%。联 合miR-10a和miR-125b能将HBV 阳性HCC 从HBV 感染组中区分出,AUC 为(99.2±0.6)%,灵敏度为98.5%;特异度为98.5%。Zhou等[1]研究指出,miR-122、miR-192、miR-21、miR-223、miR-26a、miR-27a和miR-801联合,在AFP<400ng/mL组,其AUC 为0.879(95%CI为0.839~0.912;灵 敏 度 为77.7%,特异度为84.5%);在AFP>400ng/mL 组,AUC 为0.910(95%CI为0.867~0.942,灵敏度为87.7%,特异度为83.5%)。区分HCC组和慢性乙型肝炎组,AUC 为0.842,灵敏度为79.1%,特异度为76.4%;区分HCC 组与肝硬化组,AUC为0.884,灵敏度为75%,特异度为91.1%。表现出了比传统标记物更好的诊断价值。
2.3 尿液中循环microRNA 诊断价值的研究 为了寻求更加简便、无创的诊断方法,有学者试图通过尿液寻找HCC 肿瘤标记物。因为HCV 感染是HCC 形成的危险因数之一,有研究[22-25]选取HCV 阳性HCC、慢性HCV 感染患者和健康人群的尿液进行筛查,将HCV 阳性HCC患者从HCV 感染患者中区分出,miR-618敏感度为64%,特异度为68.0%;miR-650敏感度为72.0%,特异度为58.0%。虽然研究者在尿液中并没有发现理想的肿瘤标记物,但其扩展了循环microRNA 研究的范畴,为进一步的研究树立了榜样。上述研究相关数据见表1、表2。

表1 HCC中循环microRNA 表达量改变
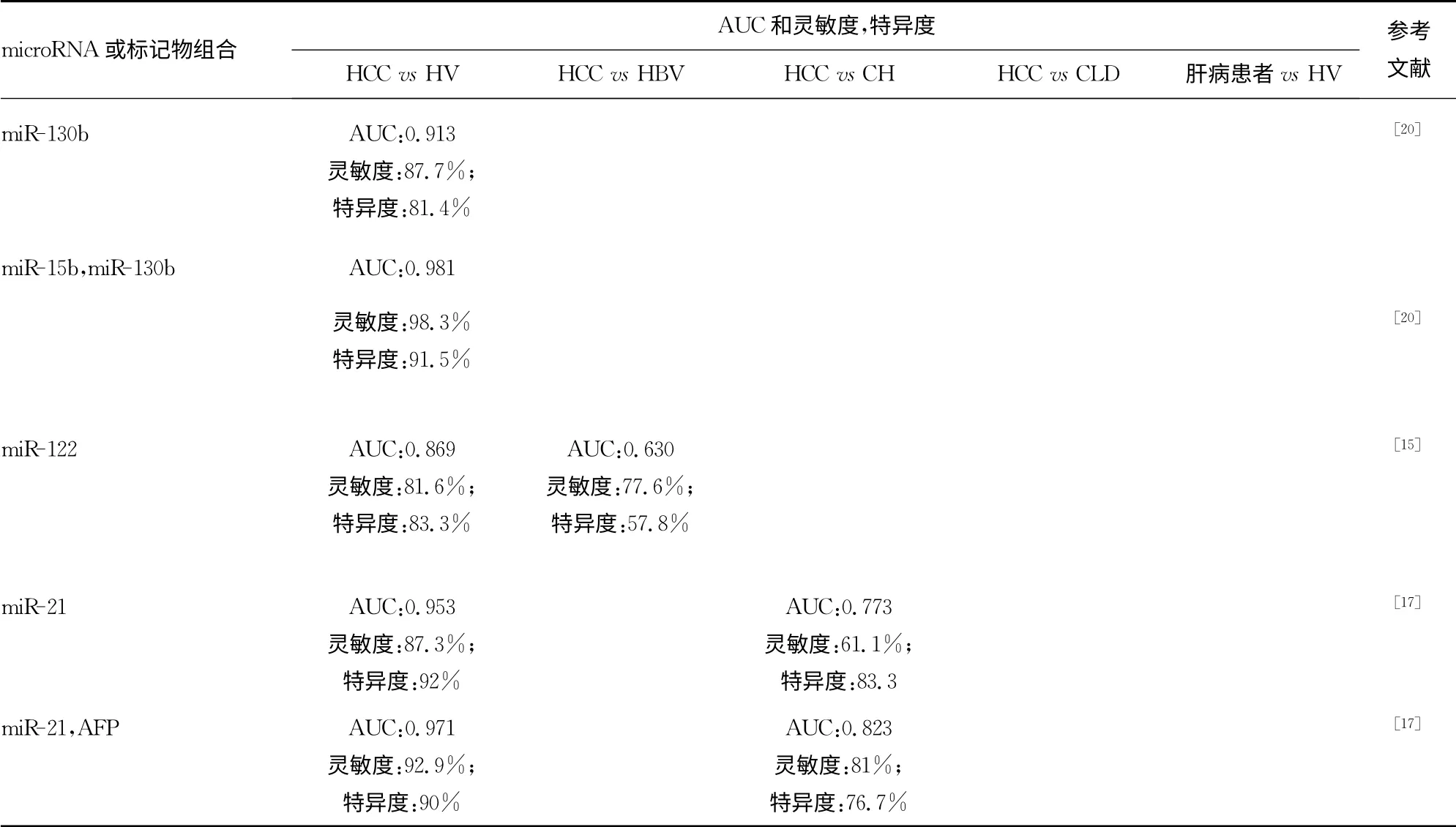
表2 循环microRNA 及其联合对HCC的诊断价值

续表2 循环microRNA及其联合对HCC的诊断价值
3 展 望
现有HCC肿瘤标记物特异度和灵敏度的不足,促使对理想HCC特异性肿瘤标记物的寻找。理想的肿瘤标记物应该具备2大特性,即灵敏度高、特异度高。从表2可见,有的microRNA 显示出了很好的特异度及灵敏度,如miR-130b、miR-21、miR-122。但实验仍有不足之处,如miR-130b在区分HCC患者和健康人群时,ROC 曲线下面积为0.913,灵敏度为87.7%,特异度为81.4%,似乎已经比传统的AFP、DCP 等标记物好。但没有关于区分HCC 和HBV 感染、肝硬化及HCV感染的研究。这表明,现在研究认为很有希望成为理想的HCC肿瘤标记物的microRNA,从实验到临床应用的转变,仍有许多工作要做。怎样筛选最佳microRNA 及其组合,并进行科学的验证,是需要解决的问题。
[1] Zhou J,Yu L,Gao X,et al.Plasma microRNA panel to diagnose hepatitis B virus-related hepatocellular carcinoma[J].J Clin Oncol,2011,29(36):4781-4788.
[2] Chen X,Ba Y,Ma L,et al.Characterization of microRNAs in serum:a novel class of biomarkers for diagnosis of cancer and other diseases[J].Cell Res,2008,18(10):997-1006.
[3] Zhu Q,Wang Z,Hu Y,et al.miR-21promotes migration and invasion by the miR-21-PDCD4-AP-1feedback loop in human hepatocellular carcinoma[J].Oncol Rep,2012,27(5):1660-1668.
[4] Bao L,Yan Y,Xu C,et al.MicroRNA-21suppresses PTEN and hSulf-1expression and promotes hepatocellular carcinoma progression through AKT/ERK pathways[J].Cancer Lett,2013,337(2):226-236.
[5] Karakatsanis A,Papaconstantinou I,Gazouli M,et al.Expression of microRNAs,miR-21,miR-31,miR-122,miR-145,miR-146a,miR-200c,miR-221,miR-222,and miR-223in patients with hepatocellular carcinoma or intrahepatic cholangiocarcinoma and its prognostic significance[J].Mol Carcinog,2013,52(4):297-303.
[6] Tsai WC,Hsu SD,Hsu CS,et al.MicroRNA-122plays a critical role in liver homeostasis and hepatocarcinogenesis[J].J Clin Invest,2012,122(8):2884-2897.
[7] Xu J,Zhu X,Wu L,et al.MicroRNA-122suppresses cell proliferation and induces cell apoptosis in hepatocellular carcinoma by directly targeting Wnt/β-catenin pathway[J].Liver Int,2012,32(5):752-760.
[8] Li C,Wang Y,Wang S,et al.Hepatitis B virus mRNAmediated miR-122inhibition up regulates PTTG1-binding protein,which promoteshepatocellular carcinoma tumor growth and cell invasion[J].J Virol,2013,87(4):2193-2198.
[9] Zhao L,Li F,Taylor EW.Can tobacco use promote HCVinduced miR-122 hijacking and hepatocarcinogenesis?[J].Med Hypotheses,2013,80(2):131-133.
[10] Li J,Wang Y,Yu W,et al.Expression of serum miR-221 in human hepatocellular carcinoma and its prognostic significance[J].Biochem Biophys Res Commun,2011,406(1):70-73.
[11] Callegari E,Elamin BK,Giannone F,et al.Liver tumorigenicity promoted by microRNA-221in a mouse transgenic model[J].Hepatology,2012,56(3):1025-1033.
[12] Rong M,Chen G,Dang Y.Increased miR-221expression inhepatocellular carcinoma tissues and its role in enhancing cell growth and inhibiting apoptosis in vitro[J].BMC Cancer,2013,13:21.
[13] Chen G,Dang YW,Luo DZ,et al.Effect of miR-221on the viability and apoptosis of hepatocellular carcinoma HepG2cells[J].Zhonghua Gan Zang Bing Za Zhi,2011,19(8):582-587.
[14] Luo J,Chen M,Huang H,et al.Circulating microRNA-122aas a diagnostic marker for hepatocellular carcinoma[J].Onco Targets Ther,2013,6:577-583.
[15] Qi P,Cheng SQ,Wang H,et al.Serum microRNAs as biomarkers for hepatocellular carcinoma in Chinese patients with chronic hepatitis B virus infection[J].PLoS One,2011,6(12):e28486.
[16] Gui J,Tian Y,Wen X,et al.Serum microRNA characterization identifies miR-885-5p as a potential marker for detecting liver pathologies[J].Clin Sci(Lond),2011,120(5):183-193.
[17] Tomimaru Y,Eguchi H,Nagano H,et al.Circulating microRNA-21as a novel biomarker for:hepatocellular carcinoma[J].J Hepatol,2012,56(1):167-175.
[18] Li L,Guo Z,Wang J,et al.Serum miR-18a:apotential marker for hepatitis B virus-related hepatocellular carcinoma screening[J].Dig Dis Sci,2012,57(11):2910-2916.
[19] Qu KZ,Zhang K,Li H,et al.Circulating microRNAs as biomarkers for hepatocellular carcinoma[J].J Clin Gastroenterol,2011,45(4):355-360.
[20] Liu AM,Yao TJ,Wang W,et al.Circulating miR-15band miR-130bin serum as potential markers for detecting.hepatocellular carcinoma:a retrospective cohort study[J].BMJ Open,2012,2(2):e000825.
[21] Li LM,Hu ZB,Zhou ZX,et al.Serum microRNA profiles serve as novel biomarkers for HBV infection and diagnosis of HBV-positive hepatocarcinoma[J].Cancer Res,2010,70(23):9798-9807.
[22] Abdalla MA,Haj-Ahmad Y.Promising candidate urinary microRNA biomarkers for the early detection of hepatocellular carcinoma among high-risk hepatitis C virus egyptian patients[J].J Cancer,2012,3:19-31.
[23] Xu J,Wu C,Che X,et al.Circulating microRNAs,miR-21,miR-122,and miR-223,in patients with hepatocellular carcinoma or chronic hepatitis[J].Mol Carcinog,2011,50(2):136-142.
[24] Shigoka M,Tsuchida A,Matsudo T,et al.Deregulation of miR-92aexpression is implicated inhepatocellular carcinoma development[J].Pathol Int,2010,60(5):351-357.
[25] Bihrer V,Waidmann O,Friedrich-Rust M,et al.Serum microRNA-21as marker for necro inflammation in hepatitis C patients with and without hepatocellular carcinoma[J].PLoS One,2011,6(10):e26971.
