DC-CIK疗法联合细胞因子对老年乳腺癌患者外周血CD4+CD25+Tr细胞水平和免疫功能的影响
2015-03-05王建华沧州市中心医院河北沧州061000
赵 芳 张 睿 刘 静 王建华 王 娟(沧州市中心医院,河北 沧州 061000)
DC-CIK疗法联合细胞因子对老年乳腺癌患者外周血CD4+CD25+Tr细胞水平和免疫功能的影响
赵芳张睿刘静王建华王娟
(沧州市中心医院,河北沧州061000)
〔摘要〕目的探讨树突细胞-细胞因子诱导的杀伤细胞(DC-CIK)疗法联合细胞因子对老年乳腺癌患者外周血CD4+CD25+Tr细胞水平和免疫功能的影响。方法应用流式细胞仪检测23例老年乳腺癌患者,经DC-CIK细胞治疗联合细胞因子治疗前后外周血中CD4+CD25+Tr细胞水平。结果治疗前CD4+CD25+Tr细胞水平明显高于健康对照组(P<0.05)。治疗后DC-CIK治疗组和DC-CIK疗法联合细胞因子组均明显低于健康对照组和治疗前(P<0.05) ; DC-CIK疗法联合细胞因子组降低更为明显。随着培养时间的延长,CIK细胞中CD3+CD8+、CD3+CD56+细胞的百分含量明显上升。治疗后,患者外周血T细胞亚群水平均升高,其中CD3+、CD4+、CD19+、CD16+CD56+细胞水平明显高于治疗前(P<0.05)。结论老年乳腺癌患者处于免疫功能的抑制状态,接受DC-CIK细胞联合细胞因子的治疗后,CD4+CD25+Tr细胞水平降低,患者机体的免疫功能明显提升。
〔关键词〕乳腺癌; DC-CIK疗法; CD4+CD25+Tr细胞;免疫功能
第一作者:赵芳(1980-),女,硕士,主治医师,主要从事恶性肿瘤的DC-CIK细胞免疫治疗。
乳腺癌是老年女性常见的恶性肿瘤之一,治疗方案主要包括手术、放疗、化疗、内分泌治疗。近年来,随着生物免疫治疗的进展,乳腺癌的生物免疫治疗逐渐兴起,其包括主动性免疫治疗和被动性免疫治疗。过继性免疫治疗是被动免疫的一种,在近几年的基础及临床研究中取得突破性进展〔1〕。过继免疫治疗包含淋巴因子激活的杀伤细胞(LAK)、肿瘤浸润性淋巴细胞(TIL)、特异性细胞毒T淋巴细胞(CTL)、树突细胞(DC)、细胞因子诱导的杀伤细胞(CIK)等,其中,DC细胞、CIK细胞治疗为近年的研究热点〔2〕。本研究应用流式细胞仪检测了老年乳腺癌患者接受DC-CIK细胞免疫治疗前后CD4+CD25+Tr细胞和各抗肿瘤相关免疫因子表达水平,旨在为老年乳腺癌患者新的细胞免疫治疗提供参考。
1 材料与方法
1.1研究对象选取2010年5月至2013年10月本院肿瘤诊疗中心收治的老年乳腺癌患者23例,均经术后病理活检确诊,且在接受常规化放疗后无法耐受继续治疗。年龄60~70〔平均(63.19±2.17)〕岁;随机分为DC-CIK治疗组(11例)和DC-CIK疗法联合细胞因子组(12例) ;选取同期来本院体检的23名健康人为对照组。入选者及其授权委托人均充分知情同意,并在细免疫治疗同意书中签字。
1.2仪器与试剂流式细胞仪(美国BD公司) ;血细胞分离机(德国费森尤斯公司) ;倒置相差显微镜(日本奥林巴斯) ; MCO-15AC型细胞孵育箱(日本三洋公司)。Ficoll淋巴细胞分离液(密度1.077 g/ml,购于天津灏洋生物有限公司) ; DMEM细胞培养液(美国Gibco公司) ; CD3单抗(武汉生物制品研究所) ;γ-干扰素(上海克隆生物高技术有限公司)。
1.3细胞培养分离患者外周血单个核细胞约3×109,去浆、Ficoll淋巴细胞分离液分离单个核细胞,用细胞培养液洗涤2次,离心后加入细胞培养瓶中,放入CO2孵育箱中培养2 h后将悬浮细胞移入另外培养瓶中培养CIK细胞,瓶中遗留的贴壁细胞继续培养DC细胞,每3天换液1次,第4天加入肿瘤坏死因子(TNF)、白细胞介素(IL) -4、GM因子,作DC细胞的常规诱导,悬浮细胞则调整细胞浓度为2×106/ml,加入CD3单抗,γ-干扰素2 000 U/ml,计为第0天,之后第1天加入1 000 U/ml IL-2诱导CIK细胞,换液当天观察细胞,初步评判细胞的生长状态,隔3 d换液1次,加入等量的γ-干扰素、IL-2,同时抽取细菌、真菌培养,换液后继续放回孵育箱中。
1.4培养细胞的回输培养细胞的回输:细胞培养第11~15天,采用流式细胞仪检测,当CD3+CD56+细胞数≥50%,CD3+CD8+细胞≥30%,并且同时留取细菌及真菌培养阴性时方可收集细胞。应用1%~2%蛋白生理盐水1 500 r 15 min洗涤3次,收集细胞加入1%蛋白生理盐水中回输,一般为每日回输一次,一个疗程根据患者细胞生长的总量回输5~7次,回输细胞总数约10×109/L。回输当天另建液路,末次输注过程中在患者床旁观察,同时观察每次输注后1 d内患者状态。根据患者病情及调节性T细胞的水平,决定患者的DC-CIK细胞免疫治疗的分组,11例患者单纯应用DC-CIK细胞,12例患者在细胞培养过程中及细胞输注后配合细胞因子治疗,给予100万单位IL-2肌注,隔日1次,300万单位α-2b干扰素肌注,隔日1次,30~40 d 为1个疗程。
1.5细胞鉴定和T细胞亚群检测细胞鉴定:分别于细胞培养第0、7、13、15天,采用流式细胞仪测定细胞免疫表型,取培养的细胞液1 ml,分别加入20 μl鼠抗人抗体,充分混匀,闭光条件下孵育40 min,4℃、3 000 r/min离心10 min,冲洗、过滤后加入磷酸盐缓冲液(PBS) 400 μl,采用流式细胞仪进行检测。T细胞亚群检测:分别于治疗前后采集外周静脉血2 ml加入乙二胺四乙酸(EDTA)抗凝管,加入20 μl鼠抗人抗体,混匀,闭光条件下孵育30~40 min,4℃、3 000 r/min离心10 min,冲洗、过滤后加入PBS缓冲液400 μl,采用流式细胞仪进行检测。
1.6统计学方法应用SPSS13.0统计软件进行分析,计量数据以±s表示。
2 结果
2.1不良反应情况5例患者首次接受细胞治疗后2 h以内即出现发热,体温最高38.0℃,嘱患者多饮用温开水后汗出,患者在细胞输注结束后10 h体温均降至正常。18例患者静脉输注过程顺利无反应,第2次细胞回输后发热症状明显缓解,患者治疗耐受性均良好。
2.2治疗情况比较治疗前CD4+CD25+Tr细胞水平明显高于健康对照组(P<0.05)。治疗后DC-CIK治疗组和DC-CIK疗法联合细胞因子组(5.89±2.69、3.67±1.56),均明显低于对照组(9.03±1.53),且低于治疗前(P<0.05) ;其中DC-CIK疗法联合细胞因子组患者CD4+CD25+Tr细胞水平降低更为明显。
2.3细胞培养过程中细胞免疫表型的变化情况CIK细胞属于异质细胞群,随着培养时间的延长,CIK细胞中CD3+CD8+、CD3+CD56+细胞的百分含量明显上升。见表1。
表1 细胞培养过程中细胞免疫表型的变化(±s,%)
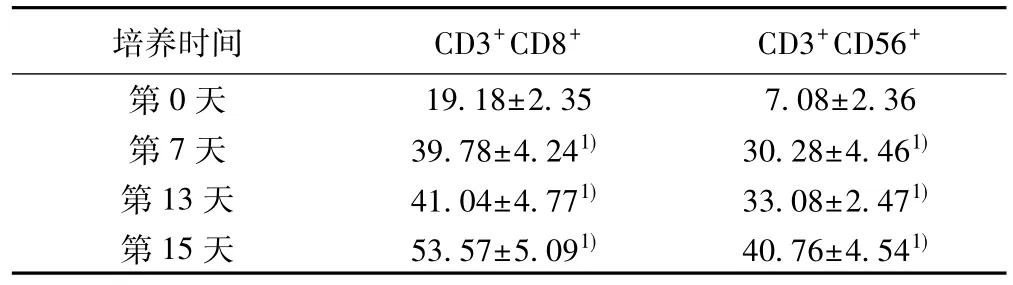
表1 细胞培养过程中细胞免疫表型的变化(±s,%)
与第0天相比: 1) P<0.01
培养时间 CD3+CD8+ CD3+CD56+第0天 19.18±2.35 7.08±2.36 第7天 39.78±4.241) 30.28±4.461)第13天 41.04±4.771) 33.08±2.471)第15天 53.57±5.091) 40.76±4.541)
2.4患者外周血T细胞亚群的变化情况治疗后DC-CIK治疗组和DC-CIK疗法联合细胞因子组患者外周血T细胞亚群水平均升高,其中CD3+、CD4+、CD19+、CD16+CD56+细胞水平明显高于治疗前(P<0.05)。见表2。
表2 治疗前后患者T细胞亚群的变化(±s,%)

表2 治疗前后患者T细胞亚群的变化(±s,%)
与治疗前相比: 1) P<0.05
T细胞亚群 治疗前 治疗后CD3+ 50.78±6.31 70.21±1.891)CD4+ 20.89±2.61 37.18±5.751)CD8+ 29.56±4.01 30.13±6.01 CD19 8.13±1.98 23.45±3.671)CD16+CD56+ 15.21±3.78 38.23±6.951)
3 讨论
肿瘤局部存在多种的免疫抑制细胞,它们参与肿瘤患者的细胞免疫,且与肿瘤的发生、发展密不可分。对于肿瘤患者外周血中CD4+CD25+Tr细胞水平的研究日渐深入,因其在肿瘤的发生、发展及其机体抗肿瘤免疫中发挥的作用日趋明朗,对其进一步深入研究和开发将为多种T细胞介导的治疗,尤其是抗肿瘤免疫提供了一种全能、高效的临床治疗方案。
DC细胞是有效的抗原提呈细胞,特征性的高表达与抗原递呈有关的主要组织相容性复合体(MHC)Ⅰ类和Ⅱ类分子,并且高水平表达刺激分子CD80、CD86、CD40、CD50等,以及某些黏附分子,其本身也可以产生多种细胞因子〔3〕。CIK细胞是以CD3+CD56+T细胞为主的异质细胞群,是新型的抗肿瘤效应细胞,兼具T淋巴细胞和自然杀伤(NK)细胞的抗肿瘤特性,与以往的抗肿瘤效应细胞相对比,CIK细胞的抗肿瘤效应更强〔4〕。DC与CIK细胞在抗肿瘤中有一定的互补作用,为取得较好的疗效可联合使用。老年患者乳腺癌恶性程度较高,往往常规的放化疗均不能耐受,尝试采用抗肿瘤免疫的生物治疗模式〔5〕。本次治疗中仅有5例患者在应用回输CIK细胞过程中出现低热反应,这种低热原因其一考虑为回输的CIK细胞中包含人血白蛋白及细胞因子IL-2,其二考虑同DC细胞联合CIK细胞治疗后大量的细胞因子释放作用于患者中枢神经系统引发的上调体温调节中枢导致的发热反应。
CD4+CD25+Tr细胞为一系列重要的免疫调节细胞,由于其在预防发生自身免疫病的同时,可上调免疫效应细胞的活化阈值,抑制抗肿瘤免疫反应,导致机体对早期肿瘤常表现为一种无反应状态〔6,7〕。因此,降低CD4+CD25+T细胞的表达,有利于刺激机体产生有效的抗肿瘤免疫应答。本研究说明DC-CIK治疗后能显著降低患者外周血CD4+CD25+Tr细胞水平,同时联合细胞因子治疗可提升疗效;其机制主要为DC-CIK治疗接触了机体的免疫抑制状态,提升了抗肿瘤免疫水平。
DC-CIK疗法联合细胞因子在乳腺癌的临床应用中仍存在很多问题。首先是对DC细胞、CIK细胞的抗肿瘤作用机制尚未完全明确,尚需进行大规模的基础研究及其临床研究探讨具体作用机制。其次,DC细胞联合CIK细胞免疫治疗应用在乳腺癌患者中的远期疗效及不良反应仍缺乏大样本的临床研究。但是,DC细胞联合CIK细胞,联合细胞因子的免疫治疗,具有增殖能力强,杀伤活性高的生物学特性,使其有望成为老年乳腺癌患者生物治疗的首选方案之一。
4 参考文献
1鲍锋,盛春华,杨光,等.DC-CIK细胞治疗中晚期恶性肿瘤531例分析〔J〕.中国免疫学杂志,2011; 27(4) : 360-2.
2 Yasuda T,Kamigaki T,Nakamura T,et al.Dendritic cell-tumor cell hybirds enhance the induction of cytotoxic T lymphocytes against murine colon cancer: a comparative analysis of antigen loading methods for the vaccination of immunotherapeutic dendritic cells〔J〕.Oncol Rep,2006; 16 (6) : 1317-24.
3何志惠,桑圣刚,洪涛,等.DC-CIK细胞治疗对晚期恶性肿瘤患者免疫功能及生活质量的影响〔J〕.肿瘤预防与治疗,2013; 26(4) : 213-5.
4 Sivers E,Albers P,Shemidt-Wolf IG,et al.Telomerase pulsed dendritic cells for immunotherapy for renal cell carcinoma〔J〕.J Urol,2013; 171 (1) : 114-9.
5 Wing K,Ekmark A,Karlsson H,et al.Characterization of human CD25+ CD4+T cells in thymus,cord and adult blood〔J〕.Immunology,2010; 106 (2) : 190-9.
6 Wolf AM,Wolf D,Steurer M,et al.Increase of regulatory T cells in the peripheral blood of cancer patients〔J〕.Clin Cancer Res,2010; 9(2) : 606-12.
7Emens LA,Reilly RT,Jaffee EM.Breast cancer vaccines: maximizing cancer treatment by tapping into host immunity〔J〕.Endcr Relat Cancer,2005; 12(1) : 1-17.
〔2015-01-15修回〕
(编辑袁左鸣/滕欣航)
基金项目:河北省沧州市科技计划项目(No.131302214)
〔中图分类号〕R73
〔文献标识码〕A
〔文章编号〕1005-9202(2015) 16-4450-02;
doi:10.3969/j.issn.1005-9202.2015.16.013
