多虑平联合促红细胞生成素治疗慢性病贫血的临床观察*
2015-03-04陈登科刘兆玉苏婷婷王玉兰何云绮
陈登科,刘兆玉,苏婷婷,王玉兰,李 强,何云绮
(贵州省遵义市第一人民医院血液科 563000)
慢性病贫血(anemia of chronic disease,ACD)是临床上最常见的贫血类型,常继发于慢性炎症、慢性感染、肿瘤、创伤及外科手术等[1]。ACD 特征为即使在储存铁足够的情况下,依然出现血铁过少及贫血;而其最主要的病理生理学改变为铁失利用、对促红素反应性降低、红细胞寿命缩短[2]。其中,炎性因子[白介素-6(IL-6)、IL-1、肿瘤坏死因子-α(TNF-α)、IL-10]及Hepcidin在ACD 的发生发展中起重要作用[3]。
尽管多虑平作为传统的三环类抗抑郁药而广泛用于治疗各种抑郁症,但其较强的抗H1受体作用使得老药新用成为可能。既往研究证实:慢性炎症可通过组胺促进IL-6生成并增加Hepcidin分泌及表达从而启动并诱导慢性炎症状态下的铁代谢异常并最终导致贫血[4-7],因此,推测多虑平所具备的较强抗H1受体效应可用于抑制IL-6产生并继而降低Hepcidin的分泌及表达,实现治疗ACD 的目的。
鉴于多虑平在ACD 的临床治疗中的效果研究尚未见报道,故本试验采用单用多虑平、单用促红细胞生成素(EPO)及两者联合应用为治疗措施,通过ELISA 法检测血清中Hepcidin及上述细胞因子的水平,并分析相互间的相关性及不良反应,初步探讨多虑平联合EPO 在ACD 的治疗中的作用。
1 资料与方法
1.1 一般资料 收集本院2010年1至2013年1月ACD 患者130例,患者年龄35~84 岁,中位年龄56 岁,患者的原发病、临床资料等见表1。4组患者的年龄、老年患者所占比例、性别、贫血程度、原发病分布、肾功能、是否合并其他部位出血等临床因素差异均无统计学意义(P>0.05)。该结果表明4组患者的临床特征基本一致,均具有可比性。所有患者之前均未接受输血及补铁治疗。ACD 诊断标准参照既往文献[8]。本研究得到本院伦理委员会许可,所有患者均被告知并获得其同意,研究符合赫尔辛基宣言中关于伦理学的相关要求。对于入组病例,按治疗策略的不同,将130例患者分为4组:A 组(对照组)23例,仅治疗ACD 的基础病,不针对贫血进行治疗;B组(单用多虑平治疗组)30例,多虑平(江苏苏州太仓制药厂生产、片剂)75 mg/d,口服;C 组(单用EPO 治疗组)35 例,EPO(南京华欣药业生物工程有限公司生产、注射剂)150 U/kg皮下注射,每周3次;D 组(多虑平联合EPO 治疗组)42例,EPO 150U/kg皮下注射,每周3次;加多虑平75mg/d,口服,EPO及多虑平用药时间均为1个月。
1.2 方法 分别于治疗后7、14、21、28、35、42、49d持续监测各组患者血红蛋白(Hb)。分别于治疗前、治疗后1个月采用ELISA 法检测Hepcidin、IL-6。
1.3 统计学处理 采用SPSS13.0软件进行统计数据处理,计数资料的比较(临床资料及输血频次、不良反应等)采用Krelated Samples test检验进行分析,Hb及血清学各项指标等采用重复测量的方差分析进行比较,分别分析其时间、分组因素主效应及交互效应,如交互效应P<0.05,则应分析时间、分组因素的单独效应。组内比较根据方差齐性,采用LSD 或Game-Howell法进行比较。输血量、住院总费用比较采用单因素方差分析,组内比较如前述。相关分析采用双变量相关分析,如相关变量中有计数资料,则选用Spearman相关分析法,如为计量资料,则为Pearson相关分析法。以P<0.05为差异有统计学意义。
2 结 果
2.1 临床资料描述 为了与慢性肾病相关性贫血及慢性失血性贫血相鉴别,本研究中,分别对上述指标进行筛选。所有入组患者中,无1例为肾功能失代偿及其后阶段的患者,然而,A组有1例,B组2例,C组2例,D 组4例合并慢性消化道出血、呼吸道咯血等。其原发病分别为肺癌、结核、胃癌、系统性红斑狼疮等。且极重度贫血(Hb≤30g/L)的患者,均包含于此类患者中。因此,将上述合并其他部位慢性失血的患者退出本研究。退组率分别为4.35%、6.67%、5.71%及9.52%。
2.2 外周血Hb变化 退组患者中,A 组1例为极重度贫血组患者(n=22);B组2例(n=28),1例为重度贫血(30<Hb<70g/L),1例为轻中度贫血(Hb>70g/L);C组2例(n=33),2例均为极重度贫血;D 组4例(n=38),3例为极重度贫血患者,1例为重度贫血。各组外周血Hb变化趋势如图1、2。图1结果表明对于本研究中Hb≥70g/L 的ACD 患者,时间及分组因素无交互效应(P=0.105),分组因素主效应F=0.081,P=0.970,即治疗策略的不同对此类患者的Hb变化的影响差异无统计学意义(P>0.05)。而时间主效应F=26.185,P<0.01,4组Hb≥70g/L 的患者Hb的升高趋势均出现于治疗后14d,其后则随治疗时间的延长而逐渐增加,直至治疗后35 d趋于平稳。图2结果表明时间、分组因素对重度贫血的ACD患者Hb的影响差异有统计学意义(交互效应F=9.534,P<0.01);分别分析两者的单独效应可知:时间主效应F=36.415,P<0.01;分组因素主效应:F=7.732,P<0.01。分别固定时间因素及分组因素可知:输血后,4组Hb均在治疗后7 d出现明显增高,此后,4组均随时间进展而逐渐下降,B、A 组下降幅度最为明显,但B、A 组差异无统计学意义(P>0.05)。D 组下降幅度最为平缓,其次为C组。
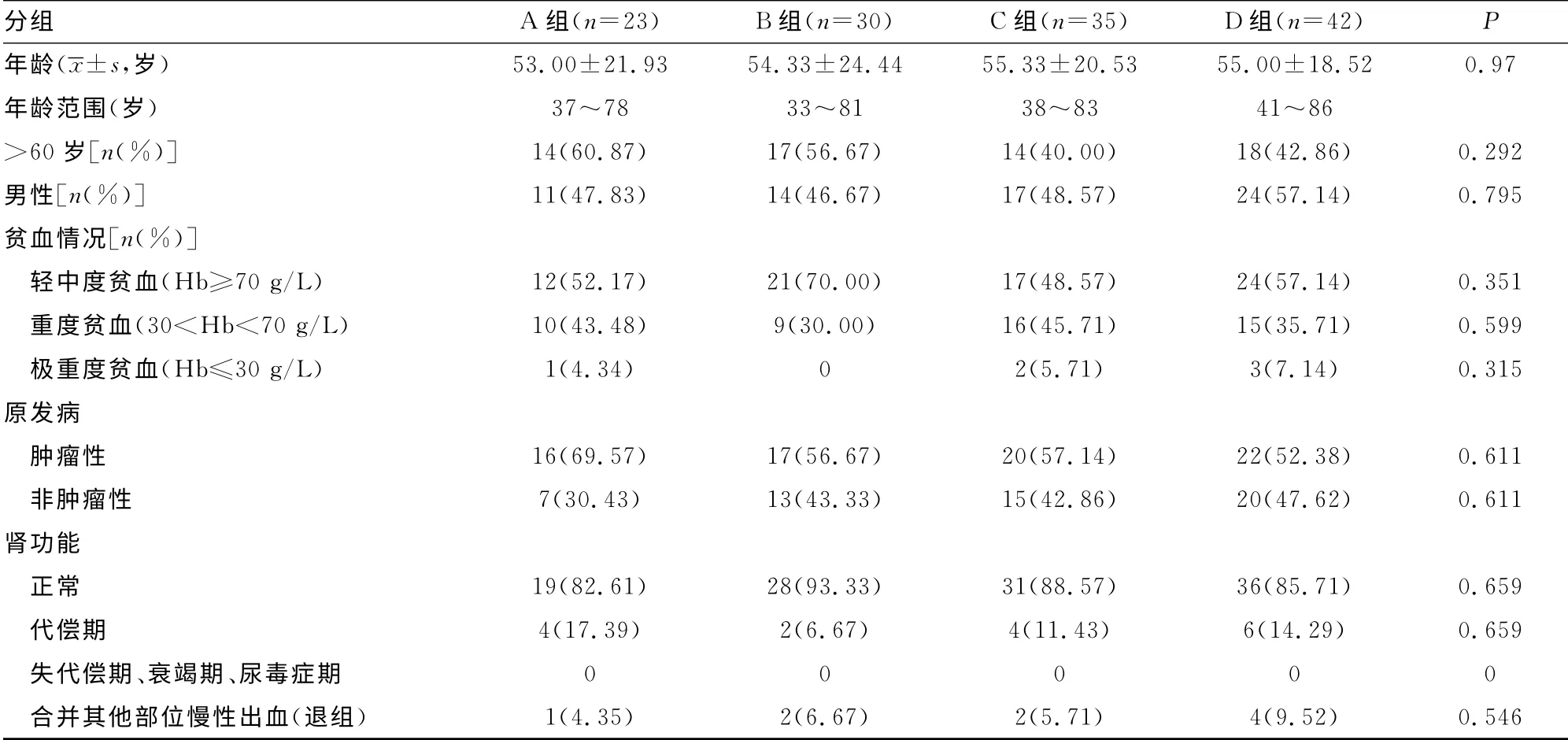
表1 入组患者临床资料
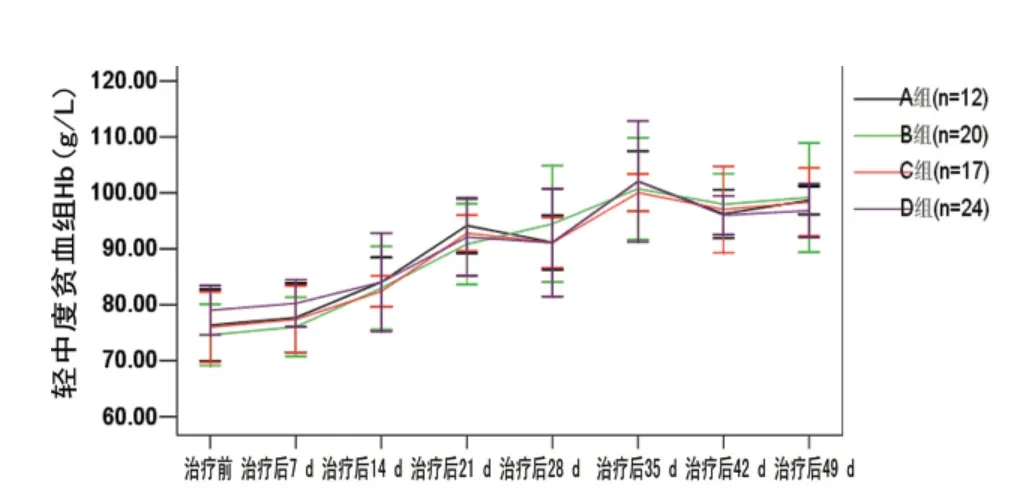
图1 轻中度贫血Hb变化趋势
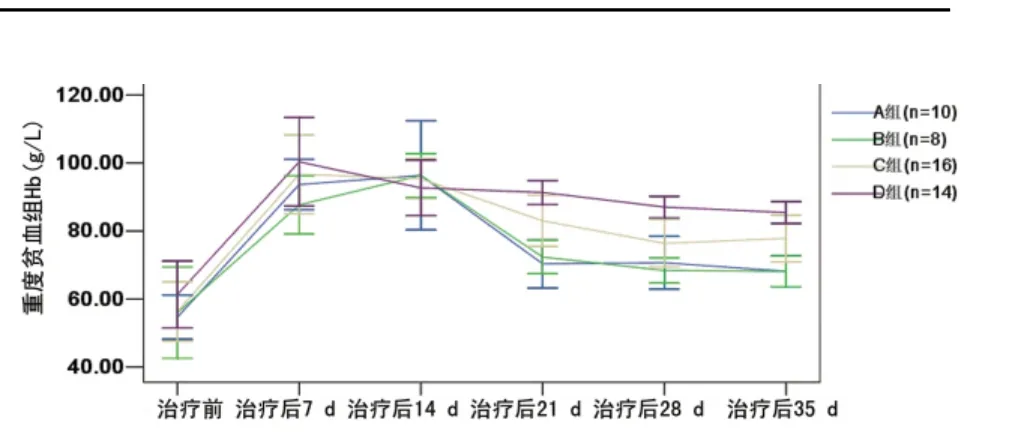
图2 重度贫血患者Hb变化趋势
2.3 各组治疗期间不良反应评估 治疗过程期间,不良反应主要表现为胃肠道反应、皮疹、嗜睡、血压增高、震颤、眩晕、多汗等。然而,各组患者胃肠道反应仅表现为轻微恶心、食欲不振,无呕吐,仅B组1例患者出现轻微腹痛,服药2d后即自行缓解,后未再出现。皮疹多于服药后2~3d内自行消失。通过比较4组不良反应发生率,4组的胃肠道反应、皮疹、震颤、眩晕多汗等不良反应的发生率差异无统计学意义(P>0.05)。然而,B、D 组的嗜睡发生率明显高于A、C 组(P=0.046)。血压升高的发生率C、D 组明显高于A、B 组(P=0.048)。但两组血压增高程度均在150~170/80~95mm Hg。见表2。
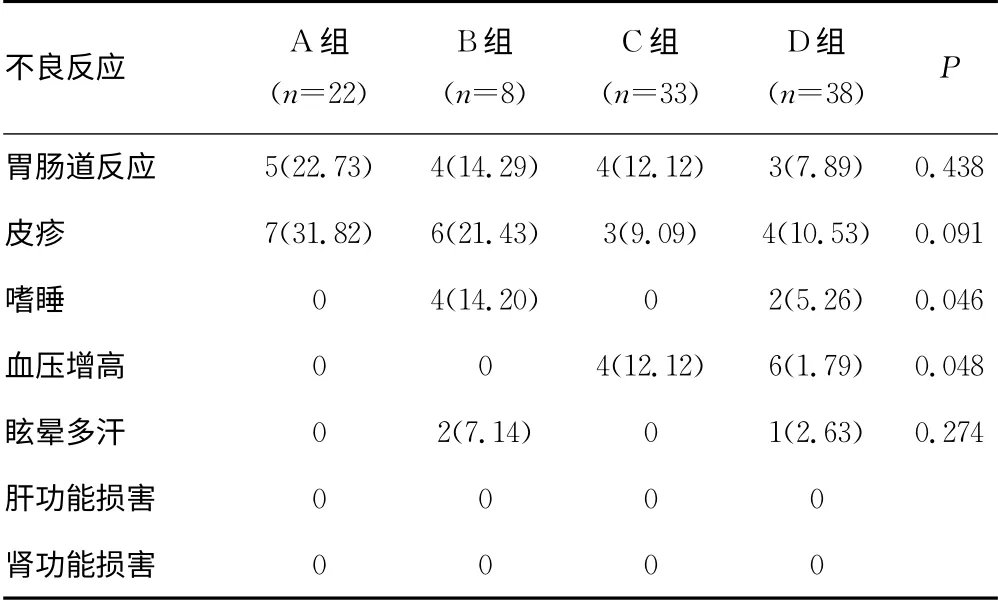
表2 不良反应发生率[n(%)]
2.4 输血量比较 分组因素对输血量的影响差异有统计学意义(F=28.165,P<0.01)。组间两两比较表明,A、B组输血量差异无统计学意义(P>0.05),但C、D 组则明显低于A、B组,其趋势为D<C<B、A 组。见图3。
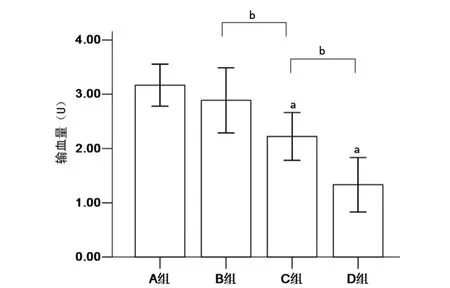
图3 各组输血量比较

图4 治疗前后Hepcidin的变化趋势
2.5 治疗前、治疗后1个月各组Hepcidin、IL-6变化趋势 观察时间点、分组因素对Hepcidin及IL-6水平的影响差异有统计学意义(Hepcidin及IL-6的交互效应均P<0.05)。两者的时间主效应、分组主效应均P<0.05。固定时间因素可知,各组Hepcidin及IL-6水平在治疗前差异均无统计学意义(P>0.05);治疗后,两者变化趋势均为:A>B、C>D。固定分组因素可知:各组Hepcidin及IL-6水平在治疗后均明显降低。见图4、5。
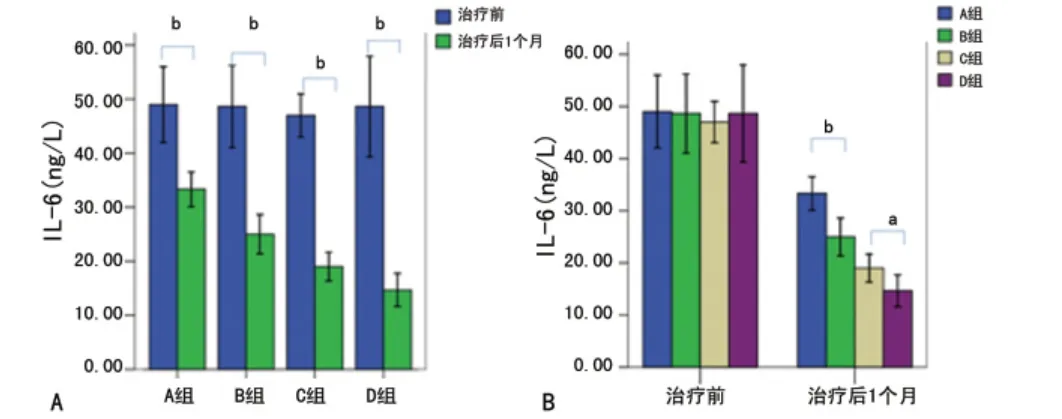
图5 治疗前后IL-6的变化趋势
3 讨 论
本研究结果表明不同程度的贫血对于治疗的反应截然不同。对于Hb>70g/L的ACD 患者,Hb变化趋势表明治疗策略因素对于此类贫血患者的Hb水平影响差异无统计学意义(P>0.05)。因此,对于不需输血的ACD 患者,治疗原发病最为关键,而使用其他药物如EPO、多虑平等并未显示出其治疗的优越性。对于30g/L<Hb<70g/L 的患者,通过持续监测Hb水平变化趋势及输血量比较可知:仅靠治疗原发病及输血等对症支持治疗并不能有效持续的缓解贫血症状,即使提高输血量亦不能有效维持Hb水平。而单用多虑平治疗组,其Hb变化趋势与对照组亦无明显差异,该结果表明单用多虑平并未像之前假设的那样可有效地治疗ACD。EPO 作为治疗ACD的一线用药,其疗效在既往文献中已获肯定[9];本研究中,作者发现使用EPO 组的Hb变化在输血后明显较B及A 组平缓,其输血后Hb升高的趋势持续更久。然而,作者亦发现EPO联合多虑平组的Hb变化趋势最为平缓,该结果表明EPO 联合多虑平治疗重度ACD 具有协同作用,其可提高EPO 疗效,更好地提高输血效率。
多虑平作为抗抑郁药物,在临床中的使用历史悠久,其不良反应亦早已阐明。本研究中,作者对多虑平以及多虑平的联合用药的安全性亦作了相关的研究。通过4组不良反应发生率的比较,发现含多虑平的治疗组的嗜睡高于其他两组。而其他诸如胃肠道反应、皮疹、眩晕、多汗等不良反应的发生率则差异无统计学意义(P>0.05)。然而,含多虑平的治疗组嗜睡并发症症状较轻微,临床患者在不进行高精密工作的情况下,对于患者生活质量及治疗等并无明显影响。而血压升高的发生率在使用含EPO 的治疗组中明显高于其他未含EPO 的治疗组。血压升高作为EPO 治疗的不良反应既往文献已证实,故不做赘述。此外,所有治疗组均未出现肝肾功能损害,因此,本研究证实使用多虑平75 mg/d用以治疗ACD,其不良反应发生率低,不良反应轻微,临床使用较安全。
作者之前曾假设多虑平可通过拮抗H1受体,从而间接抑制IL-6及后续Hepcidin的表达而改善ACD 铁代谢异常。本研究之所以选择多虑平在于其抗H1受体的作用是传统抗组胺药苯海拉明的100倍,是赛庚啶的11倍,其与H1受体的结合力为一般抗组胺药的800 倍。然而,尽管通过对治疗前后Hepcidin及IL-6 血清水平的测定表明治疗后的Hepcidin 及IL-6确实较治疗前明显降低,但其降低的趋势并不足以解释(1)单用多虑平后,IL-6及Hepcidin水平与A 组及C组无明显差 异;(2)IL-6 及Hepcidin 降 低 的 趋 势 与Hb 变 化 趋 势 不 一致。因此,作者推测多虑平与EPO 联用的协同增强效应可能源于某些未知机制。如前所述,ACD 贫血的机制与铁代谢失衡(Hepcidin升高导致机体的铁吸收障碍,失利用)、机体EPO分泌减少及对EPO 敏感性下降、红细胞寿命降低有关[10-12]。结合之前EPO 与多虑平联合使用时的协同增强效应,作者推测多虑平是否通过某种未知机制改善机体对EPO 的敏感性(与EPO 联用疗效优于单用EPO)或延长ACD 患者红细胞寿命(与EPO 联用输血后Hb维持时间更长)?后续基于多虑平与ACD 的铁调节网络及EPO、红细胞寿命的相关研究或可对此作出解释。
综上所述,对于重度贫血的ACD 患者,加用多虑平联合EPO 可明显改善贫血,提高输血效率及减少输血次数,其机制除了多虑平的强抗组胺效应所致的IL-6及Hepcidin表达降低外,还可能通过未知的机制及途径改善机体对EPO 的敏感性或延长红细胞寿命。
[1] Barker JN.Role of keratinocytes in allergic contact dermatitis[J].Contact Dermatitis,1992,26(3):145-148.
[2] Tussing-Humphreys L,Pusatcioglu C,Nemeth E,et al.Rethinking iron regulation and assessment in iron deficiency,anemia of chronic disease,and obesity:introducing hepcidin[J].J Acad Nutr Diet,2012,12(3):391-400.
[3] Weiss G,Goodnough LT.Anemia of chronic disease[J].N Engl J Med,2005,352(10):1011-1023.
[4] Nemeth E,Ganz T.Regulation of iron metabolism by hepcidin[J].Annu Rev Nutr,2006,26(1):323-342.
[5] Finkenstedt A,Bianchi P,Theurl I,et al.Regulation of iron metabolism through GDF15and hepcidin in pyruvate kinase deficiency[J].Br J Haematol,2009,144(5):789-793.
[6] Weiss G.Pathogenesis and treatment of anaemia of chronic disease[J].Blood Rev,2002,16(2):87-96.
[7] Means RT.Hepcidin and cytokines in anaemia[J].Hematology,2004,9(5/6):357-362.
[8] 李蓉生.慢性病贫血的诊断及治疗[J].中国实用内科杂志(临床版),2006,26(7):501-503.
[9] 张之南,单渊东,李蓉生,等.协和血液病学[M].北京:中国协和医科大学出版社,2004:209-213.
[10] Sasu BJ,Cooke KS,Arvedson TL,et al.Antihepcidin antibody treatment modulates iron metabolism and is effective in a mouse model of inflammation-induced anemia[J].Blood,2010,115(17):3616-3624.
[11] Gaetano B,Konstantinos M,Riccardo A,et al.Anemia of chronic disease and defective erythropoietin production in patients with celiac disease.[J].Haematologica,2008,93(12):1785-1791.
[12] Mitlyng BL,Singh JA,Furne JK,et al.Use of breath carbon monoxide measurements to assess erythrocyte survival in subjects with chronic diseases[J].Am J Hematol,2006,81(6):432-438.
