血管性痴呆大鼠海马齿状回神经前体细胞增殖的动态变化及养血清脑颗粒的影响
2015-03-04李晶刘颖刘斌罗永伟范颖马原源毛文静李世英
李晶,刘颖,刘斌,罗永伟,范颖,马原源,毛文静,李世英
血管性痴呆大鼠海马齿状回神经前体细胞增殖的动态变化及养血清脑颗粒的影响
李晶,刘颖,刘斌,罗永伟,范颖,马原源,毛文静,李世英
[摘要]目的观察血管性痴呆(VD)大鼠海马齿状回(DG)神经前体细胞(NPCs)增殖的动态变化及养血清脑颗粒的影响。方法72只Sprague-Dawley大鼠随机分为假手术组(n=24)、VD模型组(模型组, n=24)和养血清脑颗粒治疗组(治疗组, n=24),采用改良的Pulsinelli四血管阻断法制作VD大鼠模型。分别在造模术后1、2、4和8周采用Western blotting法检测Nestin的表达水平,用免疫荧光法观察海马齿状回区5-溴脱氧尿嘧啶(BrdU)和BrdU/Nestin的表达。结果模型组和治疗组各时间点大鼠Nestin、BrdU和BrdU/Nestin表达持续增多,4周时达高峰。与假手术组比较,模型组各时间点Nestin、BrdU和BrdU/Nestin表达明显增多(P< 0.01);与模型组比较,治疗组各时间点Nestin、BrdU和BrdU/Nestin表达明显增多(P<0.01)。结论养血清脑颗粒可促进VD大鼠海马齿状回区NPCs增殖。
[关键词]血管性痴呆;神经前体细胞;增殖;齿状回;海马;养血清脑颗粒
[本文著录格式]李晶,刘颖,刘斌,等.血管性痴呆大鼠海马齿状回神经前体细胞增殖的动态变化及养血清脑颗粒的影响[J].中国康复理论与实践, 2015, 21(9): 1025-1030.
CITED AS: Li J, Liu Y, Liu B, et al. Proliferation of neural precursor cells in dentate gyrus of hippocampus and effect of Yangxue Qingnao Granule in vascular dementia rats [J]. Zhongguo Kangfu Lilun Yu Shijian, 2015, 21(9): 1025-1030.
血管性痴呆(vascular dementia, VD)是发生在脑血管疾病基础上的以记忆、认知功能缺损为主的获得性智力持续性损害[1]。目前,在VD的发病机制和诊断方面取得了一定进展,但在治疗方面尚无重大突破[2-4]。养血清脑颗粒是根据中医药理论,以中医传统名方四物汤为基础改良而成的中药复方制剂,具有滋阴养血、平肝潜阳、活血通络的功效[5],临床上应用养血清脑颗粒能明显改善VD患者认知功能和日常生活能力[6],但其具体作用机制尚不明确。巢蛋白(Nestin)是哺乳动物神经系统先祖细胞中的一种主要细胞骨架蛋白,在成年大鼠及成人脑内广泛存在,为神经前体细胞(neural precursor cells, NPCs)的标记物[7-9]。本研究通过检测大鼠海马齿状回(dentate gyrus, DG)Nestin、5-溴脱氧尿嘧啶(5-bromodeoxyuridine, BrdU)的表达,观察VD大鼠海马齿状回NPCs增殖的动态变化及养血清脑颗粒对其表达的影响,探讨养血清脑颗粒治疗VD的可能作用机理。
1 材料与方法
1.1实验动物与器材
健康雄性Sprague-Dawley(SD)大鼠72只,体质量250~280 g,3月龄,由北京华阜康生物科技股份有限公司供给,合格证号SCXK(京)2013-0013。在华北理工大学屏障环境动物实验室自由进食喂养,室温(23± 2)℃,自然光照,实验前适应喂养2周。
养血清脑颗粒,国药准字Z10960082,批号130366:天津天士力制药股份有限公司。山羊血清封闭液、多聚赖氨酸溶液:北京博奥森生物技术公司。兔抗大鼠Nestin抗体:Eter Life公司。小鼠抗BrdU抗体:BD公司。DyLigh™488标记羊抗鼠IgG和DyLigh ™594标记羊抗兔IgG:KPL公司。
低温离心机:SIGMA公司。电凝仪:张家港航天医疗电器有限公司。切片机:上海亿欣生物科技有限公司。Morris水迷宫:淮北正华生物仪器设备有限公司。
1.2方法
1.2.1动物分组
将大鼠编号,用随机数生成器随机抽取不同数字,将大鼠分为假手术组、VD模型组(模型组)和养血清脑颗粒治疗组(治疗组),在模型制备成功后又随机分为造模术后1周、2周、4周和8周4个亚组,每个亚组6只。
1.2.2模型制备
采用改良的Pulsinelli四血管阻断(4-VO)法制作VD大鼠模型[10]。术前禁食12 h,10%水合氯醛350 mg/kg腹腔注射麻醉,背侧行颈正中切口,暴露双侧第一颈椎横突小孔。将直径0.5 mm的电凝针插入双侧翼小孔烧灼双侧椎动脉。大鼠仰卧位固定,行腹侧颈正中切口,分离双侧颈总动脉,以4号丝线穿线。24 h后用微动脉夹夹闭双侧颈总动脉5 min,共夹闭3次,每次间隔1 h。缝合切口。继续常规饲养观察。假手术组操作步骤同上,但不烧灼和夹闭血管。术后大鼠予庆大霉素1×104U/kg腹腔注射,连续3 d。
1.2.3给药方法
造模成功后灌胃给药,每日1次。假手术组、模型组予生理盐水10 ml/kg;治疗组将养血清脑颗粒用蒸馏水配成0.32 g/ml混悬液,10 ml/kg灌胃[11]。连续给药1、2、4、8周。
1.3学习记忆能力测定
大鼠分别于灌胃给药后1、2、4、8周行Morris水迷宫试验,观察穿越平台次数。
1.4BrdU标记
大鼠处死前1 d腹腔注射%生理盐水溶液50 mg/ kg (10 g/L),注射3次,间隔4 h;取脑前2 h注射第4次。
1.5Western blotting检测
Morris水迷宫试验后,大鼠10%水合氯醛350 mg/kg腹腔注射麻醉,断头后于冰上开颅取脑,用冷PBS漂洗残余血,立即分离出新鲜海马。海马组织置于15 ml离心管中,组织匀浆机12000 r/min匀浆15 s,加入4℃预冷组织裂解液,振荡混匀,4℃作用30 min;细胞悬液4℃12 000 r/min离心10 min,留取上清液4℃保存。
蛋白定量后分装,用4℃PBS调蛋白浓度750 μg/ml,加入等体积上样缓冲液,沸水煮至少5 min。等量蛋白样品(每个泳道50µg)经10%十二烷基硫酸钠-聚丙烯酸铵凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS- PAGE)电泳分离后,以湿转法电转移至聚偏二氟乙烯(polyvinylidene fluoride, PVDF)膜上。转移后的PVDF膜放入封闭液中封闭,加入兔抗大鼠Nestin一抗(1∶1000) 4℃孵育过夜。PBS洗膜,加入二抗(1∶2000),37℃反应1 h;洗膜,ECL显色,胶片曝光显影,结果用Image J软件分析。以Nestin蛋白与β-actin蛋白的相对光密度(OD)进行半定量分析。
1.6免疫荧光检测
Morris水迷宫试验后,大鼠10%水合氯醛350 mg/kg腹腔注射麻醉,暴露心脏,左心室快速灌注盐水100 ml,持续灌注4%多聚甲醛-PBS 100 ml,断头取脑,4%多聚甲醛-PBS固定过夜。冠状面切断包含海马的脑组织(视交叉后),石蜡包埋,5 μm连续切片。
免疫荧光检测方法按照试剂盒操作说明书进行。石蜡切片脱蜡,水化组织切片,加入正常羊血清封闭。分别加入BrdU一抗(1∶100)和Nestin一抗(1∶200)的混合液,4℃过夜。次日加入相应二抗混合液(1∶200),室温避光孵育1 h,PBS洗10 min,共3次。以0.01 mol/L PBS代替一抗作为阴性对照。OLYMPUS BX53显微镜下观察并拍照。应用图像分析系统计数大鼠海马齿状回区BrdU、BrdU/Nestin阳性细胞数。每只大鼠随机选取海马齿状回区各3张切片,随机取6个非重叠视野,取平均值。
荧光显微镜下,细胞核出现绿色颗粒者为BrdU阳性细胞,蓝光激发时呈绿色的为BrdU阳性细胞,黄光激发时呈红色的为Nestin阳性细胞。BrdU/Nestin融合后胞膜呈红色,胞核呈绿色。
1.7统计学分析
用SPSS 17.0统计软件进行数据分析。所得数据以(xˉ±s)表示。多组数据间比较采用单因素方差分析,两两比较采用LSD-t检验。显著性水平α=0.05。
2 结果
2.1一般情况
造模后4周左右,大鼠出现VD行为学改变,其中5只由于病情过重淘汰,另有3只死亡。均给予相应补充。
2.2学习记忆能力
与假手术组比较,模型组大鼠穿越平台次数明显减少(P<0.01);与模型组比较,治疗组大鼠穿越平台次数明显增加(P<0.01)。见表1。
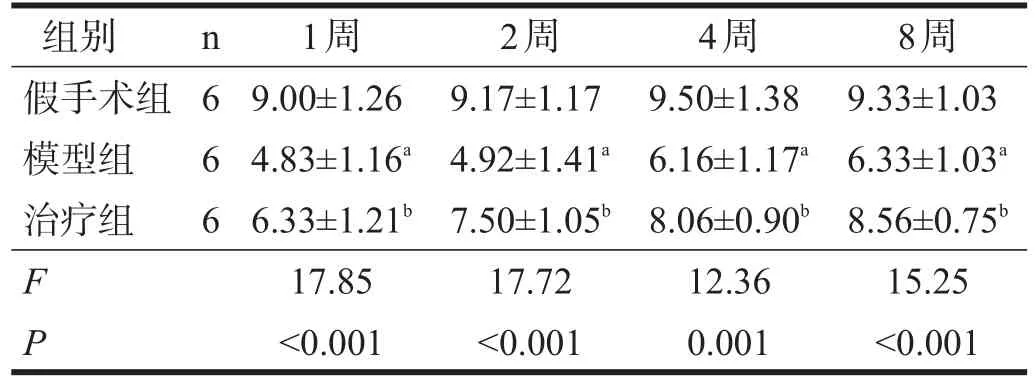
表1 各组大鼠穿越平台次数比较
2.3Western blotting
假手术组各时间点可见少量Nestin表达。模型组各时间点Nestin表达增多,4周时达高峰。与假手术组相比,模型组各时间点Nestin表达明显增多(P< 0.01)。治疗组各时间点Nestin表达较模型组明显增加(P<0.01)。见表2。
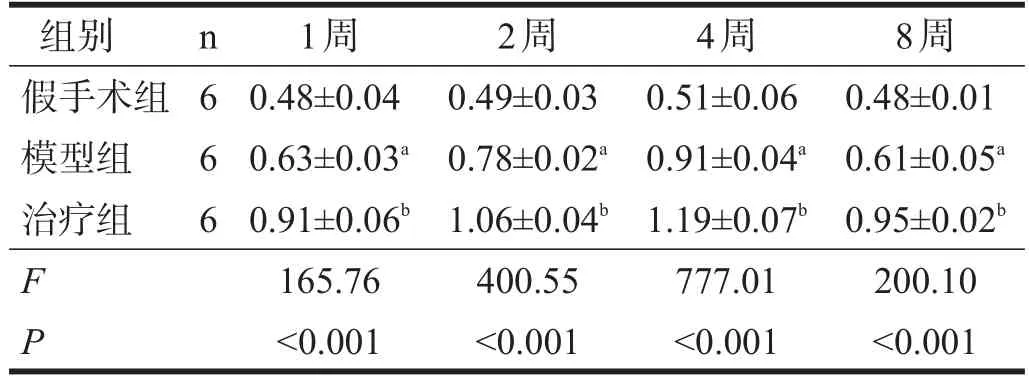
表2 各组大鼠海马齿状回Nestin比较(OD)
2.4免疫荧光
假手术组各时间点可见少量BrdU阳性细胞,呈散在分布。模型组各时间点BrdU阳性细胞表达增多,沿着海马区齿状回的颗粒下区呈线状非连续排列,局部可见阳性细胞堆积;1周时即有多量表达,2周时大量表达,4周时达高峰,8周时开始下降但仍较高。与假手术组相比,模型组各时间点BrdU阳性细胞数明显增多(P<0.01)。治疗组各时间点BrdU阳性细胞数较模型组明显增多(P<0.01)。见表3和图1。
选择增殖反应最明显的第4周作为观察点。假手术组大鼠海马齿状回可见少量BrdU/Nestin阳性细胞,平均(5.00±1.79)个/高倍视野(HD)。模型组和治疗组BrdU/Nestin阳性细胞数明显增多,主要分布在颗粒细胞下层(图2)。模型组BrdU/Nestin阳性细胞数(23.50±2.35)个/HD,较假手术组明显增多(P<0.01);治疗组BrdU/Nestin阳性细胞数(33.50±1.87)个/HD,较模型组明显增加(P<0.01)。
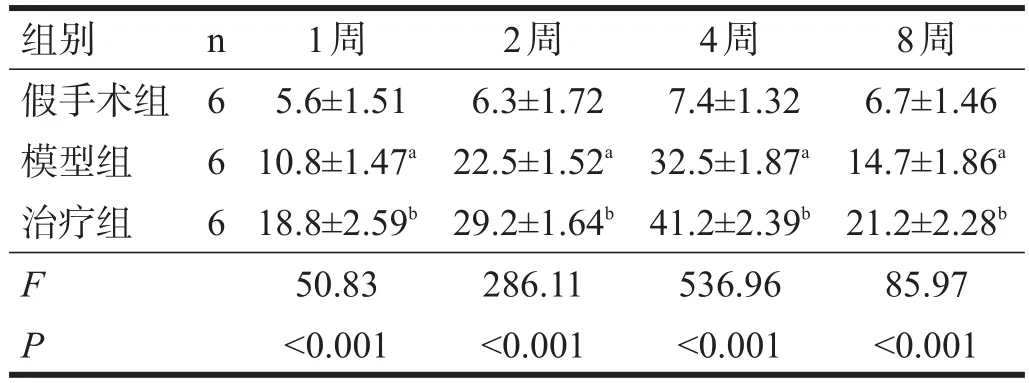
表3 各组大鼠海马齿状回BrdU阳性细胞数比较(/HD)
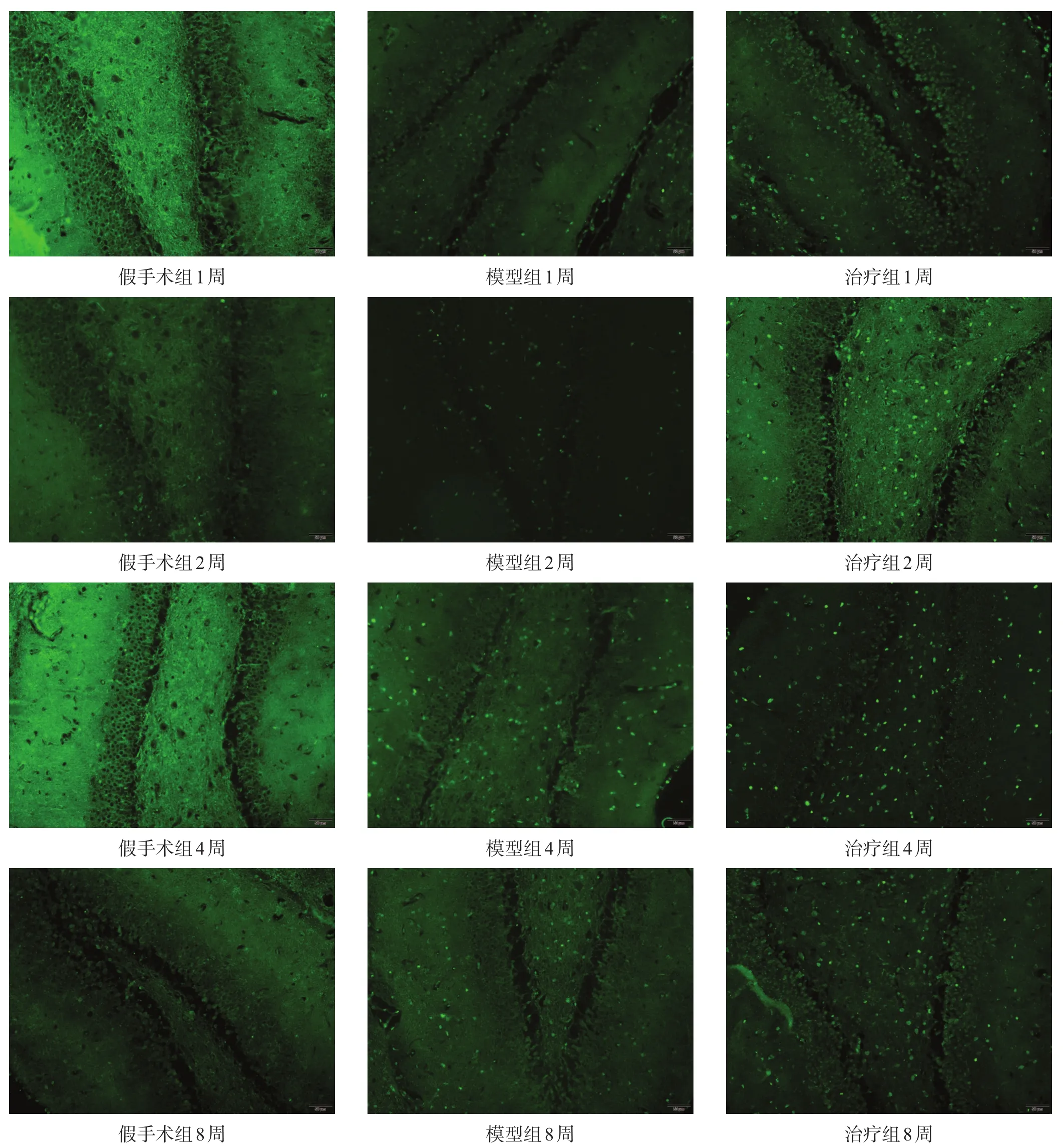
图1 各组大鼠海马齿状回BrdU免疫荧光染色(400×)
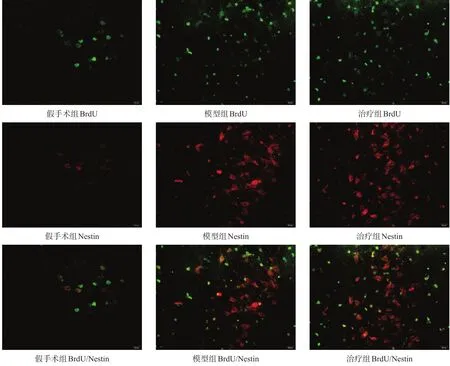
图2 各组给药后4周大鼠海马齿状回BrdU/Nestin免疫荧光染色(400×)
3 讨论
VD的基础疾病是脑血管疾病,慢性脑缺血是VD发生的主要病因之一[12]。本研究采用的4-VO法,是目前国内外公认的理想的VD动物模型,已被广泛用于VD治疗的研究。Morris水迷宫测试表明,模型组大鼠跨越平台的次数明显减少,提示造模成功;予养血清脑颗粒治疗,大鼠穿越平台次数增加,表明养血清脑颗粒能改善VD大鼠学习记忆能力。
在成年哺乳动物及人类中枢神经系统中,特别是在海马齿状回颗粒下层存在着具有增殖分化潜能的NPCs[13],可分化发育成神经元和神经胶质细胞,以补充和替代神经细胞的损伤和缺失,发挥内源性修复作用[14]。
Nestin是构成细胞骨架的一种中间丝蛋白,属于第Ⅳ类中间丝蛋白,为Hockfield和Mckay在大鼠胚胎脊髓神经管NPCs表达的蛋白中发现一种能被anti-nestin抗体特异性识别的蛋白[15]。Nestin分布在细胞质内,在神经胚胎形成阶段特异性表达于神经内皮干细胞,并在NPCs进行神经元终末分化后开始下降,并随细胞成熟而停止表达。体外培养Nestin阳性细胞可分化出神经元与胶质细胞的前体细胞,常被用来作为NPCs的标记物[8]。
BrdU是一种胸腺嘧啶脱氧核苷类似物,在细胞增殖周期的S期嵌入细胞核DNA中,可随细胞的进一步分裂、分化,进入分裂后的子细胞中,直至分化成熟依然存在,并永久标记在细胞内[16]。BrdU阳性细胞数基本可代表脑内NPCs的发生水平,BrdU阳性细胞被看作是具有增殖活性的细胞[17]。
本研究显示,模型组各时间点大鼠海马齿状回区Nestin、BrdU和BrdU/Nestin表达均增多,说明VD大鼠海马齿状回区NPCs呈激活状态,被诱导增殖分化的神经细胞大量表达Nestin,与文献报道一致[18-19]。
NPCs具有分化成神经元和神经胶质细胞的潜能,参与神经修复过程,可能在治疗各种中枢神经系统疾病,包括神经变性疾病、脱髓鞘病、脑血管病方面有益[20-21]。研究发现,增加大鼠海马区Nestin阳性细胞对细胞具有保护作用,能促使缺血再灌注后功能恢复[22]。
养血清脑颗粒主要由川芎、当归、白芍、钩藤、熟地黄、鸡血藤、决明子、夏枯草、细辛、延胡索、珍珠母组成,在改善软脑膜微循环、增加脑血管量、减轻脑损伤等方面具有显著效果[23]。养血清脑颗粒具有养血活血、平肝潜阳的作用,标本兼治,符合中医治疗VD的要求。作为现代中药复方制剂,养血清脑颗粒具有多靶点、多环节、整体性调节机体的特点。文献报道,养血清脑颗粒能抑制神经细胞凋亡,保护神经元缺血性损害[24-25]。本研究显示,养血清脑颗粒治疗后,大鼠海马齿状回区Nestin、BrdU表达增加,提示促进VD大鼠海马齿状回区内源性NPCs增殖分化,且随着用药时间的延长,作用更明显。这可能是养血清脑颗粒发挥VD治疗作用的机制之一。
[参考文献]
[1] Liu B, Tang J, Zhang JX, et al. Autophagy activation aggravates neuronal injury in the hippocampus of vascular dementia rats [J]. Neural Regen Res, 2014, 9(13): 1288-1296.
[2]姜敏,刘斌.脑卒中患者认知障碍研究进展[J].中国康复医学杂志, 2010, 25(3): 289-292.
[3]刘斌,唐静,袁敏,等.血管性痴呆大鼠海马CA1区自噬及微管相关蛋白1轻链3的表达[J].第二军医大学学报, 2013, 34 (9): 940-945.
[4]刘金霞,马原源,刘斌,等.微管相关蛋白1轻链3II与微管相关蛋白2在血管性痴呆大鼠海马CA1区的表达[J].中国康复理论与实践, 2015, 21(5): 497-500.
[5]张玲,褚扬,马晓慧,等.养血清脑颗粒的药理作用研究进展[J].医学综述, 2011, 17(5): 769-771.
[6]沈玉梅.养血清脑颗粒治疗血管性痴呆临床评价[J].药物与临床, 2012, 23(12): 1482-1483.
[7] Hermann A, Maisel M, Wegner F, et al. Multipotent neural stem cells from the adult tegmentum with dopaminergic potential develop essential properties of functional neurons [J]. Stem Cells, 2006, 24(4): 949-964.
[8] Almazam G, Vela M, Molina-Holgado E, et al. Re-evaluation of nestin as a marker of oligodendrocyte lineage cells [J]. Miciosc Res Tech, 2001, 52(6): 753-756.
[9]任新,朱建华.巢蛋白在脑内的表达[J].解剖学研究, 2014, 36 (6): 460-462.
[10]刘斌,毛文静,李爱春,等.参芎化瘀胶囊对血管性痴呆大鼠海马CA1区p38丝裂原活化蛋白激酶表达的影响[J].中国实验方剂学杂志, 2010, 16(8): 161-164.
[11]陶涛,秦新月,徐广会.养血清脑颗粒对大鼠缺血再灌注损伤后轴突再生及RGMa表达的影响[J].第三军医大学学报, 2013, 35(70): 635-638.
[12]刘斌,唐静,袁敏,等.自噬在血管性痴呆发病中的作用研究[J].临床神经病学杂志, 2013, 26(6): 424-429.
[13] Fuentealba LC, Obernier K, Alvarez-Buylla A. Adult neural stem cells bridge their niche [J]. Cell Stem Cell, 2012, 10(6): 698-708.
[14]邢艳,崔晓萍,余资江,等.脑缺血再灌注后小鼠海马神经前体细胞的增殖[J].解剖学杂志, 2008, 31(1): 43-46.
[15] Courts S, Vernerey J, Pujadas L, et al. Reelin controls progenitor cell migration in the healthy and pathological adult mouse brain [J]. PLoS One, 2011, 6(5): e20430.
[16]黄燕,王景周,张涛,等.促红细胞生成素对血管性痴呆大鼠神经干细胞增殖分化的影响[J].第三军医大学学报, 2009, 31 (9): 805-808.
[17] Romanko MJ, Rothstein RP, Levison SW. Neural stem cells in the subven tricular zone are resilient to hypoxia/ischem ia whereas progenitors are vulnerable [J]. J Cereb Blood Flow Metab, 2004, 24(7): 814-825.
[18]韦云飞,赵伟佳,郝永楠,等.黄芪注射液对缺血后脑组织神经干细胞增殖和分化的影响[J].临床神经病学杂志, 2012, 25 (3): 192-195.
[19] Shen CC, Yang YC, Chiao MT, et al. Characterization of endogenous neural progenitor cells after experimental ischemicstroke [J]. Curr Neurovasc Res, 2010, 7(1): 6-14.
[20] Lindvall O, Kokaia Z. Stem cells in human neurodegenerative disorders-time for clinical translation? [J]. Clin Invest, 2010, 120(1): 29-40.
[21]王济潍,陈文,王玉良. EGB761对血管性痴呆大鼠海马齿状回神经干细胞增殖分化的影响[J].神经解剖学杂志, 2012, 28 (6): 589-594.
[22] Yu DQ, Pei HT, Zhang PH, et al. Effects of electroacupunctureon the expression of nestin in endogenous neural stem cell in hippocampus in rats with focal cerebral ischemia-reperfusion [J]. Zhongguo Zhen Jiu, 2010, 30(11): 929-932.
[23] Xiong L, Zhang JJ, Sun D, et al. Therapeutic benefit of Yangxue Qingnao Granule on cognitive impairment induced by chronic cerebral hypoperfusion in rats [J]. Chin J Integr Med, 2011, 17(2): 134-140.
[24]梁迎春,杨海燕,赵林,等. p38MAPK参与血管性痴呆大鼠海马细胞凋亡机制研究及养血清脑颗粒的保护作用[J].中华临床医师杂志(电子版), 2014, 8(6): 1104-1108.
[25]楼小亮,席秋江,胡雪勇,等.养血清脑颗粒对大鼠脑缺血再灌注损伤后神经干细胞增殖分化的影响[J].中国神经精神疾病杂志, 2014, 40(7): 394-399.
·综述·
Proliferation of Neural Precursor Cells in Dentate Gyrus of Hippocampus and Effect of Yangxue Qingnao Granule in Vascular Dementia Rats
LI Jing, LIU Ying, LIU Bin, LUO Yong-wei, FAN Ying, MA Yuan-yuan, MAO Wen-jing, LI Shi-ying
First Department of Neurology, Hospital Affiliated to North China University of Science and Technology, Tangshan, Hebei 063000, China
Abstract:Objective To observe dynamic variation of neural precursor cells in dentate gyrus of hippocampus and effect of Yangxue Qingnao Granule on it in vascular dementia rats. Methods 72 Sprague-Dawley rats were randomly divided into sham group (n=24), vascular dementia group (model group, n=24) and Yangxue Qingnao Granule group (treatment group, n=24). The vascular dementia model was established with modified Pulsineli's four-vessel occlusion. The expression of Nestin was detected with Western blotting, the expression of 5-bromodeoxyuridine (BrdU) and BrdU/Nestin were detected with immunofluorescence in dentate gyrus of hippocampus 1, 2, 4 and 8 weeks after modeling. Results The expression of Nestin, BrdU and BrdU/Nestin increased in the model and treatment groups with time, peaked at 4 weeks after modeling, and it was more than that of the sham group on all the time points (P<0.01). However, it was more in the treatment group than in the model group on all the time points (P<0.01). Conclusion Yangxue Qingnao Granule promotes the proliferation of neural precursor cells in dentate gyrus of hippocampus in vascular dementia rats.
Key words:vascular dementia; neural precursor cells; proliferation; dentate gyrus; hippocampus; Yangxue Qingnao Granule
(收稿日期:2015-05-03修回日期:2015-07-22)
作者简介:作者单位:华北理工大学附属医院神经内一科,河北唐山市063000。李晶(1990-),女,汉族,河北邢台市人,硕士研究生,主要研究方向:脑血管病及认知障碍。通讯作者:刘斌,男,硕士,主任医师,教授,研究生导师。E-mail: liubintsh@126.com。
基金项目:1.河北省高等学校科学技术研究重点项目(No.ZH2012046);2.河北省级重大医学科研课题(No.zd2013087)。
DOI:10.3969/j.issn.1006-9771.2015.09.009
[中图分类号]R743
[文献标识码]A
[文章编号]1006-9771(2015)09-1025-06
