米泔水炮制后射干药材中6种异黄酮类含量的变化
2015-03-04王光函单国顺邹桂欣李国信
李 锁,王光函,单国顺,邹桂欣,李国信
(1.辽宁中医药大学,辽宁 沈阳 110032; 2.辽宁省中医药研究院,辽宁 沈阳 110034)
米泔水炮制后射干药材中6种异黄酮类含量的变化
李 锁1,王光函2,单国顺2,邹桂欣2,李国信2
(1.辽宁中医药大学,辽宁 沈阳 110032; 2.辽宁省中医药研究院,辽宁 沈阳 110034)
目的考察米泔水炮制前后射干药材中6种异黄酮类成分的含量变化。方法采用高效液相色谱(HPLC)法测定射干生品及米泔水炮制品中射干苷、野鸢尾苷、鸢尾黄素、鸢尾甲黄素A、鸢尾甲黄素B、野鸢尾黄素的含量,流动相为乙腈-0.1磷酸水(每100 mL含甲基- -环糊精和2-羟丙基- -环糊精各0.375 g),梯度洗脱。结果射干药材经米泔水炮制后,射干苷及野鸢尾苷等苷类成分含量降低,而鸢尾黄素、鸢尾甲黄素A、鸢尾甲黄素B、野鸢尾黄素等苷元含量有所增加。结论米泔水炮制后射干中6种异黄酮类成分的含量均发生了变化,可促使异黄酮苷类成分向异黄酮苷元类成分转化。
射干;米泔水;射干苷;野鸢尾苷;鸢尾黄素;鸢尾甲黄素A;鸢尾甲黄素B;野鸢尾黄素
射干为鸢尾科植物射干 Belamcanda Chinensis(L)DC.的干燥根茎,主要有清热解毒、利咽消痰、散血消肿等功效,为治疗喉痹咽痛之要药[1]。其临床主要用于治疗上呼吸道感染、慢性咽炎、扁桃体炎、慢性鼻窦炎、支气管炎、哮喘、肺气肿、肺心病、咽喉肿痛和痰盛咳喘等[2]。射干根茎中主要含有异黄酮类化合物[3-4],包括射干苷及其苷元、鸢尾黄素、野鸢尾苷及其苷元、野鸢尾黄素、次野鸢尾黄素,鸢尾甲黄素 B、鸢尾甲黄素A、白射干素等成分[5-8],射干苷及野鸢尾苷口服后,在体内肠道菌群作用下转变为其相应苷元而发挥疗效。临床常用品种是生射干,传统理论认为,米泔水炮制方法能进一步增强其清热解毒的功效,并能去除药材中所含过多油脂,减少药物的辛燥气味,有调理脾胃、增进食欲的作用。《本草分经》载,米泔水性味甘、凉,无毒,有清热凉血、止烦渴、利小便、解毒等功效;《雷公炮炙论》载:“射干,凡使,先以米泔水浸一宿。漉出,用堇竹叶煮,从午至亥,漉出,日干用之。”[9]但关于米泔水炮制法中异黄酮类成分含量变化尚未见详细报道。本试验中采用高效液相色谱(HPLC)法考察了米泔水炮制前后射干药材中6种异黄酮类成分的含量变化,旨在从化学成分的角度解析射干米泔水炮制方法的原理,为米泔水制射干药材提供理论依据。
1 仪器与试药
Agilent 1100型高效液相色谱仪(Chemstation色谱工作站,美国Agilent公司);KQ250DB型超声波发生器(昆山市超声仪器有限公司);FA1004型万分之一电子天平(上海上天精密仪器有限公司);CSIO型电热鼓风干燥箱(重庆试验设备厂)。对照品射干苷(中国食品药品检定研究院,批号为111607-200402);野鸢尾苷、野鸢尾黄素(成都普瑞法科技公司,批号分别为13030803,13051402);鸢尾甲黄素 A、鸢尾甲黄素B(江苏永健医药科技有限公司,批号分别为20140724,20140616);鸢尾黄素(成都生物科技有限公司,批号为12081808);乙腈、磷酸均为色谱纯,水为娃哈哈纯净水(杭州娃哈哈集团公司),其余试剂为分析纯;所购药材经辽宁中医药大学李峰教授鉴定为射干 Belamcanda Chinensis(L.)DC.的根及根茎。
2 方法与结果
2.1 样品制备
射干药材准备:取同一批射干药材,用四分法取样,分为6等份,每份100 g,分别作为试验用生品及米泔水炮制品,各平行3份。
米泔水制射干:取江米100 g,加水1 200 mL,第1次淘米水弃去;再加水1 200 mL,充分搅拌,漉出,即得米泔水。取射干药材3份,每份加入上述制得的米泔水100 mL,25℃室温浸泡过夜,取出药材,并于65℃干燥至干。
2.2 水分测定
取干燥后射干生品及炮制品粉碎,过65目筛。用烘干法[10]测定2种样品的含水量。结果生品含水量为4.64%、米泔水炮制含水量为5.17%。
2.3 含量测定
2.3.1 色谱条件
色谱柱:Phenomenex C18柱(250 mm×4.6 mm,4 μm);流动相:乙腈-0.1%磷酸溶液(每100 mL含有甲基-β环糊精和2-羟-丙基-β环糊精各0.375 g),梯度洗脱见表 1;进样量:10 μL;流速:1.0 mL/min;检测波长:265 nm;柱温:30℃。典型高效液相色谱图见图1。

表1 梯度洗脱时间表
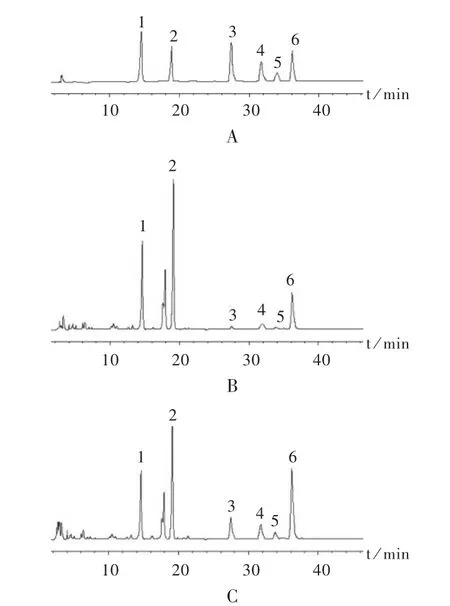
图1 射干药材米泔水炮制前后典型高效液相色谱图
2.3.2 溶液制备
取射干生品粉末1 g(n=3),精密称定,置100 mL具塞三角烧瓶中,分别精密加入 70%乙醇 25 mL,密塞,称定质量。超声(250 W,50 kHz)提取30 min,冷却,称重,用70%乙醇补足减失的质量,摇匀,滤过,用0.22 μm微孔滤膜过滤,取续滤液,即得供试品溶液。取射干苷、野鸢尾苷、鸢尾黄素、鸢尾甲黄素A、鸢尾甲黄素B、野鸢尾黄素对照品适量,用甲醇制成混合对照品贮备溶液,质量浓度分别为 0.595 7,0.434 7,0.540 5,0.095 4,0.316 3,0.325 3 g/L;精密吸取混合对照品贮备液1 mL,置10 mL容量癣中,用 70%乙醇稀释至刻度,摇匀(质量浓度分别为 59.57,43.47,54.05,9.54,31.63,32.53 μg/mL),即得混合对照品溶液。2.3.3 方法学考察
线性关系考察:分别精密量取混合对照贮备液1,2,4,6,8,10,12 μL进样,以峰面积(Y)为纵坐标、溶液进样质量(X)为横坐标进行线性回归。结果见表2。
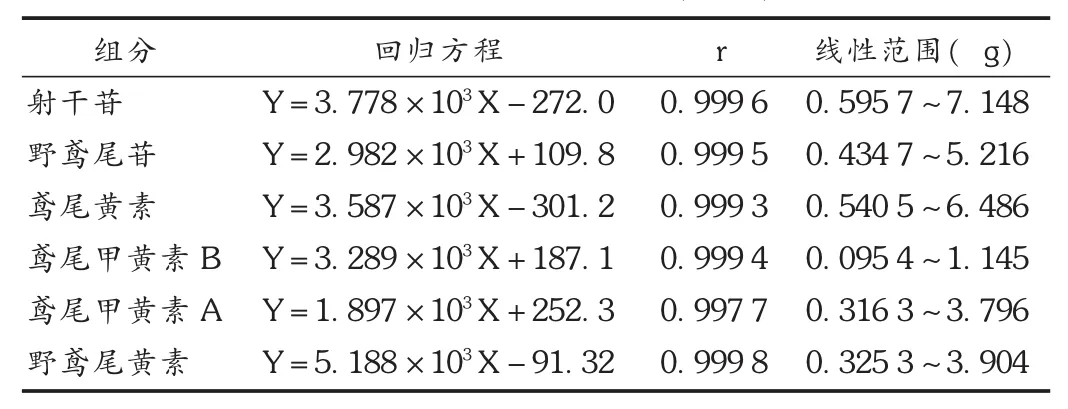
表2 线性关系考察结果(n=6)
精密度试验:精密吸取混合对照品溶液20 μL,按拟订色谱条件连续进样6次,测定峰面积。结果射干苷、野鸢尾苷、鸢尾黄素、鸢尾甲黄素 A、鸢尾甲黄素 B、野鸢尾黄素的 RSD分别为1.18%,1.03%,0.94%,1.08%,1.88%,1.29%(n=6),表明仪器精密度良好。
稳定性试验:精密吸取同一供试品溶液10 μL,按拟订色谱条件,分别于0,2,4,8,12,24 h时进样测定。结果射干苷、野鸢尾苷、鸢尾黄素、鸢尾甲黄素 A、鸢尾甲黄素 B、野鸢尾黄素峰面积的 RSD分别为1.31%,1.76%,1.63%,2.01%,1.98%,1.47%(n=6),表明供试品溶液在24 h内稳定性良好。
重复性试验:取射干药材粉末1 g,精密称定,平行6份,依法制备供试品溶液,按拟订色谱条件测定。结果样品中射干苷、野鸢尾苷、鸢尾黄素、鸢尾甲黄素B、鸢尾甲黄素A、野鸢尾黄素的含量分别为15.500,6.654,8.650,2.123,3.278,5.085 mg/g,RSD分别为1.52%,1.18%,1.33%,1.89%,2.04%,1.58%(n=6),表明该方法重复性良好。
加样回收试验:精密称取已测知含量的射干药材粉末(1号)9份,每份约0.5 g,精密称定,分别精密加入含6种对照品的混合溶液1.2,1.0,0.8 mL(射干苷7.802 g/L、野鸢尾苷3.412 g/L、鸢尾黄素 4.398 g/L、鸢尾甲黄素 B 1.085 g/L、鸢尾甲黄素 A 1.718 g/L、野鸢尾黄素2.635 g/L,所有溶液均用DMSO溶解),每种质量浓度制备3份。依法制备所需溶液,分别进样并加样测定含量。结果见表3。
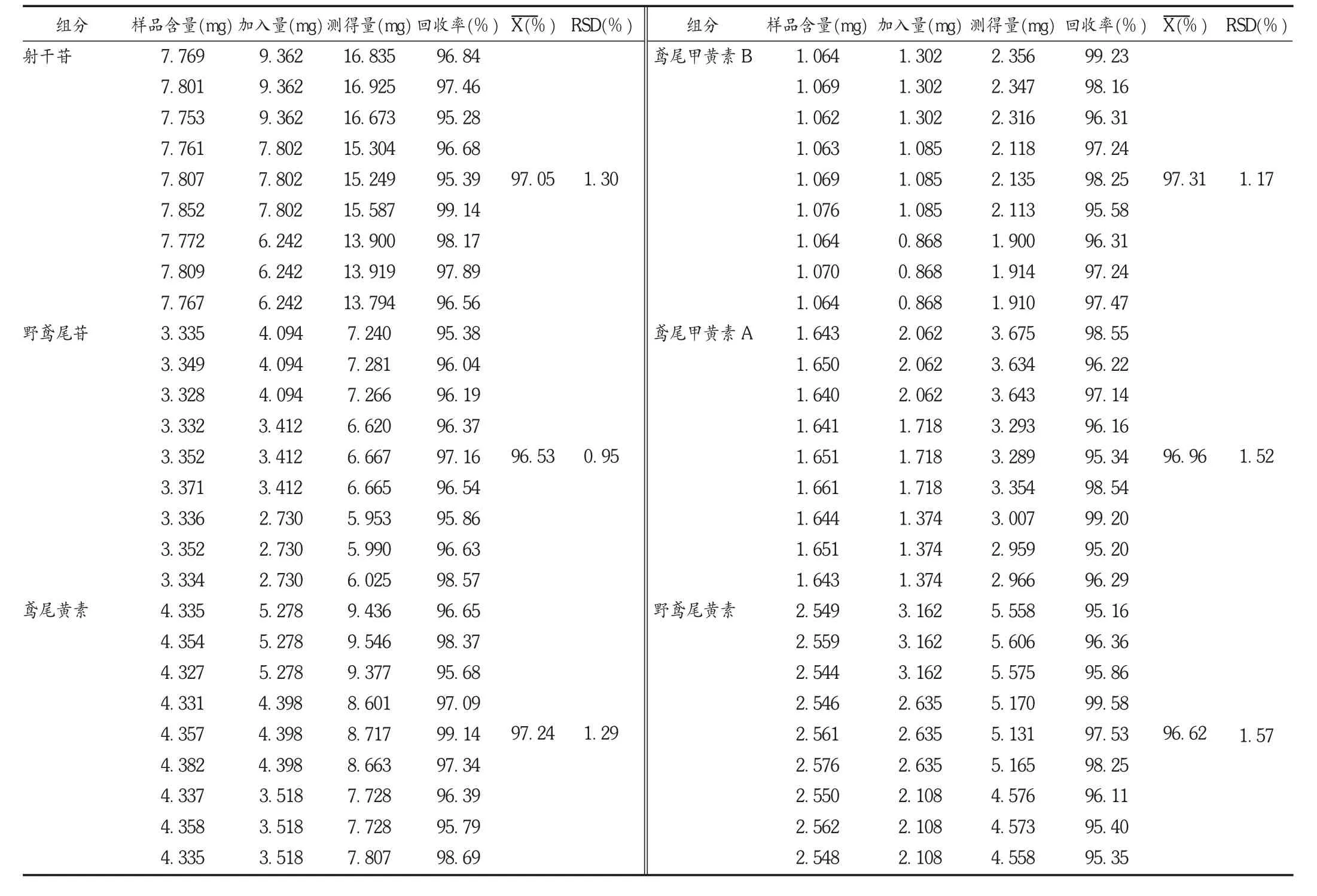
表3 射干中6种活性成分加样回收试验结果(n=9)
2.3.4 样品含量测定
分别取射干生品及米泔水炮制品各1 g,精密称定,依法制备供试品溶液,按拟订色谱条件测定并计算。结果见表4。
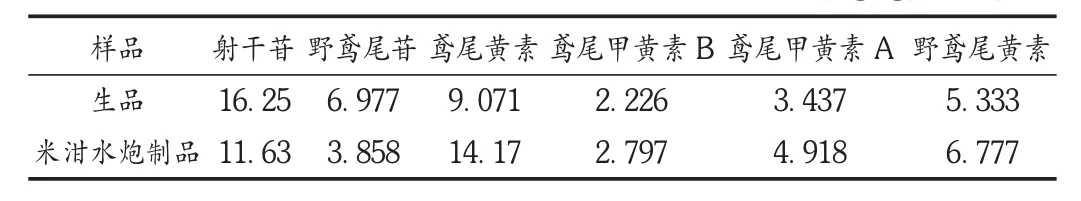
表4 射干米泔水炮制前后6种成分含量测定结果(mg/g,n=3)
3 讨论
曾采用乙腈-0.1%磷酸水为流动相进行分离,但由于射干药材中异黄酮类成分较复杂,鸢尾甲黄素A与药材中的另一异黄酮成分野鸢尾黄素结构相近,只差1个甲氧基,在0.1%磷酸水为水相的峰上,两者无法分开。Hirlekar等[11]报道,加入β-环糊精大环类物质可使异黄酮类成分的性质发生变化,β-环糊精甲基化后破坏了其分子内氢键,且甲基无立体阻碍,扩大了其疏水空腔,使其具有更强的包合特性,环糊精引入甲基和2-羟丙基等功能基团后,不但改变了其部分物理性质,还改变了其化学结构,从而使结构相近的鸢尾甲黄素A和野鸢尾黄素得到较好的分离,故择乙腈-0.1%磷酸水(每100 mL含有甲基-β环糊精和2-羟-丙基-β环糊精各0.375 g)作为流动相。
射干药材经米泔水炮制后,6种异黄酮类成分均发生了一定的变化。射干苷及野鸢尾苷等苷类成分含量降低,而鸢尾黄素、鸢尾甲黄素 A、鸢尾甲黄素 B、野鸢尾黄素等苷元含量有所增加。可见,米泔水炮制法对射干的化学成分含量影响较大,本试验结果对进一步研究射干化学成分含量的影响因素提供了参考依据。
[1]秦民坚,吉文亮,王峥涛.中药射干的化学与药理研究进展[J].国外医药·植物药分册,2000,15(2):57.
[2]钟 鸣,关旭俊,黄柄生,等.中药射干研究进展[J].中药材,2001,24(12):904-906.
[3]刘声音,王 静.射干中多种异黄酮类化合物HPLC检测含量研究方法的建立[J].辽宁中医药大学学报,2012:6(14):217-219.
[4]刘合刚.野生射干与栽培射干化学成分的定性比较[J].时珍国医国药,2001,12(8):685-686.
[5]张晓瑞,张婧涵,李国信,等.主成分分析法用于射干药材评价研究[J].中国药业,2014,23(14):37-38.
[6]邱鹰昆,高玉白,徐碧霞,等.射干异黄酮类化合物的分离与结构鉴定[J].中国药物化学杂志,2006,16(3):175-177.
[7]秦民坚,吉文亮,王峥涛.射干的化学成分研究(Ⅱ)[J].中草药,2004,35(5):487-489.
[8]刘健英,金 丽.射干化学成分及药理研究进展[J].药学服务与研究,2008,8(5):358-361.
[9]南北朝·刘 宋,雷 学.雷公炮炙论[M].南京:江苏科学技术出版社,1985:33.
[10]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2010:附录52,283-285.
[11]Hirlekar R,Kadam V.Preparation and characterization of inclusion complexes of carvedilol with methyl-P-cyclodextrin[J].Journal of Inclusion Phenomena and Macrocyclic Chemistry,2010,63(3-4):219-224.
Changes of 6 Isoflavone Contents In Rice Water after Processing of Belamcanda Chinensis
Li Suo1,Wang Guanghan2,Shan Guoshun2,Zou Guixin2,Li Guoxin2
(1.Liaoning University of TraditionalChinese Medicine,Shenyang,Liaoning,China 110032; 2.Liaoning Research Institute of Chinese Medicine, Shenyanng,Liaoning,China 110034)
Objective To determine the changes of 6 isoflavone contents in Belamcanda Chinensis by using rice water before and after processing.M ethods HPLC was used to determine the changes of tectoridin iridin,tectorigenin,iristectorigenin A,iristectorigenin B and irigenin contents Belamcanda Chinensis and rice water before and after processing.The mobile phase was acetonitrile-0.1% phosphoric acid(each 100 mL contains 0.375 g methyl-βcyclodextrin and 2-hydroxypropyl-βcyclodextrin)gradient elution.Results After rice water processing,the contents of aglycone,such as tectoridin and iridin etc.in Belamcanda Chinensis decreased and the contents of tectorigenin,iristectorigenin A,iristectorigenin B and irigenin ect.aglycone increased.Conclusion After using rice water processing,the contents of isoflavone contents in Belamcanda Chinensis were changed and prompt isoflavone glycosides composition to composition of isoflavone glycosides metaclass.
Belamcanda Chinensis;rice water;tectoridin;iridin;tectoridin;iristectorigenin A;inistectorigenin B;irigenin
R282.71;R284.1
A
1006-4931(2015)21-0010-04
李锁,在读硕士研究生,主要从事中药分析研究工作,(电话)024-86803182(电子信箱)973007794@qq.com;李国信,博士研究生,研究员,博士研究生导师,主要从事中药新药开发研究工作,本文通讯作者,(电话)024-86803184(电子信箱)yying_65@126.com。
2015-06-17)
国家“十二五”重大新药创制项目“中药新药临床技术平台评价研究技术平台”,项目编号:2012zx09303-017;国家自然基金资助项目,项目编号:81273927。
