禽多杀性巴氏杆菌C48-1株OmpA基因表达与抗原性鉴定
2015-03-02高明燕胡茂志沈欣悦
高明燕,胡茂志,沈欣悦,周 生,徐 步
(1.中国农业科学院家禽研究所,江苏扬州225125;2.扬州大学
江苏省物质微区与性能测试服务中心,江苏扬州 225009)
禽多杀性巴氏杆菌C48-1株OmpA基因表达与抗原性鉴定
高明燕1,胡茂志2,沈欣悦1,周 生1,徐 步1
(1.中国农业科学院家禽研究所,江苏扬州225125;2.扬州大学
江苏省物质微区与性能测试服务中心,江苏扬州 225009)
为了研究禽多杀性巴氏杆菌(Pm)外膜蛋白A(OmpA)的免疫原性,根据C48-1菌株OmpA基因序列设计一对特异性引物,采用PCR方法扩增去信号肽的成熟OmpA基因.将去信号肽的成熟OmpA基因扩增片段双酶切后,克隆到pGEX-6p-1表达载体中,构建重组表达质粒pGEX-OmpA,转化宿主菌BL21并经异丙基硫代半乳糖苷(IPTG)诱导表达.SDS-PAGE的结果显示,融合蛋白GST-OmpA大小约为63 ku,与预期的分子质量相符.免疫印迹分析结果表明,该融合蛋白与鸡抗Pm血清具有明显的免疫反应,说明OmpA具有良好的抗原性,这为禽Pm OmpA在免疫防御研究中的应用奠定了基础.
禽多杀性巴氏杆菌;外膜蛋白A;原核表达;免疫印迹
禽霍乱,又称禽巴氏杆菌病、禽出血性败血症,是一种侵害家禽和野禽的急性、败血性传染病,是养禽业中重要的细菌性传染病之一,给养禽业造成了严重的经济损失[1].多杀性巴氏杆菌(Pasteurella multocida,Pm)是禽霍乱的病原菌,主要以荚膜抗原和菌体抗原区分血清型,荚膜抗原分为A、B、D、E、F等5个血清型;菌体抗原分为16(1-16)个血清型[2].禽Pm的血清型主要为A:1、A:3、A:5,我国分离到的菌株血清型以 A:1 为主[2-3].
外膜蛋白A(outermembrane protein A,OmpA)是普遍存在于革兰氏阴性菌表面的蛋白,具有维持细胞膜的稳定性、保证物质运输的功能,并在细菌对宿主的感染、致病和免疫中都起着重要的作用[4].目前,关于革兰氏阴性菌,诸如大肠杆菌、克雷伯氏菌等的OmpA在免疫调节等方面功能的研究与发现较多[5-6],而Pm OmpA的免疫作用以及免疫功能等相关研究还非常少.已知Pm OmpA具有免疫原性,能够在小鼠模型上诱导抗体产生,但在家禽体内的免疫功能和作用还缺乏了解[4].本课题组前期研究发现,国内禽Pm标准强毒株C48-1与其他多个国内禽分离株的OmpA基因序列的同源性高达100%;进一步证实禽Pm OmpA基因序列非常保守[7].因此为进一步深入研究OmpA的功能,本试验选择C48-1菌株,以其OmpA基因为研究对象,进行原核表达和抗原性分析,旨在为禽Pm OmpA的免疫与致病功能研究提供生物材料.
1 材料与方法
1.1 材料
1.1.1 菌种及质粒 C48-1菌株源自中国兽医药品监察所;大肠杆菌DH5α、BL21以及原核表达载体pGEX-6p-1由本课题组保存,pMD18-T购自宝生物工程(大连)有限公司.
1.1.2 试剂 EX-Taq聚合酶、限制性内切酶、连接酶、异丙基硫代半乳糖苷(Isopropylβ-D-1-Thiogalactopyranoside,IPTG)、X-Gal均为宝生物工程(大连)有限公司产品;DNA提取试剂盒、DNA胶回收试剂盒、质粒DNA小量抽提试剂盒、DNA Marker、SOC肉汤、LB肉汤、LB琼脂、氨苄青霉素钠(Amp)等购自生工生物工程(上海)有限公司;预染蛋白Marker购于Fermentas公司;酶标羊抗鸡IgG为Bethyl公司产品;免疫印迹相关试剂均为北京康为世纪生物有限公司产品;鸡抗Pm阳性血清由本课题组制备.
1.2 方法
1.2.1 引物的设计与合成 参考前期测定的C48-1菌株OmpA基因的核苷酸序列,针对成熟蛋白(去掉信号肽)基因设计一对特异性引物,并在上下游引物分别加入BamHⅠ、SalⅠ的酶切位点(下划线),由生工生物工程(上海)有限公司合成.

1.2.2 细菌基因组DNA的制备 将Pm菌株C48-1接种在BHI液体培养基中,于37℃、100 r·min-1振荡培养12 h,按照DNA抽提试剂盒的说明书提取细菌DNA.
1.2.3OmpA基因的扩增 PCR扩增体系50μL,含25μLPremix Ex Taq混合物、1μLDNA模板、上下游引物各2μL、20μL ddH2O.PCR扩增条件:94℃预变性5 min;94℃变性30 s,55℃ 30 s,72℃ 1 min,35个循环;72℃延伸10 min.采用1.2%琼脂糖凝胶电泳鉴定扩增产物.
1.2.4 重组表达质粒的构建及鉴定 用BamHⅠ和SalⅠ双酶切去信号肽OmpA基因扩增产物和pGEX-6p-1质粒,胶回收两个片段后用T4连接酶连接,转化大肠杆菌BL21.挑取阳性克隆,提取质粒,将酶切鉴定正确的重组质粒pGEX-OmpA送金斯瑞生物有限公司测序.鉴定正确的重组菌命名为BL21(pGEX-OmpA).
1.2.5 重组菌的诱导表达 将重组菌BL21(pGEX-OmpA)振荡培养4 h,菌液的D600nm为0.4-0.6时,加入终浓度为0.1 mmol·L-1的IPTG诱导表达4 h.将诱导表达的细菌裂解产物进行SDS-PAGE电泳鉴定,同时用只含有空载体的重组菌BL21(pGEX-6P-1)作为阴性对照.
1.2.6 免疫印迹分析 诱导表达的蛋白经SDS-PAGE分离后,按常规方法转膜;转移后的NC膜在5%的脱脂乳中于4℃封闭过夜,用PBST洗膜3次,每次5 min;加入1∶500倍稀释的鸡抗Pm阳性血清孵育1 h后,弃去一抗,用PBST洗膜3次,每次5 min;再与辣根过氧化物酶标记的羊抗鸡IgG(1∶1000)孵育1 h,然后弃去二抗,用PBST洗膜3次,每次5 min;最后用DAB显色液显色.
2 结果与分析
2.1 OmpA基因的扩增与克隆
用所设计合成的特异性引物扩增C48-1菌株DNA,扩增片段大小为1000 bp,与预期结果一致.随机挑选白色菌落的阳性克隆进行培养,提取质粒,经BamHⅠ和SalⅠ双酶切鉴定,可见2600和1000 bp的条带(图1),与理论结果一致.测序证实,成熟OmpA基因长度为999 bp,序列正确.
2.2 重组表达质粒的鉴定
提取重组表达质粒pGEX-OmpA,经BamHⅠ和SalⅠ双酶切鉴定得到4900和1000 bp两个片段.经测序证实序列与方向正确(图2).

图1 Pm菌株成熟OmpA基因的扩增结果Fig.1 PCR result of Pm strainsmature OmpA gene

图2 重组质粒pMD18T-OmpA和pGEX-OmpA的双酶切鉴定Fig.2 Restriction enzyme analysis of recombinant plasmid pMD18T-OmpA and pGEX-OmpA
2.3 重组菌的诱导表达和表达产物的鉴定
IPTG诱导的重组菌BL21(pGEX-OmpA)的裂解产物经SDS-PAGE电泳后,在63 ku处出现一条特异性蛋白条带,与预期的融合蛋白大小一致;未诱导的细菌未出现明显的蛋白条带;而空载体细菌BL21(pGEX-6P-1)裂解物在26 ku处出现明显的GST条带(图3).免疫印迹结果表明,表达的融合蛋白能够与鸡抗Pm阳性血清呈免疫反应,而空载体对照与阳性血清没有反应条带,由此推定表达的蛋白与细菌菌体的OmpA具有相似的抗原性(图4).
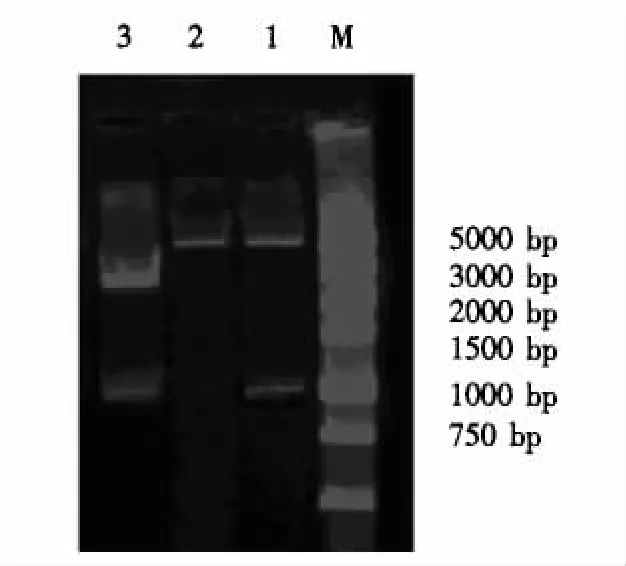
图3 重组菌的SDS-PAGE结果Fig.3 SDS-PAGE of recombinant bacteria
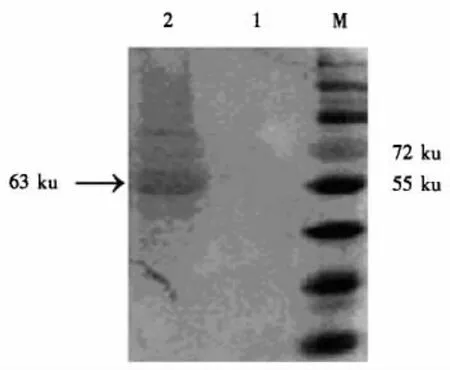
图4 表达产物的免疫印迹分析结果Fig.4 Western blotting analysis of expressing product
3 讨论
Gatto et al[8]研究显示,Pm提纯的OmpA具有很强的免疫原性,能诱导小鼠产生显著的抗体;Dabo et al[9]报道,原核表达的OmpA能够引起小鼠强烈的Th2类免疫反应,诱导产生高水平的IgG1抗体;Lu et al[10]制备的OmpA单克隆抗体被动免疫实验动物的结果表明,攻毒后接种动物死亡率下降.本试验也发现,经原核表达的Pm OmpA能够与Pm鸡抗血清产生免疫反应,说明原核表达的OmpA与细菌本身的OmpA具有相似的抗原位点,能够利用其进行免疫和致病等相关功能的研究.
OmpA属跨膜蛋白,其全基因表达产物(也称前蛋白)由于带有信号肽,能够引导前蛋白整合到大肠杆菌外膜中,从而引起大肠杆菌外膜失去原有的完整性和稳定性,导致大肠杆菌死亡引起表达失败.因此,本试验选择去掉信号肽的成熟OmpA进行表达的方案,因对大肠杆菌不产生干扰作用从而获得了成功表达.
4 结论
本试验成功构建了pGEX-OmpA重组表达质粒,诱导表达了OmpA-GST融合蛋白;免疫印迹分析结果表明,该融合蛋白具有良好的免疫原性,为进一步研究OmpA在疾病防治中的应用奠定了基础.
[1]SAIF Y M.禽病学[M].12 版.苏敬良,高福,索勋,译.北京:中国农业出版社,2012.
[2]DZIVA F,MUHAIRWA A P,BISGAADM,etal.Diagnostic and typing options for investigating diseases associated withPasteurellamultocida[J].Vet Microbiol,2008,128:1 -22.
[3]吴范庚.我国多杀性巴氏杆菌血清学鉴定及交互免疫试验[J].中国兽医杂志,1997,23(8):14-15.
[4]TAMASH,KEITH A H,JOHN D B,et al.Outermembrane proteins ofPasteurella multodida[J].Vet Microbiol,2010,144:1-17.
[5]STEPHEN G J,MAHON SV,MATTHEW A,etal.A molecular Swiss army knife:OmpA strucutre,function and expression[J].FEMSMicrobiol Lett,2007,273:1 -11.
[6]JEANIN P,IOVANIGM,ILIANE LG,et al.outermembrane protein(OmpA):a new pathogen-associated molecular pattern that interactswith presenting cells in pact on vaccine strategies[J].Vaccine,2002,20:24 -27.
[7]高明燕,徐步,龚建森,等.11株禽多杀性巴氏杆菌OmpA基因克隆测序及其序列分析[J].浙江农业学报,2013,25(5):951-956.
[8]GATTO N T,DABO SM,HANCOCK R E,et al.Characterization of,and immune responses ofmice to,the purified OmpA-equivalent outermembrane protein ofPasteurellamultocidaserotype A:3(Omp28)[J].VetMicrobiol,2002,87:221 -235.
[9]DABO SM,CONFER A W,MONTELONGO M,et al.Vaccination withPasteurella multocidarecombinat OmpA induces strong but non-protective and deleterious Th2-type immune response inmice[J].Vaccine,2008,26:4345 -4351.
[10]LU Y S,LAIW C,PAKESP,et al.A monoclonal antibodaies against aPasteurellamultocidaoutermembrane protein protects rabbits and mice against pasteurellosis[J].Infect Immun,1999,59:172 -180.
(责任编辑:施晓棠)
Prokaryotic expression and antigenicity analysis of the OmpA gene of avian Pasteurella multocida strain C48-1
GAO Ming-yan1,HU Mao-zhi2,SHEN Xin-yue1,ZHOU Sheng1,XU Bu1
(1.Poultry Institute,Chinese Academy of Agricultural Sciences,Yangzhou,Jiangsu 225125,China;2.Jiangsu Test and Service Center for Material Microanalysis and Property,Yangzhou University,Yangzhou,Jiangsu 225009,China)
According to the nucleotide sequencing resultof outermembrane protein A(OmpA)gene ofPasteurellamultocida(Pm)C48-1 strain,a pair of primers were designed.ThematureOmpAgene of C48-1 strain was amplified by polymerase chain reaction technique and then cloned into prokaryote expression vector pGEX-6p-1 for sequence analysis.The recombinant plasmid,pGEXOmpA was then transformed intoE.coliBL21.After induction with Isopropylβ-D-1-Thiogalactopyranoside(IPTG),SDS-PAGE and western blotting results showed that the fusion protein GST-OmpA was about63 ku and could be detected by chick serum against Pm.So,itwas suggested that the OmpA protein was a immunodominance antigen in the process of Pm infection and could be used in the study of immune protection against Pm.
avianpasteurellamultocida;outermembrane protein A;prokaryotic expression;Western blotting
S852.61
A
1671-5470(2015)03-0289-04
10.13323/j.cnki.j.fafu(nat.sci.).2015.03.012
2014-01-13
2014-10-11
公益性行业(农业)科研专项(201303044);江苏省家禽科学研究所青年科学基金项目(JQ201102).
高明燕(1978-),女,助理研究员,硕士.研究方向:禽病防治.Email:gmy_stella@sina.com.通讯作者徐步(1964-),男,研究员,硕士.研究方向:禽病防治.Email:bu_xu@yahoo.com.cn.
