过氧化氢对NIH/3T3细胞蛋白磷酸酶2A催化亚基C甲基化的影响
2015-03-02刘银品陆彩玲李习艺
刘银品, 唐 深, 陆彩玲, 秦 富, 孙 斌, 许 扬, 李习艺
(广西医科大学 1. 公共卫生学院营养与食品卫生教研室, 2. 基础医学院, 广西 南宁 530021)
过氧化氢对NIH/3T3细胞蛋白磷酸酶2A催化亚基C甲基化的影响
刘银品1, 唐 深2, 陆彩玲1, 秦 富1, 孙 斌1, 许 扬1, 李习艺1
(广西医科大学 1. 公共卫生学院营养与食品卫生教研室, 2. 基础医学院, 广西 南宁 530021)
目的 探讨过氧化氢(H2O2)对NIH/3T3细胞中蛋白磷酸酶2A催化亚基C(PP2Ac)甲基化的影响。方法 ① H2O20,0.1,1,5,10和25 mmol·L-1刺激NIH/3T3细胞1 h,刃天青还原率检测细胞活性;② Western蛋白印迹法检测H2O20,0.1,1和5 mmol·L-1作用1 h后细胞内去甲基PP2Ac的表达;③ 分别用羧基端甲基酯酶(PME-1)抑制剂AMZ30 0,0.1,0.5,1.0,5.0和10.0 μmol·L-1和抗氧化剂N-乙酰半胱氨酸(NAC)0,0.5,1和5 mmol·L-1预处理细胞30 min,再用H2O21 mmol·L-1作用细胞1 h,Western蛋白印迹法检测细胞内去甲基PP2Ac的表达;④ 免疫荧光实验观察NIH/3T3细胞H2O21 mmol·L-1处理1 h、AMZ30 10.0 μmol·L-1或NAC 1 mmol·L-1分别预处理30 min后再加H2O21 mmol·L-1处理1 h细胞内去甲基PP2Ac的表达。结果 ① 刃天青检测实验结果显示,H2O2对细胞增殖具有显著的抑制作用,浓度≥0.1 mmol·L-1细胞活性显著降低(P<0.01);② Western蛋白印迹检测结果显示,H2O2可致NIH/3T3细胞内去甲基PP2Ac蛋白表达升高,H2O20.1,1和5 mmol·L-1组与空白对照组相比差异有统计学意义(P<0.01);③ Western蛋白印迹结果显示,AMZ30与NAC二者均可拮抗H2O2对细胞内PP2Ac去甲基的作用,与H2O21 mmol·L-1组相比,加入AMZ30 5.0和10.0 μmol·L-1或NAC 1和5 mmol·L-1细胞内去甲基PP2Ac含量明显降低(P<0.01);④ 免疫荧光实验结果显示,加入H2O21 mmol·L-1刺激1 h后,细胞内去甲基PP2Ac的表达要高于正常细胞组,而用AMZ30 10.0 μmol·L-1与NAC 1 mmol·L-1干预后,去甲基PP2Ac表达降低。结论 H2O2可诱导NIH/3T3细胞内PP2Ac去甲基,而PME-1抑制剂AMZ30和抗氧化剂NAC均能拮抗H2O2诱导的PP2Ac去甲基作用。
过氧化氢; 磷蛋白磷酸酶; 甲基化
氧化应激参与多种生理及病理过程,氧化应激产生活性氧自由基造成细胞氧化损伤是多种化学物毒作用的普遍机制之一。H2O2是细胞内主要的活性氧自由基,既可直接造成生物大分子物质的氧化损伤,也可作为第二信使,参与氧化应激相关信号转导途径调控[1]。研究H2O2在细胞分子传导、蛋白调控过程中的作用,对深入理解氧化损伤机制、寻找氧化型损伤的防治靶点具有重要理论及现实意义。蛋白磷酸酶2A(protein phosphatase 2A,PP2A)是一种在细胞内重要而又普遍表达的丝氨酸/苏氨酸磷酸酶,它参与许多重要的细胞进程,如DNA损伤修复[2]、细胞凋亡和抑制癌症信号转导通路[3]等。PP2A由结构亚基A、调节亚基B和催化亚基C(PP2Ac)三部分组成的,其中PP2Ac对PP2A的活性具有重要的调节作用[4]。PP2Ac的结构中含有一段序列高度保守的游离羧基尾巴,其羧基端L309受甲基化修饰调控,可在亮氨酸甲基转移酶的作用下发生甲基化,在羧基端甲基酯酶1(PP2A methylesterase 1,PME-1)的催化下去甲基[5],这种可逆的甲基化作用是调节PP2A生物学功能的重要机制之一,在PP2A活性及其底物特异性调控中具有重要作用[6-7]。研究表明,PP2A是一种氧化敏感型蛋白[8],但氧化应激对PP2Ac甲基化的调控作用尚未明确。Bachovchin等[9-10]通过文库筛查发现了几类能有效抑制PME-1活性的化合物,它们能与PME-1共价结合,特异性抑制其活性而不影响其他蛋白功能,为了解氧化应激在PP2Ac甲基化调控的机制提供了研究思路。本研究以NIH/3T3细胞为研究对象,用H2O2制备细胞的氧化应激模型,探讨H2O2诱导的氧化应激对PP2Ac甲基化修饰的调控以及PME-1抑制剂AMZ30和抗氧化剂N-乙酰半胱氨酸(N-acetyl-L-cysteine, NAC)对其的拮抗作用。
1 材料与方法
1.1 试剂和主要仪器DMEM培养基(美国Gibco公司),新生小牛血清(中国杭州四季青公司),AMZ30(德国Merck公司),NAC(中国碧云天公司),去甲基化PP2Ac抗体(ab32104)和总PP2Ac抗体(ab32065,英国Abcam公司),β肌动蛋白、辣根过氧化物酶标记羊抗兔IgG(ZB-5301)和羊抗鼠IgG(ZB-5305,中国中杉金桥),刃天青(resazurin, 美国Sigma公司),0.45 nm NC膜(美国Millipore公司),30% H2O2和其余试剂均为国产分析纯。Forma 3111型CO2恒温培养箱和Multiskan GO全波长酶标仪(美国Thermo公司),垂直电泳槽和伯乐通用型电泳仪Biorad Powerpac Universal(美国Bio-Rad公司),Ti-s倒置生物显微镜(日本Nikon公司)。
1.2 细胞和培养NIH/3T3细胞由广西医科大学实验中心提供,用含10%新生小牛血清的DMEM培养基在37℃,5%CO2培养箱中培养,实验选用对数生长期细胞。
1.3 刃天青检测NIH/3T3细胞存活[11] 取NIH/3T3细胞接种于96孔板中,每孔100 μL(约含细胞数1×104),分成6个组,分别用PBS及H2O2 0.1,1,5,10和25 mmol·L-1处理1 h,设8个复孔,染毒结束后取出96孔板,吸出原培养基,用PBS洗涤1次,最后各孔加入100 μL含0.001%刃天青的培养液继续放入培养箱孵育2~4 h,用酶标仪在双波长570和600 nm下检测吸光度(A)值,计算细胞相对活性。细胞相对活性(%)=给药组A/对照组A×100%。
1.4 Western 蛋白印迹法检测NIH/3T3细胞去甲基PP2Ac和总PP2Ac蛋白的表达将NIH/3T3细胞接种于6孔板中,待细胞铺满底壁>80%后分别给予PBS及H2O2 0.1,1和5 mmol·L-1处理1 h,染毒结束后弃上清,提取蛋白,将裂解液收集于1.5 mL EP管,振荡器振荡1 min,10 000×g离心30 min,BCA法进行定量后,加入等体积2×上样缓冲液(mL: 20%SDS 40;甘油10;1.0 mol·L-1 Tris-HCl 25, pH 6.8;β-巯基乙醇5;加ddH2O定容至100)混匀,放入-20℃备用。配置4%浓缩胶和10%分离胶,上样(各组取25 μg),100 V电泳90 min,100 V转膜1 h,用含5%脱脂奶粉的PBST封闭30 min,以β肌动蛋白为内参,一抗4℃孵育6 h或过夜,PBST漂洗3次,二抗室温孵育2 h,PBST漂洗3次,ECL显色,凝胶成像系统拍照,条带用Image j软件进行分析,以目标蛋白与内参蛋白积分吸光度比值,表示蛋白相对表达水平。实验重复3次。
1.5 Western 蛋白印迹法检测AMZ30和NAC干预后细胞内去甲基PP2Ac和总PP2Ac蛋白的表达将细胞分成9组,各组先分别用PBS,AMZ30 0.1,0.5,1.0,5.0和10.0 μmol·L-1及NAC 0.5, 1和5 mmol·L-1预处理30 min,然后再在各培养基中加入终浓度为1 mmol·L-1的H2O2继续培养1 h,染毒结束后弃上清,提取蛋白,按1.4进行蛋白检测。
1.6 免疫荧光法检测去甲基PP2Ac在细胞内表达将细胞接种于6孔板,其中4个孔中,每孔1.5 mL(约含细胞数1×104),放入培养箱过夜,待细胞完全贴壁后进行分组处理,其中2组分别用AMZ30 10 μmol·L-1和NAC 1 mol·L-1预处理30 min,然后加入H2O2 1 mmol·L-1继续培养培养1 h,设正常细胞组作为空白对照。染毒结束后弃上清,4%多聚甲醛固定30 min,PBS洗3次,0.5% TritonX-100透化30 min,PBS洗3次,5%脱脂奶粉封闭1 h,一抗4℃ 4 h,PBS洗3次,二抗室温避光孵育2 h,PBS洗3次,DAPI避光孵育15 min,PBS洗1次,荧光显微镜拍照。

2 结果
2.1 H2O2对NIH/3T3细胞存活的影响刃天青还原率实验结果(表1)显示,随着H2O2浓度增加,NIH/3T3细胞增殖抑制越明显,与正常细胞对照组相比,H2O2 0.1,1,5,10和25 mmol·L-1处理细胞1 h后,细胞存活率显著降低(P<0.01)。
Tab.1 Effect of H2O2on NIH/3T3 cell viability
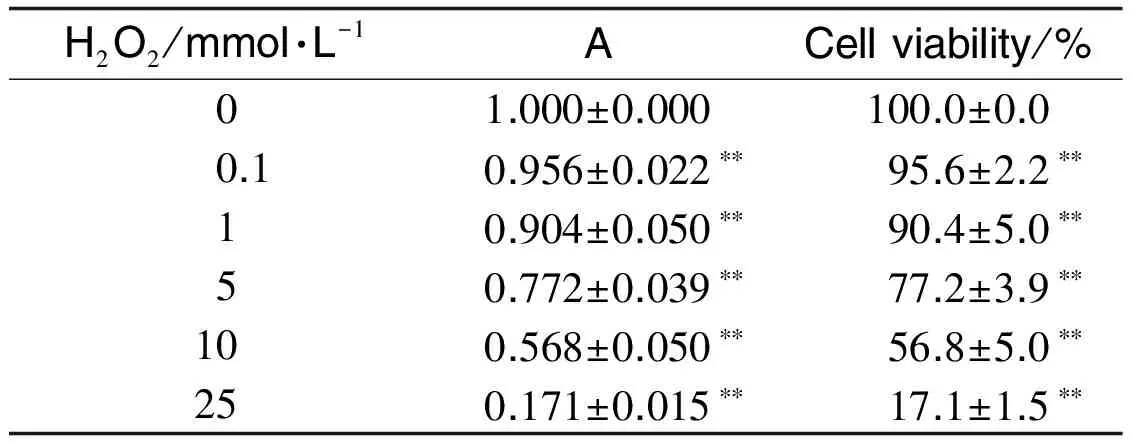
H2O2/mmol·L-1ACellviability/%01.000±0.000100.0±0.00.10.956±0.022∗∗95.6±2.2∗∗10.904±0.050∗∗90.4±5.0∗∗50.772±0.039∗∗77.2±3.9∗∗100.568±0.050∗∗56.8±5.0∗∗250.171±0.015∗∗17.1±1.5∗∗


2.2 H2O2对NIH/3T3细胞PP2Ac甲基化的影响Western蛋白印迹结果显示(图1),与正常细胞组相比,各H2O2浓度组细胞内去甲基化PP2Ac表达明显增加(P<0.01),而细胞内总PP2Ac表达未见明显变化,提示细胞内PP2Ac在氧化应激调控下自身会发生去甲基化,但其总量并不会有改变。

2.3 AMZ30和NAC对H2O2诱导的细胞内PP2Ac去甲基的影响Western蛋白印迹结果(图2)所示,AMZ30可抑制H2O2对细胞内PP2Ac去甲基化的作用,与单独H2O2处理组相比,AMZ30 5和10 μmol·L-1预处理组细胞内去甲基PP2Ac表达显著下调(P<0.01),对总PP2Ac表达无影响(数据略)。提示PME-1参与了氧化应激调控时PP2Ac的去甲基作用。
Western蛋白印迹结果显示(图3),与单独H2O2处理组相比, NAC 1及5 mmol·L-1预处理组细胞内去甲基PP2Ac表达显著降低(P<0.01),总PP2Ac无变化。说明NAC可抑制H2O2对细胞内PP2Ac的去甲基作用。
2.4 AMZ30和NAC对H2O2诱导的细胞内去甲基PP2Ac表达的影响由图4可见,加入H2O2 1 mmol·L-1刺激1 h,细胞内去甲基PP2Ac荧光强度增强(图4A1);而AMZ30和NAC预处理后再给予H2O2 刺激,则细胞内去甲基PP2Ac荧光强度明显低于单独H2O2刺激(图4C1,D1),与Western蛋白印迹实验结果一致。


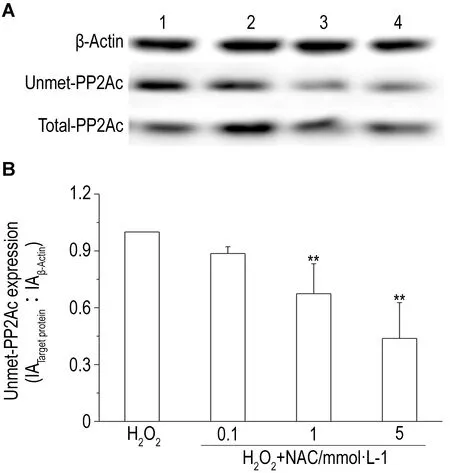

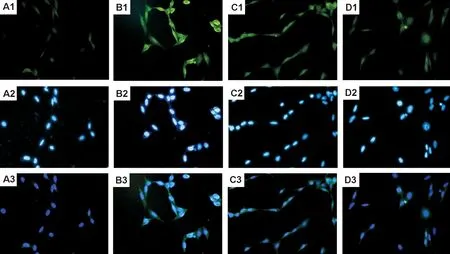
Fig.4 Expression of unmet-PP2Ac in NIH/3T3 cells by immunofluorescence analysis (×400). A: normal control group; B: H2O21 mmol·L-1group; C: H2O21 mmol·L-1+AMZ30 10 μmol·L-1group; D: H2O21 mmol·L-1+NAC 1 mmol·L-1group. 1: un-methylated PP2Ac; 2: DAPI; 3: merge pictures of 1 and 2.
3 讨论
本研究结果显示,H2O2能对NIH/3T3细胞造成明显的氧化损伤作用,使细胞存活率下降,细胞内去甲基PP2Ac表达增加,抗氧化剂能可逆性地调控PP2Ac甲基化,提示PP2Ac甲基化在氧化应激信号转导通路中可能具有重要调控作用。有研究显示,PP2A与PP1共调控细胞内约90%的丝、苏氨酸蛋白磷酸化,细胞内约1/3的蛋白受丝、苏氨酸磷酸化调控。此外,PP2A处于信号转导通路的上游,对多条细胞内重要的信号转导途径有调控作用[12]。因此,我们认为PP2Ac甲基化或许可作为敏感的分子开关,受到氧化应激刺激后迅速反应,通过改变PP2A功能及底物特异性,调控下游蛋白磷酸化修饰,从而激活或抑制下游通路,介导生物学功能。PME-1是细胞内催化PP2Ac去甲基的酶。研究显示,PME-1敲除小鼠在围产期死亡[13],提示PME-1对机体的正常发育具有重要作用。本研究结果表明,PME-1受到抑制后再使用H2O2刺激细胞,细胞内的去甲基PP2Ac表达明显受到抑制,说明当细胞发生氧化应激时,PP2Ac会通过自身的甲基化变化来参与细胞的调控。综上所述,PME-1参与H2O2诱导的PP2Ac去甲基,提示PME-1可能成为潜在的氧化型损伤防治靶点,但PME-1在氧化应激反应中的具体作用还有待进一步研究。
[1] Ray PD, Huang BW, Tsuji Y. Reactive oxygen species (ROS) homeostasis and redox regulation in cellular signaling[J].CellSignal, 2012, 24(5):981-990.
[2] Duong FH, Christen V, Lin S, Heim MH. Hepatitis C virus-induced up-regulation of protein phosphatase 2A inhibits histone modification and DNA damage repair[J].Hepatology, 2010, 51(3):741-751.
[3] Mumby M. PP2A: unveiling a reluctant tumor suppressor[J].Cell, 2007, 130(1):21-24.
[4] Bryant JC, Westphal RS, Wadzinski BE. Methylated C-terminal leucine residue of PP2A catalytic subunit is important for binding of regulatory Balpha subunit[J].BiochemJ, 1999, 339(Pt 2):241-246.
[5] Shi Y. Serine/threonine phosphatases: mechanism through structure[J].Cell, 2009, 139(3):468-484.
[6] Li TZ, Xiang BQ. The structure of protein phosphatase 2A and its inhibition of tumorigenesis[J].ProgBiochemBiophys(生物化学与生物物理进展), 2009, 36(2): 133-142.
[7] Xing Y, Li Z, Chen Y, Stock JB, Jeffrey PD, Shi Y. Structural mechanism of demethylation and inactivation of protein phosphatase 2A[J].Cell, 2008, 133(1):154-163.
[8] Rao RK, Clayton LW. Regulation of protein phosphatase 2A by hydrogen peroxide and glutathionylation[J].BiochemBiophysResCommun, 2002, 293(1):610-616.
[9] Bachovchin DA, Mohr JT, Speers AE, Wang C, Berlin JM, Spicer TP,etal. Academic cross-fertilization by public screening yields a remarkable class of protein phosphatase methylesterase-1 inhibitors[J].ProcNatlAcadSciUSA, 2011, 108(17):6811-6816.
[10] Bachovchin DA, Zuhl AM, Speers AE, Wolfe MR, Weerapana E, Brown SJ,etal. Discovery and optimization of sulfonyl acrylonitriles as selective, covalent inhibitors of protein phosphatase methylesterase-1[J].JMedChem, 2011, 54(14):5229-5236.
[11] Li XY, Zhuang ZX, Liu JJ, Yang XH, Wei QZ, Huang HY. Proteomie analysis of adaptive response induced by low concentration of formaldehyde in human embryonic fibroblasts cells[J].ChinJPublicHealth(中国公共卫生), 2007, 23(4):414-415.
[12] Yan L, Mieulet V, Burgess D, Findlay GM, Sully K, Procter J,etal. PP2A T61 epsilon is an inhibitor of MAP4K3 in nutrient signaling to mTOR[J].MolCell, 2010, 37(5):633-642.
[13] Ortega-Gutiérrez S, Leung D, Ficarro S, Peters EC, Cravatt BF. Targeted disruption of the PME-1 gene causes loss of demethylated PP2A and perinatal lethality in mice[J].PLoSOne, 2008, 3(7):e2486.
(本文编辑: 乔 虹)
Effect of hydrogen peroxide on protein phosphatase 2A catalyticsubunit C methylation in NIH/3T3 cells
LIU Yin-pin1, TANG Shen2, LU Cai-ling1, QIN Fu1, SUN Bin1, XU Yang1, LI Xi-yi1
(1.DepartmentofNutritionandFoodHygiene,CollegeofPublicHealth, 2.CollegeofBasicMedicine,GuangxiMedicalUniversity,Nanning530021,China)
OBJECTIVE To investigate the effect of hydrogen peroxide(H2O2) on protein phosphatase 2A catalytic subunit C(PP2Ac) methylation. METHODS After H2O20, 0.1, 1, 5, 10 and 25 mmol·L-1treatment of NIH/3T3 cells for 1 h, the rate of resazurin reduction was observed to determine the cell proliferation while Western blotting was used to detect the expression of un-methylated PP2Ac. PP2A methylesterase (PME-1) inhibitor AMZ30 0, 0.1, 0.5, 1, 5 and 10 μmol·L-1and antioxidant NAC 0, 0.5, 1 and 5 mmol·L-1were used to intervene in the effect of H2O21 mmol·L-1on NIH/3T3 cells. After various treatments, the expression of un-methylated PP2Ac was detected by Western blotting and indirect immunofluorescence. RESULTS Compared with normal control group, H2O20.1, 1, 5 and 25 mmol·L-1significantly decreased the cell proliferation(P<0.01). The expression of un-methylated PP2Ac in NIH/3T3 cells and in H2O20.1, 1 and 5 mmol·L-1groups was significantly increased(P<0.01) compared with normal control group. Western blotting results revealed that both NAC (1 or 5 mmol·L-1) and AMZ30 (5 or 10 μmol·L-1) significantly antagonized the effect of H2O2on PP2Ac(P<0.01). Indirect immunofluorescence results showed that the un-methylated PP2Ac expression of H2O21 mmol·L-1group was higher than that of normal control group, while the expression of PP2Ac methylation was reduced after the use of AMZ30 10 μmol·L-1or NAC 1 mmol·L-1. CONCLUSION H2O2can induce demethylation of PP2Ac in NIH/3T3 cells, while the PME-1 inhibitor AMZ30 and antioxidant NAC can antagonize the methylation of PP2Ac induced by H2O2.
hydrogen peroxide; phosphoprotein phosphatase; methylation
LI Xi-yi, E-mail: leeciyee@163.com
国家自然科学基金(81360428); 广西壮族自治区自然科学基金(2014GXNSFAA118188)
刘银品,硕士研究生,主要从事营养与食品卫生研究。
李习艺, E-mail: leeciyee@163.com
Foundation item: The project supported by National Natural Science Foundation of China(81360428); and Natural Science Foundation of Guangxi Zhuangzu Autonomous Region(2014GXNSFAA118188)
2014-08-04 接受日期: 2015-02-15)
R966
A
1000-3002(2015)02-0272-05
10.3867/j.issn.1000-3002.2015.02.014
--------------------
