厄洛替尼时辰给药对肺癌模型裸鼠的抑瘤作用及作用机制
2015-03-02林萍萍李明春
林萍萍, 李明春, 刘 亮, 刘 宁, 刘 博
(1. 青岛大学医学院药理学系, 山东 青岛 266071; 2. 解放军第401医院药剂科, 山东 青岛 266071)
厄洛替尼时辰给药对肺癌模型裸鼠的抑瘤作用及作用机制
林萍萍1, 李明春2, 刘 亮1, 刘 宁1, 刘 博2
(1. 青岛大学医学院药理学系, 山东 青岛 266071; 2. 解放军第401医院药剂科, 山东 青岛 266071)
目的 探讨厄洛替尼按时辰给药对肺癌裸鼠模型的抑瘤作用及其可能的作用机制。方法 制备HCC827人肺癌细胞皮下移植瘤裸鼠模型,并随机分为6个厄洛替尼组和模型组,每组10只。厄洛替尼组分别在08:00, 12:00, 16:00, 20:00, 24:00及次日04:00 ig给予厄洛替尼5 mg·kg-1,模型组给予与厄洛替尼组等体积分数的溶剂磺丁基醚-β-环糊精溶液。测量21 d内裸鼠肿瘤体积变化,处死裸鼠后剥离肿瘤并称量其质量,实时荧光定量PCR和Western蛋白印迹法检测肿瘤组织中表皮生长因子受体(EGFR)及其下游信号转导通路分子丝裂原激活蛋白激酶(MAPK)以及细胞周期蛋白依赖激酶抑制因子1A(P21Waf1)的mRNA和相关蛋白表达水平。结果 与模型组比较,厄洛替尼08:00和次日04:00组肿瘤体积显著缩小(P<0.05);厄洛替尼08:00,12:00和次日04:00组肿瘤质量显著降低(P<0.05)。与20:00组〔(0.70±0.36)g〕比较,08:00〔(0.30±0.17)g〕和次日04:00〔(0.39±0.29)g〕组裸鼠肿瘤质量显著降低(P<0.05)。08:00组裸鼠肿瘤组织中EGFR和MAPK的mRNA表达水平显著低于20:00组(P<0.05),而P21Waf1 mRNA表达水平显著高于模型组(P<0.05)。厄洛替尼08:00和次日04:00组p-EGFR和p-MAPK蛋白表达显著低于模型组(P<0.05)。结论 厄洛替尼时辰给药对裸鼠移植肺癌的抗肿瘤作用具有时辰节律性,08:00给药组效果最佳,其作用机制可能与EGFR/MAPK/P21Waf1信号转导通路有关。
厄洛替尼; 时辰化疗; 昼夜节律; 信号转导途径; 表皮生长因子
近年来,随着个体化药物治疗的不断发展,小分子靶向治疗药物逐渐成为抗肿瘤领域的研究热点。盐酸厄洛替尼(erlotinib hydrochloride)是一种选择性表皮生长因子受体(epidermal growth factor receptor, EGFR)酪氨酸激酶抑制剂,对EGFR突变型非小细胞肺癌(non-small-cell lung cancer, NSCLC)患者有显著疗效[1]。生物体的昼夜节律变化影响着抗肿瘤药物的功效与毒性,很多药物在不同时间给药获得的效果不同[2]。时辰治疗是在1 d中选择合适的时间给药、使药物功效最大化而毒性最小从而提高治疗效果并减少不良反应的一种治疗方案[3-4]。昼夜节律调节着大多数哺乳动物的生理功能和行为活动,随着对其分子机制及下游信号通路的深入认知,如何更有效地利用现有药物日渐成为研究热点[5-6]。目前,已发现多种细胞毒性抗肿瘤药物具有时辰药理学效应[7-8],但小分子靶向药物的时辰药理学研究较少见。
厄洛替尼对EGFR突变型NSCLC疗效最为显著[9],因而本研究采用EGFR突变型细胞HCC827皮下种植造模。根据小鼠昼夜节律特点及其他时辰药理学研究[10-11]选取6个时辰点,根据药物对裸鼠的半数有效量和预实验结果,选取药效最佳剂量5 mg·kg-1,通过探究盐酸厄洛替尼对肺癌移植瘤裸鼠的时辰药理学作用及其可能的分子机制,为临床合理应用厄洛替尼提供依据。
1 材料与方法
1.1 试剂RPMI 1640培养基(批号: NYL1029,规格:500 mL)、胰蛋白酶(批号:J130049,规格:100 mL)、胎牛血清(批号:NYE0873,规格:500 mL)和青霉素/链霉素双抗(批号:J130043,规格:100 mL)均购自美国HyClone公司;盐酸厄洛替尼片(商品名:特罗凯,意大利Roche S.p.A.公司生产,规格:每片含厄洛替尼150 mg,产品批号:M1028);RNAiso Plus(批号:AKA105)、cDNA提取试剂盒(批号:AK2501)和RNA扩增试剂盒(批号:AK5305)均购自大连TaKaRa公司。
1.2 仪器CB150型CO2培养箱(德国Binder公司);DW-86WHO型-86℃低温保存箱(中国澳柯玛公司);TGL16型台式高速冷冻离心机(长沙英泰仪器有限公司);TL988型荧光定量聚合酶链式反应(PCR)仪(西安天隆公司);910型电泳仪(美国Bio-Rad公司);转膜仪(美国Bio-Rad公司);化学发光成像系统(上海山富科学仪器有限公司)。
1.3 动物SPF级BALB/c裸鼠,♀,4周龄,体质量10~14 g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001。整个实验过程将裸鼠置于严格控制的人工明暗周期(明期:07:00~19:00;暗期:19:00~07:00)环境中喂养,维持环境温度为22~28℃,湿度为40%~60%,自由进食进水。
1.4 细胞培养人非小细胞肺癌细胞HCC827,购于中国科学院细胞库,货号:31800022。将HCC827细胞培养于含10%胎牛血清的RPMI 1640培养基中,置于37℃,CO2体积分数为0.05的培养箱中进行常规培养,每3 d传代1次。
1.5 皮下移植瘤肺癌裸鼠模型制备及分组给药收集对数生长期HCC827细胞,制成细胞悬液,调整细胞悬液浓度至1.0×1010 L-1,于裸鼠右上肢腋下皮下接种0.2 mL细胞悬液,接种4 d后肉眼可见肿瘤形成,即为肿瘤模型制备成功。待肿瘤生长至0.3~0.5 cm3时,将70只造模成功裸鼠随机分为模型组和6个厄洛替尼时辰给药组,每组10只,厄洛替尼组分别在08:00, 12:00, 16:00, 20:00, 24:00和次日04:00 ig给予厄洛替尼混悬液(加入6%磺丁基醚-β-环糊精作为厄洛替尼的增溶剂)5 mg·kg-1,模型组给予等体积的磺丁基醚-β-环糊精溶液。连续给药21 d。
1.6 瘤重和抑瘤率检测自开始给药起,观察裸鼠的活动、精神状态和摄食情况[12]。每3 d用游标卡尺测量各组裸鼠肿瘤最长径与最短径,按照公式“体积=长径×短径2/2”[13]计算肿瘤体积,绘制肿瘤体积变化曲线。第21天相应时辰点处死裸鼠,剥离肿瘤并称瘤质量,按照公式“抑瘤率(%)=(模型组平均瘤质量-实验组平均瘤质量)/模型组平均瘤质量×100%”计算各组抑瘤率。
1.7 实时荧光定量PCR法检测肿瘤组织中EGFR, 丝裂原激活蛋白激酶1(mitogen-activated protein kinase 1, MAPK1)和细胞周期蛋白依赖激酶抑制剂1A(cyclin-dependent kinase inhibitor 1A, P21Waf1)的基因表达
1.7.1 肿瘤组织中总RNA的提取称量超低温冻结的裸鼠肿瘤组织100 mg,迅速转移至液氮预冷的研钵中,用研杵研磨组织,期间不断加入液氮,直至研磨成粉末,充分匀浆后,按照RNA提取试剂盒操作说明书提取总RNA。
1.7.2 逆转录为cDNA按照试剂盒要求,取已提取的总RNA于冰上配制逆转录反应体系,进行逆转录操作,反应条件为37℃,15 min;85℃,5 s。
1.7.3 PCR扩增按照引物合成说明书,将引物稀释为10 μmol·L-1,-20℃保存备用,各引物序列见表1。按PrimeScript RT reagent Kit说明进行实时PCR反应。扩增条件:95℃预变性30 s;95℃变性5 s,55℃退火30 s,72℃延伸30 s,共40个循环。通过PCR反应得到目的基因在各组肿瘤组织中的Ct值,用内参基因GAPDH对目的基因的表达量进行均一化处理。取3次重复结果的平均Ct值,2-ΔΔCt表示基因的相对表达量。
Tab.1 Primer sequences of EGFR,MAPK1,P21Waf1 and GAPDH for real-time quantitative PCR

Gene SequenceLength/bpEGFRF:5′⁃CATCCAGGCCCAACTGTGAG⁃3′20R:5′⁃CAGTGGAAGCCTTGAAGCAGAA⁃3′22MAPK1F:5′⁃CGTTGGTACAGGGCTCCAGAA⁃3′21R:5′⁃CTGCCAGAATGCAGCCTACAGA⁃3′22P21Waf1F:5′⁃TCAAATCGTCCAGCGACCTTC⁃3′21R:5′⁃CATGCCCTGTCCATAGCCTCTAC⁃3′23GAPDHF:5′⁃GCACCGTCAAGGCTGAGAAC⁃3′20R:5′⁃TGGTGAAGACGCCAGTGGA⁃3′19
EGFR: epidermal growth factor receptor;MAPK1: mitogen-activated protein kinase 1;P21Waf1: cyclin-dependent kinase inhibitor 1A;GAPDH: glyceraldehyde-3-phosphate dehydrogenase.
1.8 Western蛋白印迹法检测肿瘤组织中EGFR, p-EGFR, MAPK和p-MAPK蛋白表达
1.8.1 肿瘤组织中总蛋白的提取取100 mg超低温冻存组织于预冷研钵中,用研杵研磨组织,期间不断加入液氮,直至研磨成粉末。加入1 mL裂解液(细胞裂解液∶PMSF∶磷酸酶抑制剂=100∶1∶1)充分匀浆后,冰上静置30 min,高速离心机9139×g,4℃离心10 min收集上清液。BCA法测蛋白含量,加入上样缓冲液配制成相同浓度蛋白样品,95℃煮沸10 min变性,于-80℃保存。1.8.2 聚丙烯酰胺凝胶电泳(SDS-PAGE)及转膜 配制10%SDS-PAGE凝胶,将各组蛋白样品等量上样进行电泳。采用湿法转膜,将各组蛋白转移到PVDF膜上。
1.8.3 抗原抗体反应及显影5%脱脂奶粉封闭2 h后,4℃一抗孵育过夜,PBST洗膜。37℃二抗摇床孵育1 h后PBS洗膜。将PVDF膜放入DAB显影剂和定影剂各150 μL的混合溶液中反应约1 min,置于化学发光凝胶成像仪中显影拍照,用凝胶分析软件Quantity One进行积分吸光度值分析,用目标蛋白与内标蛋白积分吸光度比值表示蛋白的相对表达量。
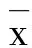
2 结果
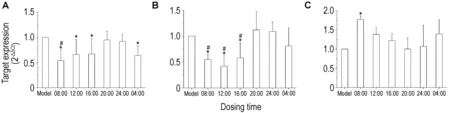
2.1 厄洛替尼时辰给药对肺癌模型裸鼠肿瘤体积的影响由图1可见,模型组肿瘤呈迅速生长趋势,厄洛替尼组裸鼠肿瘤生长较模型组均有所减缓,其中,08:00组肿瘤生长曲线最为平缓,次日04:00组次之,20:00趋势与模型相近。与模型组相比,08:00组和次日04:00组裸鼠21 d内肿瘤体积显著缩小(P<0.05)。
2.2 厄洛替尼时辰给药对肺癌模型裸鼠肿瘤质量的影响由表2可知,与模型组相比,厄洛替尼各给药组肿瘤质量均减小,08:00组裸鼠肿瘤质量最低,04:00组次之(P<0.05)。与20:00组比较,08:00和次日04:00组裸鼠肿瘤质量显著降低(P<0.05)。厄洛替尼08:00组抑瘤率最高,20:00组抑瘤率最低。
Tab.2 Effect of dosing time of erlotinib on tumor mass

GroupTumormass/gGrowthinhibitoryrate/%Model0.74±0.260.008:000.30±0.17∗∗##59.212:000.48±0.34∗34.516:000.61±0.3517.120:000.70±0.365.124:000.59±0.3219.804:000.39±0.29∗#47.7
2.3 厄洛替尼时辰给药对肺癌模型裸鼠肿瘤组织中相关基因表达的影响图2结果显示,与模型组相比,厄洛替尼8:00,12:00和16:00组裸鼠肿瘤组织中EGFR和MAPK1的相对表达量显著降低(P<0.05),但08:00组裸鼠肿瘤组织中P21Waf1的相对表达量明显升高(P<0.05);与20:00组相比,08:00组肿瘤组织中EGFR的相对表达量及08:00, 12:00和16:00组肿瘤组织中MAPK1的相对表达量显著降低(P<0.05)。
2.4 厄洛替尼时辰给药对肺癌模型裸鼠肿瘤组织中相关蛋白表达的影响与模型组相比,厄洛替尼组裸鼠肿瘤组织中EGFR和MAPK蛋白的相对表达量无显著性差异(数据略),但8:00和04:00组p-EGFR和p-MAPK蛋白的相对表达量显著降低(P<0.05)(图3)。


3 讨论
本研究结果表明,在不同时辰点厄洛替尼对EGFR突变型肺癌模型裸鼠的抗肿瘤效果不同,且08:00组疗效最好,这与我们先前药动学的研究结果一致[14]。目前,厄洛替尼的时辰药理学作用机制尚未明确。但此类研究已发现,一些抗肿瘤药物具有时辰药理学作用是其作用靶点及信号转导通路中某些激酶活动呈现节律性所致[10-11]。EGFR是HER家族成员之一,是NSCLC治疗的关键靶点。当配体连接到EGFR的细胞外结构域时,它会与另一EGFR分子或者其他HER家族成员组合成二聚体从而完成自身的磷酸化。磷酸化的EGFR进一步激活其下游的信号转导通路, ERK/MAPK通路即为其中一条,它在调节细胞增殖、凋亡和代谢等多种细胞活动中发挥关键作用[15]。厄洛替尼通过抑制EGFR的自磷酸化而阻断其下游信号转导,从而抑制肿瘤细胞生长增殖。细胞周期调控异常是肿瘤发生发展的重要机制,肿瘤抑制蛋白P21Waf1是ERK/MAPK通路的下游因子,可通过与CDK2复合体结合而抑制G1期细胞周期进程。因此,考虑厄洛替尼的时辰作用机制可能与ERK/MAPK信号转导通路中相关因子呈时辰节律性表达有关。而本研究结果显示,EGFR, MAPK, P21Waf1的基因表达及p-EGFR和p-MAPK蛋白表达的确存在时辰差异。哺乳动物近似昼夜节律的脑内控制机制,目前普遍认为与下丘脑上的视交叉上核(suprachiasmatic nucleus, SCN)有关,它是哺乳动物生物钟的主要振荡器。有研究表明,EGFR和EGFR配体的表达贯穿整个中枢神经系统,在SCN对昼夜节律的调节中发挥重要作用[16-17]。因此,p-EGFR表达呈现节律性的一个可能机制是一些呈现节律性表达的EGF家族配体与EGFR相结合,调节EGFR的二聚化,继而使EGFR的自磷酸化也呈现出一定的时辰节律性[18]。另外,这些EGF家族的配体与EGFR结合的数量可能在各个时辰点有所不同,这也可能引起p-EGFR的节律性表达。而在SCN中,EGFR的活化可引起MAPK的磷酸化[19],因此,本研究结果中p-MAPK蛋白表达与p-EGFR蛋白表达存在相似的趋势。编码EGFR的基因被认为是一种致癌基因[20],EGFR与众多肿瘤生长进程有关。因此,厄洛替尼的抗肿瘤效果存在时辰节律性可能是由于其介导的对EGFR/MAPK信号转导通路的抑制存在时辰变化所致。本研究结果将有助于优化厄洛替尼给药方案,为进一步的临床试验提供参考。然而,各信号转导通路之间错综复杂、交织成网,更为详尽的分子机制仍需深入探究。另外,厄洛替尼主要代谢酶的表达是否具有时辰差异也需进一步研究。
[1] Yap TA, Popat S. Toward precision medicine with next-generation EGFR inhibitors in non-small-cell lung cancer[J].PharmgenomicsPersMed, 2014, 7:285-295.
[2] Smolensky MH, Peppas NA. Chronobiology, drug delivery, and chronotherapeutics[J].AdvDrugDelivRev, 2007, 59(9-10):828-851.
[3] Ortiz-Tudela E, Mteyrek A, Ballesta A, Innominato PF, Lévi F. Cancer chronotherapeutics: experimental, theoretical, and clinical aspects[J].HandbExpPharmacol, 2013, (217):261-288.
[4] Lévi F, Okyar A. Circadian clocks and drug delivery systems: impact and opportunities in chronotherapeutics[J].ExpertOpinDrugDeliv, 2011, 8(12):1535-1541.
[5] Griffett K, Burris TP. The mammalian clock and chronopharmacology[J].BioorgMedChemLett, 2013, 23(7):1929-1934.
[6] Ohdo S, Koyanagi S, Matsunaga N, Hamdan A. Molecular basis of chronopharmaceutics[J].JPharmSci, 2011, 100(9):3560-3576.
[7] Filipski E, Amat S, Lemaigre G, Vincenti M, Breillout F, Lévi FA. Relationship between circadian rhythm of vinorelbine toxicity and efficacy in P388-bearing mice[J].JPharmacolExpTher, 1999, 289(1):231-235.
[8] Patel DM, Jani RH, Patel CN. Design and evaluation of colon targeted modified pulsincap delivery of 5-fluorouracil according to circadian rhythm[J].IntJPharmInvestig, 2011, 1(3):172-181.
[9] Pao W, Chmielecki J. Rational, biologically based treatment of EGFR-mutant non-small-cell lung cancer[J].NatRevCancer, 2010, 10(11):760-774.
[10] Nakagawa H, Takiguchi T, Nakamura M, Furuyama A, Koyanagi S, Aramaki H,etal. Basis for dosing time-dependent change in the anti-tumor effect of imatinib in mice[J].BiochemPharmacol, 2006, 72(10):1237-1245.
[11] Takane H, Ohdo S, Yamada T, Yukawa E, Higuchi S. Chronopharmacology of antitumor effect induced by interferon-beta in tumor-bearing mice[J].JPharmacolExpTher, 2000, 294(2):746-752.
[12] Shen J, Xie Y, Sun ML, Han R, Qin ZH, He JK. Antitumor activity of cobrotoxin in human lung adenocarcinoma A549 cells and following transplantation in nude mice[J].OncolLett, 2014, 8(5):1961-1965.
[13] Perera Y, Toro ND, Gorovaya L, Fernandez-DE-Cossio J, Farina HG, Perea SE. Synergistic interactions of the anti-casein kinase 2 CIGB-300 peptide and chemotherapeutic agents in lung and cervical preclinical cancer models[J].MolClinOncol, 2014, 2(6):935-944.
[14] Liu J, Li MC, Wang PP, Zhang B. Chronopharmacokinetics of erlotinib in tumor-bearing mice[J].ChinJPharmacolToxicol(中国药理学与毒理学杂志), 2014, 28(3): 403-407.
[15] Lin Y, Wang X, Jin H. EGFR-TKI resistance in NSCLC patients: mechanisms and strategies[J].AmJCancerRes, 2014, 4(5):411-435.
[16] Xian CJ, Zhou XF. EGF family of growth factors: essential roles and functional redundancy in the nerve system[J].FrontBiosci, 2004, 9:85-92.
[17] Zak DE, Hao H, Vadigepalli R, Miller GM, Ogunnaike BA, Schwaber JS. Systems analysis of circadian time-dependent neuronal epidermal growth factor receptor signaling[J].GenomeBiol, 2006, 7(6):R48.
[18] Ockenga W, Kühne S, Bocksberger S, Banning A, Tikkanen R. Epidermal growth factor receptor transactivation is required for mitogen-activated protein kinase activation by muscarinic acetylcholine receptors in HaCaT keratinocytes[J].IntJMolSci, 2014, 15(11):21433-21454.
[19] Hao H, Schwaber J. Epidermal growth factor receptor induced Erk phosphorylation in the suprachiasmatic nucleus[J].BrainRes, 2006, 1088(1):45-48.
[20] Berg M, Soreide K. EGFR and downstream genetic alterations in KRAS/BRAF and PI3K/AKT pathways in colorectal cancer: implications for targeted therapy[J].DiscovMed, 2012, 14(76):207-214.
(本文编辑: 乔 虹)
Inhibitory effect of chronopharmaceutical drug delivery of erlotinibin lung cancer nude mice model and its mechanism
LIN Ping-ping1, LI Ming-chun2, LIU Liang1, LIU Ning1, LIU Bo2
(1.DepartmentofPharmacology,MedicalCollege,QingdaoUniversity,Qingdao266071,China;2.PharmacyDepartment, №.401HospitalofPeople′sLiberationArmy,Qingdao266071,China)
OBJECTIVE To investigate the pharmacodynamics of chronopharmaceutical drug delivery of erlotinib in lung cancer model nude mice and its potential mechanism. METHODS A nude mouse model of human lung adenocarcinoma HCC827 cell subcutaneously implanted tumor was established and subsequently the nude mice were randomly divided into 6 erlotinib groups and a model group, with 10 nude mouse per group. Erlotinib groups were respectively gavaged with 5 mg·kg-1erlotinib at 08:00, 12:00, 16:00, 20:00, 24:00 and morrow 04:00, while the model group was given the same volume fraction of captisol. The tumor volume and tumor mass were measured and the tumor growth inhibitory rate was calculated. The mRNA expression of epidermal growth factor receptor (EGFR), mitogen-activated protein kinase (MAPK), cyclin-dependent kinase inhibitor 1A(P21Waf1) and the related protein level were detected by real-time quantitative PCR and Western blotting. RESULTS Compared with model group, the tumor volume and tumor mass of mice at the dosing time of 08:00 and morrow 04:00 were significantly decreased(P<0.05). Compared with dosing time at 20:00 group〔(0.70±0.36)g〕, the tumor mass of 08:00 group〔(0.30±0.17)g〕 and morrow 04:00〔(0.39±0.29)g〕 group was significantly decreased(P<0.05). The mRNA expression of EGFR and MAPK in the tumor group of 08:00 was lower than in group of 20:00(P<0.05), while the mRNA expression of P21Waf1 was significantly higher than that of model group(P<0.05). Compared with model group, the protein expression of p-EGFR and p-MAPK in tumor 08:00 and morrow 04:00 group was negative-regulated significantly(P<0.05). CONCLUSION The antitumor effect of erlotinib on the human lung adenocarcinoma implanted tumor nude mice model presents rhythmicity. The dosing time at 08:00 is the most effective. Its mechanism is likely related to EGFR/MAPK/P21Waf1 signal transduction pathway.Key words: erlotinib; chronochemotherapy; circadian rhythms; signal transduction pathway; epidermal growth factor
LI Ming-chun, Tel: (0531)51870086, E-mail: lmc401y@163.com
林萍萍,女,硕士研究生, 主要从事药理学研究。
李明春,Tel: (0531)51870086, E-mail: lmc401y@163.com
2014-11-02 接受日期: 2015-03-02)
R96,R979.1
A
1000-3002(2015)02-0234-06
10.3867/j.issn.1000-3002.2015.02.008
--------------------
