低浓度p, p′-滴滴涕对大肠腺癌SW620细胞增殖和凋亡的影响
2015-03-02刘建新赵君宇晋小婷李卓玉
刘建新, 赵君宇, 晋小婷, 李卓玉, 宋 莉,2
(1. 山西大学生物技术研究所化学生物学与分子工程教育部重点实验室, 山西 太原 030006;2. 浙江大学环境与资源学院, 浙江 杭州 310058)
低浓度p, p′-滴滴涕对大肠腺癌SW620细胞增殖和凋亡的影响
刘建新1, 赵君宇1, 晋小婷1, 李卓玉1, 宋 莉1,2
(1. 山西大学生物技术研究所化学生物学与分子工程教育部重点实验室, 山西 太原 030006;2. 浙江大学环境与资源学院, 浙江 杭州 310058)
目的 探讨低浓度p,p′-滴滴涕暴露对大肠癌SW620细胞增殖和凋亡的影响及作用机制。方法用p,p′-滴滴涕1×10-12~1×10-6mol·L-1作用于SW620细胞48和96 h后, 采用MTT实验检测细胞存活率。用p,p′-滴滴涕1×10-10, 1×10-9和1×10-8mol·L-1处理SW620细胞96 h后,用流式细胞仪检测细胞周期和细胞凋亡率。Western蛋白质印迹法检测Wnt/β-连环蛋白信号通路成员β-连环蛋白、磷酸化β连环蛋白和磷酸化糖原合成酶激酶3β,下游靶蛋白c-Myc 和细胞周期蛋白D1,以及凋亡相关蛋白Bcl-2、Bax、胱天蛋白酶原8和胱天蛋白酶原3表达水平。结果p,p′-滴滴涕1×10-12~1×10-7mol·L-1作用96 h,明显促进SW620细胞存活(P<0.01);p,p′-滴滴涕1×10-10, 1×10-9和1×10-8mol·L-1处理SW620细胞96 h, 与对照组相比,G1期细胞百分率显著减少(P<0.01),S期细胞百分率显著增加(P<0.01),细胞凋亡率显著降低(P<0.01);Wnt/β-连环蛋白信号通路成员β-连环蛋白和磷酸化糖原合成酶激酶3β以及下游靶蛋白c-Myc和细胞周期蛋白D1水平显著升高(P<0.01),磷酸化β连环蛋白水平显著降低(P<0.01);凋亡相关蛋白Bcl-2、胱天蛋白酶原8和胱天蛋白酶原3表达显著升高(P<0.01),Bax表达和胱天蛋白酶3活性显著降低(P<0.01)。结论 低浓度p,p′-滴滴涕可能通过激活Wnt/β-连环蛋白信号通路及影响凋亡相关蛋白表达,进而促进SW620细胞增殖,抑制 SW620细胞凋亡。
滴滴涕; 大肠癌; Wnt信号通路; β-连环蛋白; Bcl-2; 胱天蛋白酶3
滴滴涕(dichlorodiphenyltrichloroethane,DDT)是一种人工合成的有机氯农药。由于其化学性质稳定,难降解,残留时间长,且可通过食物链蓄积放大,对人类生命健康造成了严重威胁。研究发现,DDT具有生殖发育毒性、免疫毒性、神经毒性、干扰内分泌功能和致癌性[1-5]。近年来,DDT的致癌作用已受到广泛关注。DDT 暴露与多种肿瘤发生密切相关,如乳腺癌、肝癌和胰腺癌等[1-5]。大肠癌是常见的恶性肿瘤,其发生与高脂肪低纤维饮食和遗传因素等有关[6-8]。此外,摄入食物的化学污染也被考虑作为大肠癌发病的一个重要因素[9]。流行病学调查显示,DDT 暴露与大肠癌的发病有关[10-12]。目前关于DDT暴露与大肠癌发病的相关性只限于流行病学研究,对于DDT暴露促进大肠癌发病的分子机制未见报道。研究发现,异常的Wnt/β-连环蛋白信号通路在大肠癌发生和发展中发挥着重要的作用[13-14];同时也有研究表明,在癌症的发生和进展中,细胞凋亡机制的异常具有重要的作用[15-17]。因此,本研究以DDT暴露于大肠癌SW620细胞,检测其对大肠癌SW620细胞增殖和凋亡的影响,并探讨其可能机制。
1 材料与方法
1.1 细胞、药物、主要试剂和仪器人大肠癌细胞SW620购自中国科学院上海分院细胞研究所。p,p′-DDT购自美国Sigma公司。DMEM培养基购自美国Gibco公司;胎牛血清购自杭州四季青生物公司;胰蛋白酶购自中国Solarbio公司;β-连环蛋白抗体购自美国Abmart公司;磷酸化糖原合成酶激酶(glycogen synthase kinase, GSK)3β抗体购自美国Cell Signaling公司;硫酸化β连环蛋白抗体购自英国BBI公司;c-Myc、细胞周期蛋白D1、胱天蛋白酶原8和胱天蛋白酶原3抗体购自美国Bioword公司;α-微管蛋白抗体购自美国Sigma公司;辣根过氧化物酶标记的羊抗鼠IgG(H+L)和羊抗兔IgG(H+L)二抗购自美国Invitrogen公司;胱天蛋白酶3试剂盒购自碧云天生物技术研究所;细胞周期和凋亡试剂盒购自南京凯基生物科技发展有限公司。CO2细胞恒温培养箱,美国Thermo Forma公司;全自动酶标仪、蛋白质电泳仪和电转仪,美国Bio-Rad公司。
1.2 细胞培养和药物配制人大肠癌细胞SW620生长在含有10%胎牛血清、青霉素和链霉素100 kU·L-1的DMEM培养基中,置于37℃,5%CO2细胞培养箱中培养。采用胰酶消化细胞并传代。取对数生长期细胞进行实验。将p,p′-DDT溶于DMSO配成100 mmol·L-1母液。使用时用DMEM培养基稀释至1×10-12~1×10-6 mol·L-1的实验浓度,对照组DMSO浓度为0.1%。
1.3 MTT法检测细胞存活取对数生长期细胞,0.05%胰酶消化,DMEM培养基调整细胞浓度,按1×104 L-1的细胞密度接种于96孔板,每孔加入100 μL,置于37℃,5%的CO2培养箱中贴壁培养24 h后,弃去培养基。实验组用含p,p-DDT 1×10-12~1×10-6 mol·L-1的DMEM培养基孵育, 对照组用含0.1%DMSO的DMEM培养基孵育。处理48和96 h后,每孔分别加入20 μL MTT溶液, 继续置于37℃培养箱孵育4 h。小心吸出孔内培养上清液,每孔分别加入100 μL DMSO置于摇床上振荡10 min,于酶标仪570 nm波长下测定吸光(A)值,每组设5个平行孔。
1.4 流式细胞仪检测细胞周期和细胞凋亡取对数生长期细胞,按照每孔2×105个细胞接种于6孔培养板,培养24 h后弃上清,加入p,p′- DDT 1×10-10, 1×10-9和1×10-8 mol·L-1培养96 h后,胰酶消化,PBS洗涤细胞2次,1000×g离心5 min,弃上清; 70%乙醇4℃固定过夜,PI避光染色30 min,用流式细胞仪检测细胞周期, 每组设3个平行。同时取上述p,p′- DDT暴露后的细胞,按试剂盒说明书分别加入Annexin-FITC和PI,用流式细胞仪检测细胞凋亡率。
1.5 Western蛋白质印迹法检测Wnt/β-连环蛋白信号通路相关蛋白表达取对数生长期细胞,0.05%胰酶消化,DMEM培养基调整细胞浓度,按1×106细胞接种于60 mm培养皿中,置于37℃,5%的CO2培养箱中贴壁培养24 h后,弃去培养基,用含p,p′-DDT 1×10-10, 1×10-9和1×10-8 mol·L-1的DMEM培养基孵育。每48 h换一次培养基,孵育96 h后,加入细胞裂解液裂解10 min,13 000×g离心10 min,收集上清蛋白,用BCA试剂盒测定蛋白浓度。将样品与5×SDS蛋白上样缓冲液以4∶1比例混匀,沸水浴5 min使蛋白变性,每孔80 μg蛋白,于12%SDS-PAGE凝胶电泳分离。电转移蛋白至NC膜,5%脱脂奶粉封闭1 h,分别加入β-连环蛋白抗体(1∶1000),磷酸化GSK3β抗体(1∶1000),磷酸化β-连环蛋白抗体(1∶500),c-Myc抗体(1∶500),细胞周期蛋白D1抗体 (1∶500),胱天蛋白酶原8抗体(1∶1000),胱天蛋白酶原3抗体(1∶1000)和α-微管蛋白抗体(1∶1000) 4℃过夜孵育,然后分别加入辣根过氧化物酶标记的二抗(1∶1000),室温孵育1 h,TBS缓冲液洗膜3次,每次10 min。最后化学发光液显像。实验重复3次。
1.6 荧光分光光度法检测胱天蛋白酶3活性取对数生长期细胞,0.05%胰酶消化,DMEM培养基调整细胞浓度,按1×106细胞接种细胞于60 mm培养皿中,贴壁培养24 h后,弃去培养基,用含p,p′-DDT 1×10-10,1×10-9和1×10-8 mol·L-1的DMEM培养基孵育。每48 h换一次培养基,孵育96 h后,按照半胱氨酸蛋白酶3活性检测试剂盒说明书裂解细胞,Bradford法测定蛋白质浓度(c)。反应体系中加入10 μL裂解物、80 μL检测缓冲液和10 μL 底物Ac-DEVD-pNA,于37℃孵育60 min,然后于酶标仪405 nm波长下测定A值,实验重复3次。一个酶活力单位(U)定义为当底物饱和时,在37℃, 1 h内可以剪切1 nmol Ac-DEVD-pNA产生1 nmol pNA的胱天蛋白酶3的酶量。计算胱天蛋白酶3活性(kU·g-1蛋白)=U/c。

2 结果
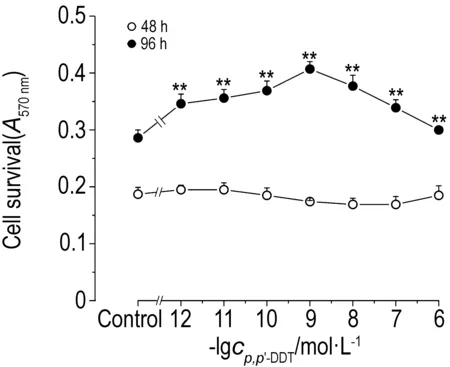
2.1 不同浓度p,p′-DDT对大肠癌SW620细胞存活的影响如图1所示,与细胞对照组相比,SW620细胞经p,p′-DDT 1×10-12~1×10-6 mol·L-1处理48 h后,细胞存活无明显变化。p,p′-DDT 1×10-12~1×10-7 mol·L-1作用96 h后,随着p,p′-DDT浓度的升高,细胞存活率明显升高(P<0.01);在p,p′-DDT 1×10-9 mol·L-1作用下, SW620细胞存活率最高;当p,p′-DDT浓度达到1×10-6 mol·L-1时,SW620细胞存活与对照组相比无明显变化。以上结果表明,p,p′-DDT在低浓度(1×10-12~1×10-7 mol·L-1)作用SW620细胞96 h后,明显促进SW620细胞存活。

2.2 p, p′-DDT对大肠癌SW620细胞周期的影响如图2和表1 所示,与正常对照组相比较,p,p′-DDT 1×10-10, 1×10-9和1×10-8 mol·L-1处理SW620细胞96 h后,G1期细胞百分率明显减少(P<0.01), 同时S期细胞百分率显著增加(P<0.01),表明p,p′-DDT可促使SW620细胞由G1期向S期过渡。
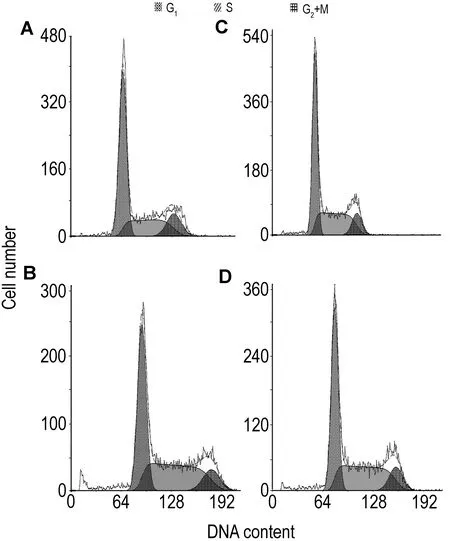
Fig.2 Effect of p,p′-DDT exposure for 96 h on SW620 cell cycle detected by flow cytometry. A: control group; B,C and D:p,p′-DDT 1×10-10, 1×10-9and 1×10-8mol·L-1group, respectively.
Tab.1 Effect of p,p′-DDT exposure for 96 h on SW620 cell cycle
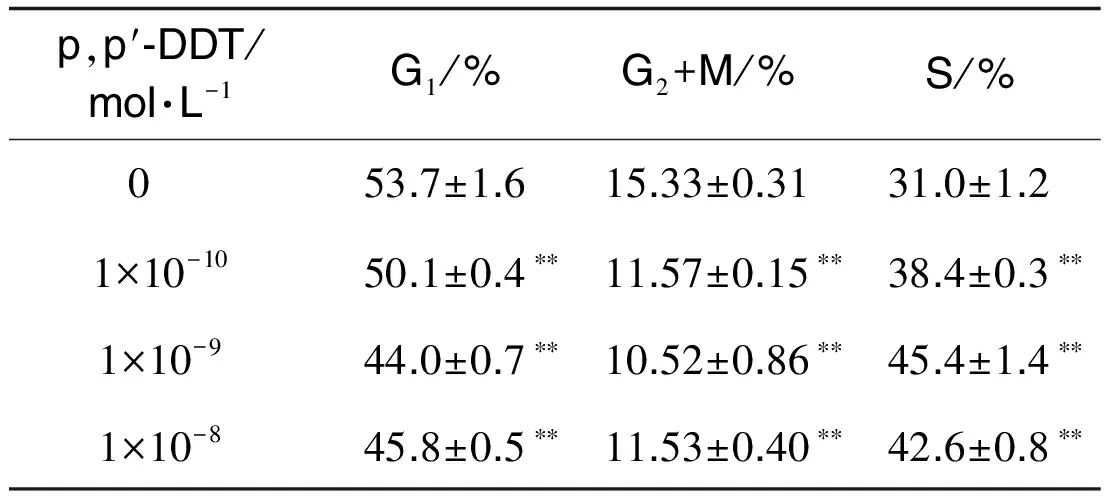
p,p′⁃DDT/mol·L-1G1/%G2+M/%S/%0 53.7±1.615.33±0.3131.0±1.21×10-1050.1±0.4∗∗11.57±0.15∗∗38.4±0.3∗∗1×10-944.0±0.7∗∗10.52±0.86∗∗45.4±1.4∗∗1×10-845.8±0.5∗∗11.53±0.40∗∗42.6±0.8∗∗
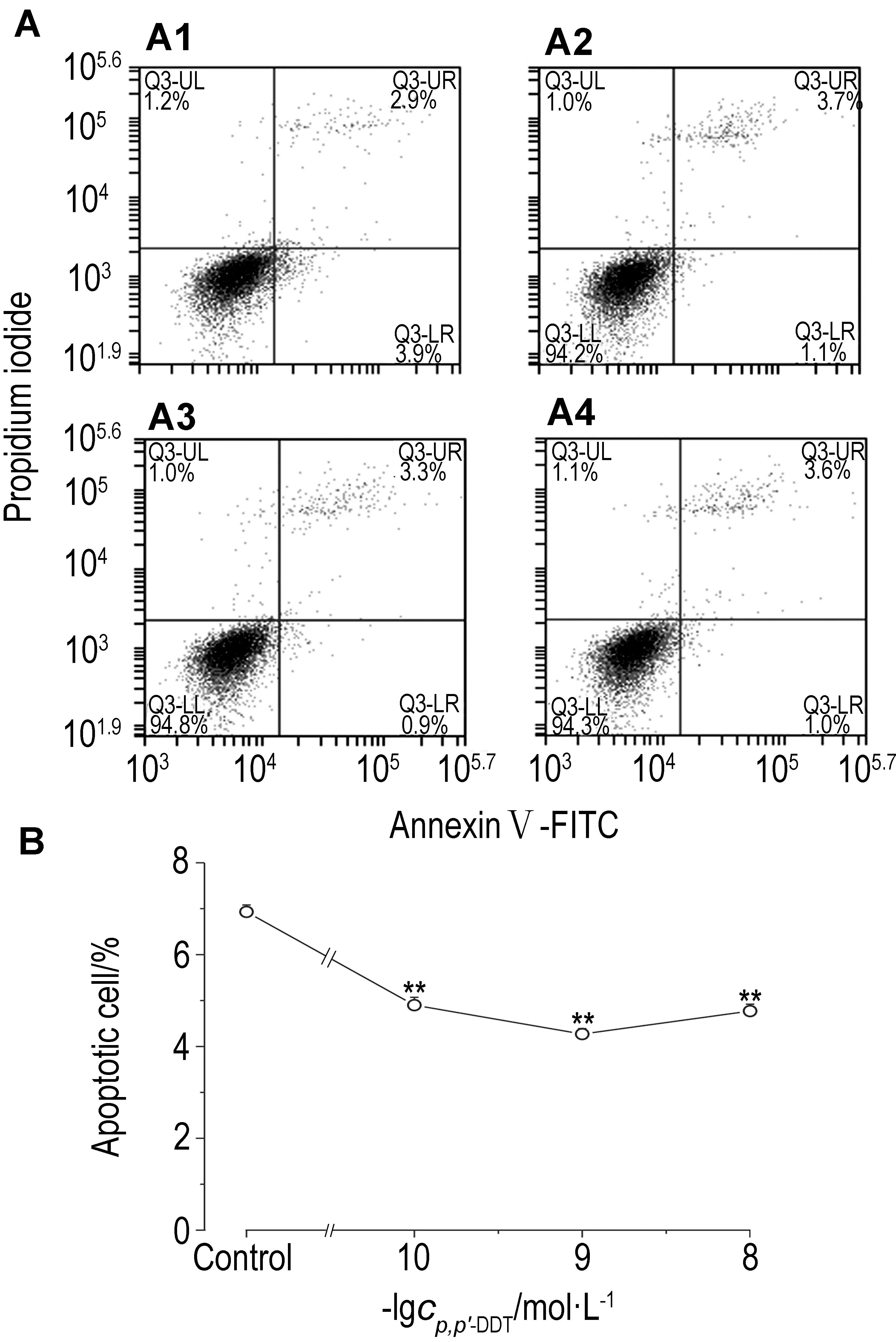
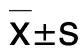
2.3 p,p′-DDT对大肠癌SW620细胞凋亡的影响如图3所示,p,p′-DDT 1×10-10, 1×10-9和1×10-8 mol·L-1处理SW620细胞96 h后,与细胞对照组相比,细胞凋亡率明显减少(P<0.01)。

2.4 p,p′-DDT暴露对Wnt/β-连环蛋白信号通路及下游靶蛋白c-Myc和细胞周期蛋白D1的影响由图4可知,p,p′-DDT 1×10-10,1×10-9和1×10-8 mol·L-1处理大肠癌SW620细胞96 h后,与细胞对照组比较,β-连环蛋白和磷酸化GSK3β显著升高(P<0.01),β-连环蛋白分别为细胞对照组的1.67,3.45和2.76倍,磷酸化GSK3β分别为细胞对照组的1.92,2.28和1.57倍;磷酸化β-连环蛋白水平显著降低(P<0.01),分别为细胞对照组的82%,57%和60%。此外,Wnt/β-连环蛋白信号通路下游靶蛋白c-Myc和细胞周期蛋白D1的表达水平也显著升高(P<0.01),c-Myc分别为细胞对照组的2.08,3.00和2.23倍,细胞周期蛋白D1分别为对照组的3.80,4.23和3.95倍。
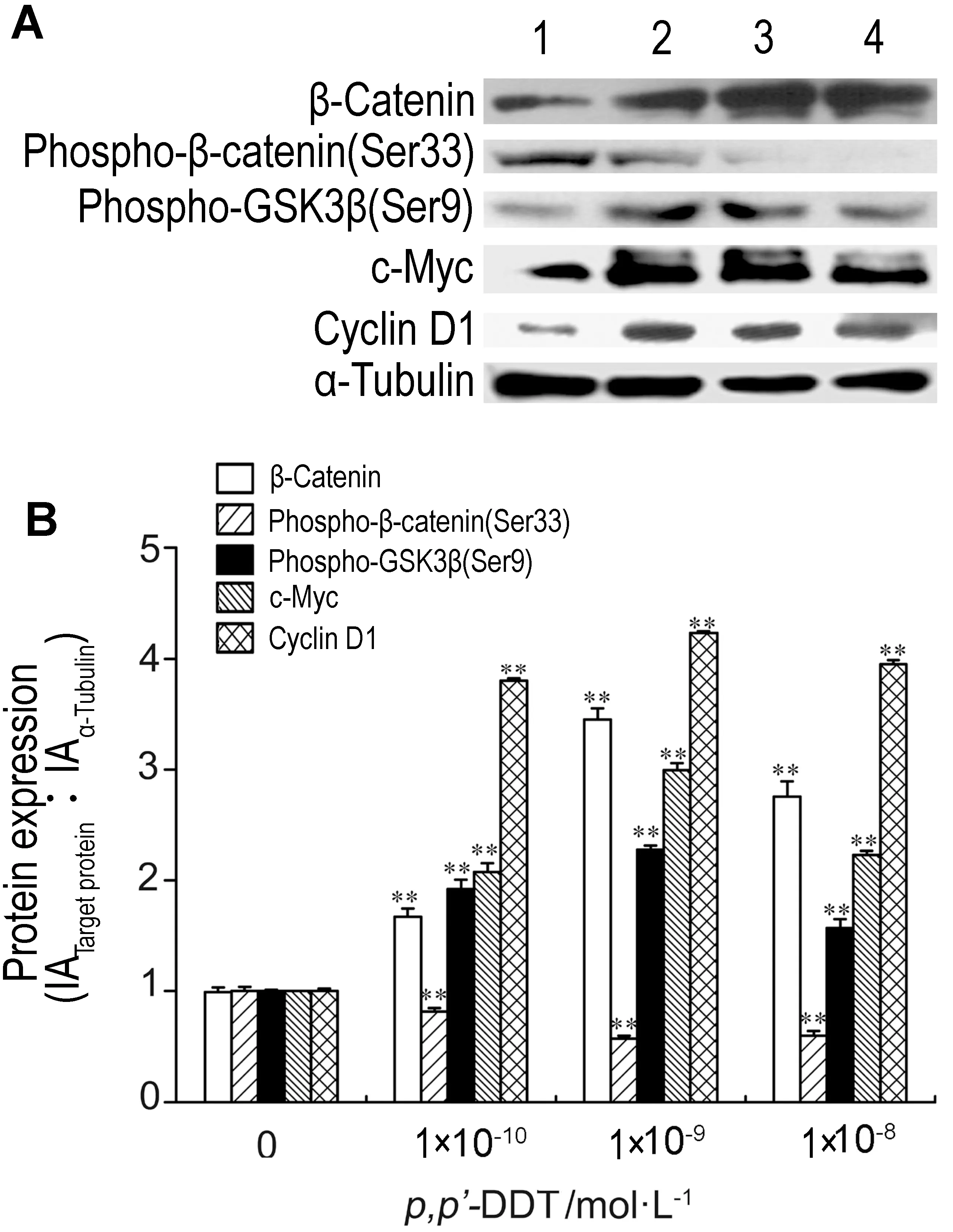

2.5 p,p′-DDT暴露对Bcl-2和Bax表达的影响由图5可知,p,p′-DDT 1×10-10,1×10-9和1×10-8 mol·L-1处理大肠癌SW620细胞96 h 后,Bcl-2表达与细胞对照组相比显著升高(P<0.01),分别为细胞对照组的1.91,1.90和2.31倍;Bax表达显著降低(P<0.01),分别为细胞对照组的68%,49%和62%;Bcl-2/Bax比值明显升高(P<0.01),分别为细胞对照组的2.81,4.03和3.95倍。
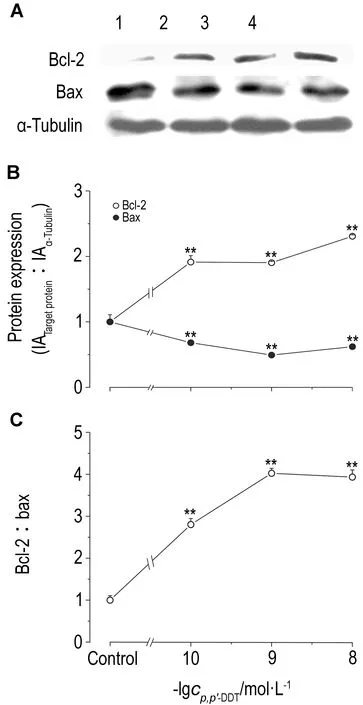
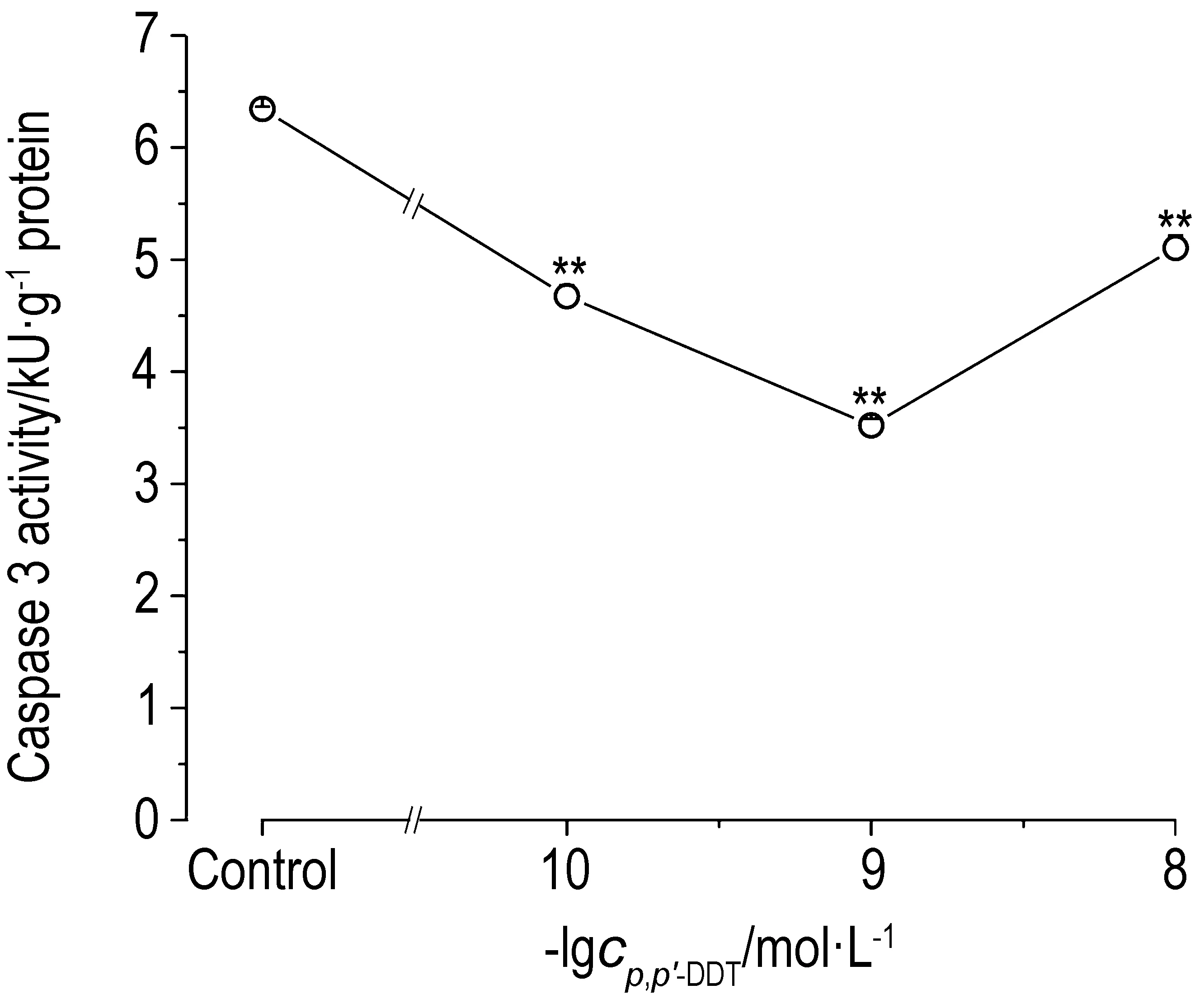
2.6 p,p′-DDT暴露对胱天蛋白酶原3、胱天蛋白酶原8和胱天蛋白酶3活性的影响由图6可知,SW620细胞经p,p′-DDT 1×10-10,1×10-9和1×10-8 mol·L-1处理96 h后,与对照组相比,胱天蛋白酶原3和胱天蛋白酶原8表达明显升高(P<0.05)。胱天蛋白酶原3分别为细胞对照组的2.06,2.32和1.97倍,胱天蛋白酶原8分别为对照组的2.47,2.67和3.65倍。由图7可知,SW620细胞经p,p′-DDT 1×10-10,1×10-9和1×10-8 mol·L-1处理96 h后,与对照组相比,胱天蛋白酶3活性明显降低,分别为对照组的74%,56%和80%。



3 讨论
本研究发现,p,p′-DDT 1×10-12~1×10-7mol·L-1暴露96 h明显促进SW620细胞的存活,表明低浓度p,p′-DDT可能通过促进大肠癌细胞的存活影响大肠癌的进展。异常的Wnt/β-连环蛋白信号通路在大肠癌发生和发展中发挥着重要的作用[13-14]。正常的细胞中没有Wnt信号,胞浆内的β-连环蛋白大部分与细胞膜上的钙黏蛋白结合,少部分游离的β-连环蛋白与一个由GSK3β、结肠腺瘤息肉蛋白和轴蛋白所形成的复合物结合,GSK3β磷酸化β-连环蛋白氨基端保守的丝氨酸/苏氨酸,促使β-连环蛋白的降解[18]。GSK3β是一种丝/苏氨酸磷酸激酶,其氨基端的第9位的丝氨酸磷酸化后可显著抑制其活性[19]。在大肠癌中,Wnt/β-连环蛋白信号通路异常激活是由通路中各成分包括GSK3β、结肠腺瘤息肉蛋白和β-连环蛋白突变所致,导致β-连环蛋白在细胞质内积累并转移至细胞核内,并与细胞核内转录因子TCF/LEF相结合,启动下游靶基因c-Myc和细胞周期蛋白D1等的转录激活,进而导致细胞异常增殖[20-21]。本研究发现,p,p′-DDT处理SW620 细胞后,β-连环蛋白和磷酸化GSK3β上调,磷酸化-β-连环蛋白水平显著降低。此外,Wnt/β-连环蛋白信号通路下游靶蛋白c-Myc和细胞周期蛋白D1的表达水平也显著升高。本研究发现,p,p′-DDT处理SW620细胞后,细胞周期发生改变,G1期细胞百分率减少,S期细胞百分率增多。文献报道,c-Myc和细胞周期蛋白D1是调节G1/S期过渡的关键蛋白[22]。上述结果表明,p,p′-DDT暴露可能通过抑制GSK3β的活性进而导致β-连环蛋白的稳定性提高,进一步上调Wnt/β-连环蛋白信号通路的下游靶蛋白c-Myc和细胞周期蛋白D1表达,最终促进大肠癌SW620 细胞的存活。细胞凋亡的发生与多种凋亡相关基因有关,如Bcl-2和胱天蛋白酶家族等。Bcl-2蛋白家族按功能可分为2类,一类具有抗凋亡作用,包括Bcl-2和Bcl-xl等;另一类为促凋亡成员,包括Bax和Bak等[23]。胱天蛋白酶家族是在细胞凋亡过程中起关键作用的酶,在细胞凋亡网络中居中心地位。研究发现,在癌症的发生和进展中,细胞凋亡机制的异常具有重要的作用[15-17]。Wright等[17]研究发现,一些致癌或促癌剂像DDT和PMA等通过抑制凋亡进而促进肿瘤的进展。Burow等[24]发现,DDT处理乳腺癌MCF-7细胞后拮抗肿瘤坏死因子α诱导的细胞凋亡。此外,Kazantseva等[25]研究发现,DDT能调节小鼠肝细胞细胞周期并且同时抑制细胞凋亡,这一机制可能在DDT促进肝癌进展中起重要作用。本研究结果发现,p,p′-DDT处理SW620 细胞96 h后,细胞凋亡率降低,Bcl-2表达明显上调,而Bax表达明显下调, Bcl-2/Bax比值明显升高;胱天蛋白酶原8和胱天蛋白酶原3的水平显著升高,并且胱天蛋白酶3活性明显降低,表明DDT干扰了胱天蛋白酶8和胱天蛋白酶3的活化。以上结果表明,DDT可能通过影响凋亡相关蛋白进而抑制细胞凋亡。综上所述,本研究结果表明,低浓度p,p′-DDT暴露可增加SW620细胞存活,促进细胞周期从G1期到S期进展,抑制细胞凋亡,进一步激活 Wnt/β-连环蛋白信号通路,并且影响凋亡相关蛋白的表达和活性,这可能与DDT促进大肠癌的发展有关。
[1] Beard J, Australian Rural Health Research Collaboration. DDT and human health[J].SciTotalEnviron, 2006, 355(1-3):78-89.
[2] Beard J, Sladden T, Morgan G, Berry G, Brooks L, McMichael A. Health impacts of pesticide exposure in a cohort of outdoor workers[J].EnvironHealthPerspect, 2003, 111(5):724-730.
[3] Cohn BA, Wolff MS, Cirillo PM, Sholtz RI. DDT and breast cancer in young women: new data on the significance of age at exposure[J].EnvironHealthPerspect, 2007, 115(10):1406-1414.
[4] Eskenazi B, Chevrier J, Rosas LG, Anderson HA, Bornman MS, Bouwman H,etal. The Pine River statement: human health consequences of DDT use[J].EnvironHealthPerspect, 2009, 117(9):1359-1367.
[5] McGlynn KA, Abnet CC, Zhang M, Sun XD, Fan JH, O′Brien TR,etal. Serum concentrations of 1,1,1-trichloro-2,2-bis(p-chlorophenyl)ethane(DDT) and 1,1-dichloro-2,2-bis(p-chlorophenyl)ethylene (DDE) and risk of primary liver cancer[J].JNatlCancerInst, 2006, 98(14):1005-1010.
[6] Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics[J].CACancerJClin, 2011, 61(2):69-90.
[7] Bazensky I, Shoobridge-Moran C, Yoder LH. Colorectal cancer: an overview of the epidemiology, risk factors, symptoms, and screening guidelines[J].MedsurgNurs, 2007, 16(1):46-51.
[8] Watson AJ, Collins PD. Colon cancer: a civilization disorder[J].DigDis, 2011, 29(2):222-228.
[9] El-Tawil AM. Colorectal cancer and pollution[J].WorldJGastroenterol, 2010, 16(28):3475-3477.
[10] Jaga K. Serum organochlorine pesticide levels in patients with colorectal cancer in Egypt[J].ArchEnvironHealth, 1999, 54(3):217-218.
[11] Soliman AS, Smith MA, Cooper SP, Ismail K, Khaled H, Ismail S,etal. Serum organochlorine pesticide levels in patients with colorectal cancer in Egypt[J].ArchEnvironHealth, 1997, 52(6):409-415.
[12] Chen K, Zhao YW, Ma XY, Zhang LJ, Zheng S. Relationship between organochlorine pollution in soil and rice and the incidence of colorectal cancer in Jiashan county, Zhejiang province[J].ChinJEpidemiol(中华流行病学杂志), 2004, 25(6):479-483.
[13] Bienz M, Clevers H. Linking colorectal cancer to Wnt signaling[J].Cell, 2000, 103(2):311-320.
[14] Polakis P. Wnt signaling and cancer[J].GenesDev, 2000, 14(15):1837-1851.
[15] Williams GT. Programmed cell death: apoptosis and oncogenesis[J].Cell, 1991, 65(7):1097-1098.
[16] Pickard MR, Edwards SE, Cooper CS, Williams GT. Apoptosis regulators Fau and Bcl-G are down-regulated in prostate cancer[J].Prostate, 2010, 70(14):1513-1523.
[17] Wright SC, Zhong J, Larrick JW. Inhibition of apoptosis as a mechanism of tumor promotion[J].FASEBJ, 1994, 8(9):654-660.
[18] Yost C, Torres M, Miller JR, Huang E, Kimelman D, Moon RT. The axis-inducing activity, stability, and subcellular distribution of beta-catenin is regulated inXenopusembryos by glycogen synthase kinase 3[J].GenesDev, 1996, 10(12):1443-1454.
[19] Frame S, Cohen P, Biondi RM. A common phosphate binding site explains the unique substrate specificity of GSK3 and its inactivation by phosphorylation[J].MolCell, 2001, 7(6):1321-1327.
[20] Haydon RC, Deyrup A, Ishikawa A, Heck R, Jiang W, Zhou L,etal. Cytoplasmic and/or nuclear accumulation of the beta-catenin protein is a frequent event in human osteosarcoma[J].IntJCancer, 2002, 102(4):338-342.
[21] Krausova M, Korinek V. Wnt signaling in adult intestinal stem cells and cancer[J].CellSignal, 2014, 26(3):570-579.
[22] Skouteris GG, Schröder CH. C-myc is required for the G0/G1-S transition of primary hepatocytes stimulated with a deleted form of hepatocyte growth factor[J].BiochemJ, 1996, 316(Pt 3):879-886.
[23] Chen CR, Xia YH, Yao SY, Zhang Q, Wang Y, Ji ZN. Virosecurinine induces apoptosis by affecting Bcl-2 and Bax expression in human colon cancer SW480 cells[J].Pharmazie, 2012, 67(4):351-354.
[24] Burow ME, Tang Y, Collins-Burow BM, Krajewski S, Reed JC, McLachlan JA,etal. Effects of environmental estrogens on tumor necrosis factor alpha-mediated apoptosis in MCF-7 cells[J].Carcinogenesis, 1999, 20(11):2057-2061.
[25] Kazantseva YA, Yarushkin AA, Pustylnyak VO. Dichlorodiphenyltrichloroethane technical mixture regulates cell cycle and apoptosis genes through the activation of CAR and ERα in mouse livers[J].ToxicolApplPharmacol, 2013, 271(2):137-143.
(本文编辑: 齐春会)
Effect of low concentrations of p,p′- dichlorodiphenyltrichloroethaneon proliferation and apoptosis of colorectaladenocarcinoma SW620 cells
LIU Jian-xin1, ZHAO Jun-yu1, JIN Xiao-ting1, LI Zhuo-yu1, SONG Li1,2
(1.InstituteofBiotechnology,KeyLaboratoryofChemicalBiologyandMolecularEngineeringofNationalMinistryofEducation,ShanxiUniversity,Taiyuan030006,China; 2.MOEKeyLabofEnvironmentalRemediationandEcosystemHealth,CollegeofEnvironmentalandResourceSciences,ZhejiangUniversity,Hangzhou310058,China)
OBJECTIVE To investigate the effect and mechanism of low concentrations ofp,p′-dichlorodiphenyltrichloroethane (p,p′-DDT) on colorectal adenocarcinoma SW620 cell proliferation and apoptosis. METHODS SW620 cells were exposed to low concentrations ofp,p′-DDT ranging from 1×10-12to 1×10-6mol·L-1for 48 and 96 h. MTT assay was employed to examine the effect ofp,p′-DDT on SW620 cell viability. Different cell stages of cycle and apoptosis rate were determined by flow cytometry after SW620 cells were exposed to 1×10-10, 1×10-9and 1×10-8mol·L-1for 96 h. Western blotting was used to determine the protein expression of Wnt/β-catenin signaling components 〔β-catenin, phospho-β-catenin and phospho-glycogen synthase kinase (GSK)3β〕, their downstream target proteins (c-Myc and cyclin D1)and apoptosis related proteins (Bcl-2, Bax, procaspase 8 and procaspase 3). RESULTSThe viability of colorectal adenocarcinoma SW620 cells was significantly increased after exposure to low concentrations ofp,p′-DDT ranging from 1×10-12to 1×10-7mol·L-1for 96 h.p,p′-DDT 1×10-10, 1×10-9and 1×10-8mol·L-1exposure led to a decreased percentage of SW620 cells in G1stage(P<0.01) along with an increased percentage of cells in S stage(P<0.01). Meanwhile, the apoptosis rate was significantly decreased compared with control group(P<0.01). Exposure top,p′-DDT from 1×10-10to 1×10-8mol·L-1induced upregulation of phospho-GSK3β (Ser9), β-catenin, c-Myc and cyclin D1 in SW620 cells(P<0.01). Moreover, apoptosis related proteins Bcl-2, procaspase 8 and procaspase 3 were unregulated(P<0.01), and Bax level and caspase 3 activity were decreased inp,p′-DDT-stimulated cells(P<0.01). CONCLUSION Low concentrations ofp,p′-DDT exposure activates Wnt/β-catenin signaling and affects apoptosis-related proteins, which may be involved inp,p′-DDT-induced cell proliferation as well as suppression of cell apoptosis in SW620 cells.Key words: dichlorodiphenyltrichloroethane; large intestine cancer; Wnt signaling pathway; β-catenin; Bcl-2; caspase 3
SONG Li, E-mail: lsong@sxu.edu.cn, Tel: (0351)7017774
国家自然科学基金(31271516); 国家自然科学基金(21207084);教育部博士点博导基金(20111401110011);中国博士后基金(2012M521178);山西省自然科学基金(2014011027-5)
刘建新(1989- ),男,硕士研究生,主要从事毒理学研究。
宋 莉, E-mail: lsong@sxu.edu.cn, Tel: (0351)7017774
Foundation item: The project supported by National Natural Science Foundation of China (31271516); National Natural Science Foundation of China (21207084); Research Fund for Doctoral Program of Higher Education of China (20111401110011);China Postdoctoral Science Foundation (2012M521178); and Natural Science Foundation of Shanxi Province (2014011027-5)
2014-08-28 接受日期: 2015-03-19)
R965,R979.8
A
1000-3002(2015)02-0227-07
10.3867/j.issn.1000-3002.2015.02.007
--------------------
