姜黄素通过抑制糖皮质激素受体促进大鼠神经干细胞增殖
2015-03-02马晓晓王春满张高龙左春龙黄意湘连庆泉
马晓晓, 王春满, 张高龙, 左春龙, 黄意湘, 刘 劲, 连庆泉, 林 函
(温州医科大学附属第二医院麻醉科, 浙江 温州 325000)
姜黄素通过抑制糖皮质激素受体促进大鼠神经干细胞增殖
马晓晓, 王春满, 张高龙, 左春龙, 黄意湘, 刘 劲, 连庆泉, 林 函
(温州医科大学附属第二医院麻醉科, 浙江 温州 325000)
目的 探讨姜黄素对大鼠神经干细胞增殖的影响及其可能机制。方法 取孕15 d(E15)远交群(SD)大鼠的胎脑皮质,分离培养原代神经干细胞,进行神经干细胞标志蛋白神经上皮干细胞蛋白巢蛋白(nestin)和胚胎干细胞关键蛋白(SOX2)染色鉴定。姜黄素 0,0.1,0.5,2.5,12.5和62.5 μmol·L-1处理大鼠神经干细胞24 h后,乳酸脱氢酶(LDH)释放法检测细胞毒性;MTT法检测细胞存活;5-溴脱氧尿嘧啶核苷(BrdU)增殖试剂盒检测神经干细胞增殖;荧光定量聚合酶链反应法(qRT-PCR)检测神经干细胞糖皮质激素受体(GR)、信号转导与激活因子3(Stat3)、Notch1和p21 mRNA表达;Western蛋白印迹法检测神经干细胞GR, Stat3和磷酸化Stat3(p-Stat3)蛋白表达。结果 原代细胞经巢蛋白和SOX2蛋白染色鉴定为神经干细胞。LDH释放法检测结果显示,姜黄素12.5和62.5 μmol·L-1对神经干细胞具有细胞毒性作用(P<0.05)。MTT结果显示,姜黄素0.5和2.5 μmol·L-1增强神经干细胞活力,姜黄素62.5 μmol·L-1降低神经干细胞活力(P<0.05)。BrdU结果显示,姜黄素0.1,0.5和2.5 μmol·L-1促进神经干细胞增殖(P<0.05),姜黄素12.5和62.5 μmol·L-1抑制神经干细胞增殖(P<0.05)。qRT-PCR结果显示,姜黄素0.5 μmol·L-1组GR mRNA表达明显降低(P<0.05)。Western蛋白印迹法结果表明,姜黄素0.5 μmol·L-1组GR, Stat3和p-Stat3蛋白表达明显降低(P<0.05)。结论 姜黄素促进神经干细胞增殖,可能与其抑制GR mRNA转录及相关蛋白表达有关。
姜黄素; 神经干细胞; 细胞增殖; 受体, 糖皮质激素
姜黄素(curcumin)能缓解阿尔茨海默病(Alzheimer disease, AD)模型小鼠的病理症状,改善和提高AD大鼠与老年小鼠的空间学习和记忆能力[1-2];对冈田酸引起的小鼠记忆损伤具有神经保护作用[3];阻止大鼠慢性乙醇中毒引起的认知功能障碍的发生[4];并逆转皮质酮引起的大鼠抑郁行为[5]。在离体细胞水平,姜黄素装载的纳米颗粒可诱导成年神经再生[6];保护AD中神经元免受氧化应激的损伤,通过减弱氧化损伤作用保护皮质神经元[7-8];还可以预防皮质酮引起的神经毒性和神经可塑性的异常[9]。由于神经干细胞(neural stem cell, NSC)在神经修复与再生中起重要作用,姜黄素对NSC的作用及其机制研究值得探讨。Kim等[10]发现,姜黄素促进NSC的增殖,并且激活胞外信号调节激酶(extracellular signal-regulated kinase,ERK)和P38激酶,但其中ERK和P38信号通路的具体作用机制仍不明确。另有研究表明,糖皮质激素通过糖皮质激素受体(glucocorticoid receptor, GR)可抑制NSC的增殖[11]。离体及在体实验证明,GR激活ERK和P38信号通路可抑制海马神经系统的发育[12-13]。因此,本研究从ERK和P38信号通路的上游靶蛋白GR探讨姜黄素对NSC增殖作用的影响机制。
1 材料与方法
1.1 试剂和仪器
DMEM/F12和B27 supplement,美国Gibco公司;碱性成纤维生长因子(basic fibroblast growth factor,bFGF)和表皮生长因子(epidermal growth factor,EGF),美国Cali-Bio公司;CytoTox 96非放射性细胞毒性试剂盒,美国Promega公司;姜黄素,二甲亚砜(dimethyl sulfoxide, DMSO),噻唑蓝〔3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazoliumbromide, MTT〕,多聚鸟氨酸,美国Sigma公司;5-溴脱氧尿嘧啶核苷(5-bromo-2-deoxy uridine,BrdU)细胞增殖检测试剂盒,美国Merck Millipore公司;大鼠神经上皮干细胞蛋白巢蛋白(nestin)和胚胎干细胞关键蛋白(SRY-related HMG-box2, SOX2)抗体,美国Santa公司;大鼠GR抗体,美国Pierce公司;大鼠信号转导与激活因子3(signal transducers and activators of transcription 3, Stat3)抗体、磷酸化Stat3(phosphorylated Stat3, p-Stat3)抗体,美国Abcam公司;Trizol,美国Invitrogrn公司;荧光定量PCR仪和SsoFast EvaGreen Supermix,美国Bio-Rad公司;逆转录试剂盒,美国Promega公司;Western蛋白印迹法鼠抗兔及抗鼠二抗,碧云天公司;CO2培养箱,酶联免疫检测仪,美国Thermo公司;解剖显微镜,日本Olympus公司;荧光显微镜,日本Nikon公司。0.1%姜黄素DMSO溶液备用。
1.2 细胞制备和鉴定
SD大鼠,体质量250~350 g(温州医科大学实验动物中心,动物许可证编号:SCXK浙20100044)。将雌雄SD大鼠放在定制的铁笼里进行交配,室温为21.5~22.5℃,自然照明,12 h昼夜交替饲养,观察到阴拴日为孕第0天,记为E0。分离E15大鼠的皮质NSC,在含有神经营养因子(2% B27,bFGF 20 μg·L-1和EGF 20 μg·L-1)的DMEM/F12的培养基中进行培养,培养条件为5%CO2, 37℃。培养4~5 d后进行细胞传代,稳定培养至第2代。24孔板用多聚鸟氨酸铺板预处理6~12 h,培养的NSC以每孔5×104的细胞密度接种于24孔板上,加入500 μL培养基,培养24 h后,进行NSC标志蛋白巢蛋白及SOX2免疫细胞化学染色鉴定,荧光显微镜拍照。
1.3 乳酸脱氢酶(lactate dehydrogenase, LDH)释放法检测细胞毒性
96孔板预先用多聚鸟氨酸铺板12 h。将NSC以每孔2×104的细胞密度接种于加100 μL培养基的96孔板内,在细胞培养箱内孵育培养24 h,细胞随机分组为正常组、溶剂组、姜黄素0.1,0.5,2.5,12.5和62.5 μmol·L-1组。24 h后按照CytoTox96非放射性细胞毒性试剂盒实验,检测并计算细胞死亡率。细胞死亡率(%)=样品A490 nm/酶活性最大细胞A490 nm×100%。
1.4 MTT法检测细胞存活
按1.3分组的细胞接板接种于96孔板,每孔加入20 μL MTT溶液(5 g·L-1),继续培养4 h。用酶联免疫检测仪检测A490 nm值,计算细胞活力百分率,细胞存活率(%)=(实验组A值/对照组A值)×100%。
1.5 BrdU检测细胞增殖
96孔板预先用多聚鸟氨酸铺板12 h,将NSC以每孔2×104的细胞密度接种于加100 μL培养基的96孔板内,按1.3分组的细胞在培养箱内孵育培养24 h,每孔加入20 μL 20%BrdU培养基,放入细胞培养箱孵育24 h。用酶联免疫检测仪检测A490 nm值,计算细胞增殖百分率。细胞增殖百分率(%)=(实验组A值/对照组A值)×100%。
1.6 实时荧光定量聚合酶链反应(qRT-PCR)法检测神经干细胞增殖相关基因的mRNA水平
以每孔1×106的细胞密度接种,置于细胞培养箱内孵育24 h,按1.3分组的细胞,24 h后,按Trizol试剂说明书提取各组NSC的总RNA,测定总RNA的浓度与A260 nm/A280 nm比值,将RNA逆转为cDNA用qRT-PCR检测,采用相对稀释标准曲线法测定目的基因GR, Stat3, Notch1和p21 mRNA的相对表达水平。其引物序列如下,内参基因RS16:上游引物(F) AAGTCTTCGGACGCAAGAAA;下游引物(R) TTGCCCAGAAGCAGAACAG;目的基因GR: (F) ATACAGCATCCCTTTCTCAGCA;(R) CTTGGCACCTATTCCAGTTTTC;Stat3: (F) TACCAGCAAAATCAGGTTGCT;(R) ACATCCCCAGAGTCCTTATCAA;Notch1:(F) ACATCCCCAGAGTCCTTATCAA;(R) GAAAAGCCACCGAGATAGTCAG;p21:(F):AACTGGGGAGGGCTTTCT;(R) TGTCTTGTCTTCGCTGAGGT。根据双标准曲线法从各自标准曲线上计算待测样本初始表达量,将目的基因表达量归一处理,按照公式基因相对表达量=(待测样本目的基因初始浓度/待测样本内参初始浓度)/(对照样本目的基因初始浓度/对照样本内参基因初始浓度), 得出样本目的基因的表达差异。
1.7 Western蛋白印迹法检测神经干细胞增殖相关基因的蛋白表达
以每孔1×106的细胞密度接种,置于细胞培养箱内孵育24 h,按1.3分组的细胞,24 h后,收集细胞离心沉淀,按照蛋白裂解试剂说明书加入裂解液和磷酸酶抑制剂,置于冰上静止30 min,EP管内超声5 s×3次。低温12 000×g离心10 min,收取上清液。用BCA工作试剂盒测定蛋白浓度,每条泳道蛋白上样量30 μg,电泳、转膜后用5%脱脂奶粉封闭2 h,加入内参蛋白兔抗大鼠β肌动蛋白和目的蛋白GR, Stat3和p-Stat3一抗,按1∶1000的滴度稀释,4℃摇床孵育过夜。TBST洗膜,加入稀释比例为1∶5000的鼠抗兔二抗,室温孵育2 h,TBST充分洗膜,通过曝光后显示条带。用Quantity One4.62软件分析目标蛋白条带和内参蛋白条带的积分吸光度(integrated absorbance, IA),以两者IA的比值表示目标蛋白的相对表达水平。
1.8 统计学分析
2 结果
2.1 神经干细胞的鉴定
图1显示,相差显微镜下观察到培养的原代NSC细胞球(图A)进行巢蛋白染色鉴定(绿色,图B),多聚鸟氨酸铺板培养的贴壁NSC进行巢蛋白(绿色,图C)和SOX2(绿色,图D)免疫荧光染色鉴定,细胞核进行DAPI染色鉴定(蓝色),其中巢蛋白和SOX2绿色染色在DAPI染色的蓝色细胞核中阳性率均超过98%,免疫荧光结果证明培养的细胞为NSC。
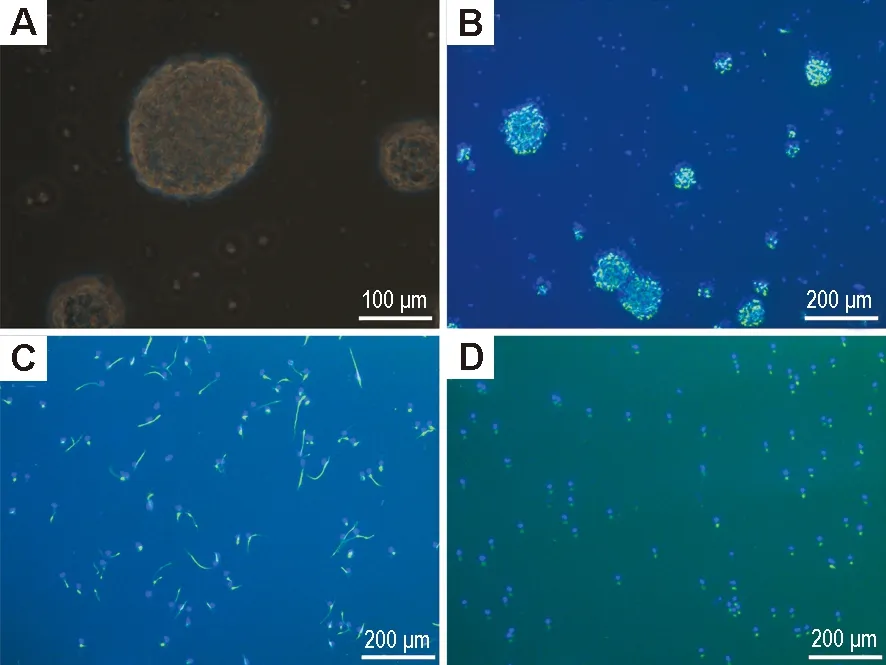
Fig.1 Photomicrographs of neural stem cells (NSCs) in culture. Cells were separated from embryonic rat brain at day 15 and cultured in proliferation media containing growth factors. A: immunofluorescence image of a neurosphere that was fixed and stained with nestin (green) and then counterstained with nuclear marker DAPI (blue); B: immunofluorescence image of NSCs when grown on 96-well poly-L-O-rnithine coated plates stained with nestin (green, C) or SOX2 (green, D) and then counterstained with nuclear marker DAPI (blue).
2.2 姜黄素对神经干细胞的细胞毒性及存活率影响
表1结果显示,正常组、溶剂组和姜黄素0.1,0.5及2.5 μmol·L-1组细胞死亡率无统计学差异;与正常对照组和溶剂组相比,姜黄素12.5和62.5 μmol·L-1组细胞死亡率显著升高(P<0.05),说明高浓度姜黄素促进NSC中LDH的释放,对NSC具有细胞毒性。
Tab.1 Cytotoxicity of curcumin on NSCs by lactate dehydrogenase (LDH) release detection
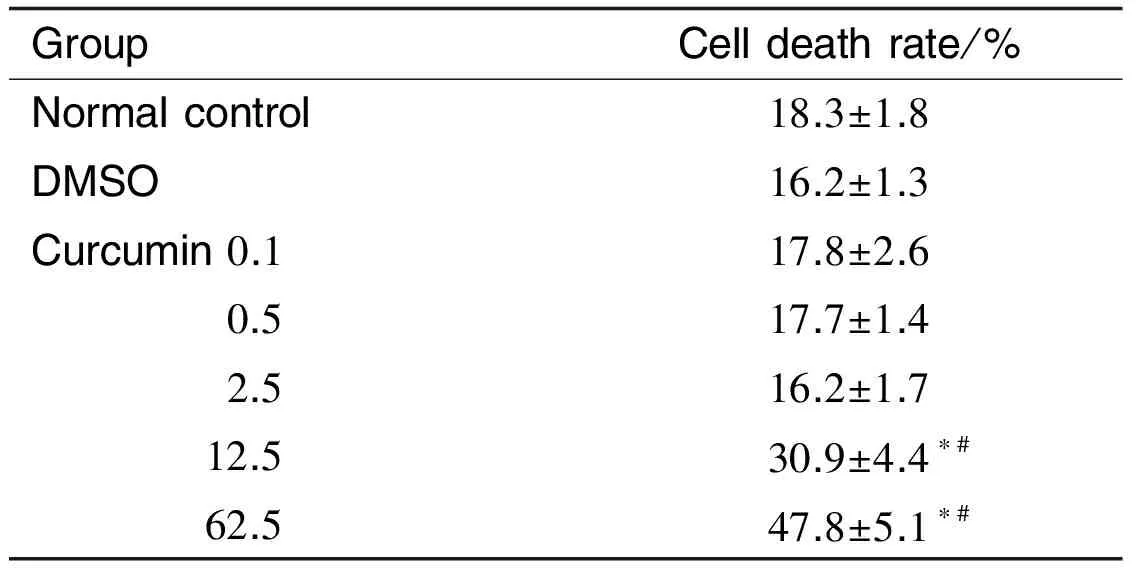
GroupCelldeathrate/%Normalcontrol18.3±1.8DMSO16.2±1.3Curcumin0.117.8±2.6 0.517.7±1.4 2.516.2±1.7 12.530.9±4.4∗# 62.547.8±5.1∗#

表2结果显示,与正常对照组和溶剂组相比,姜黄素0.1和12.5 μmol·L-1细胞存活率无显著差异,姜黄素0.5及2.5 μmol·L-1增强NSC的存活率(P<0.05);而姜黄素62.5 μmol·L-1则显著抑制细胞存活(P<0.05)。
Tab.2 Effect of curcumin on cell viability of NSCs by MTT assay
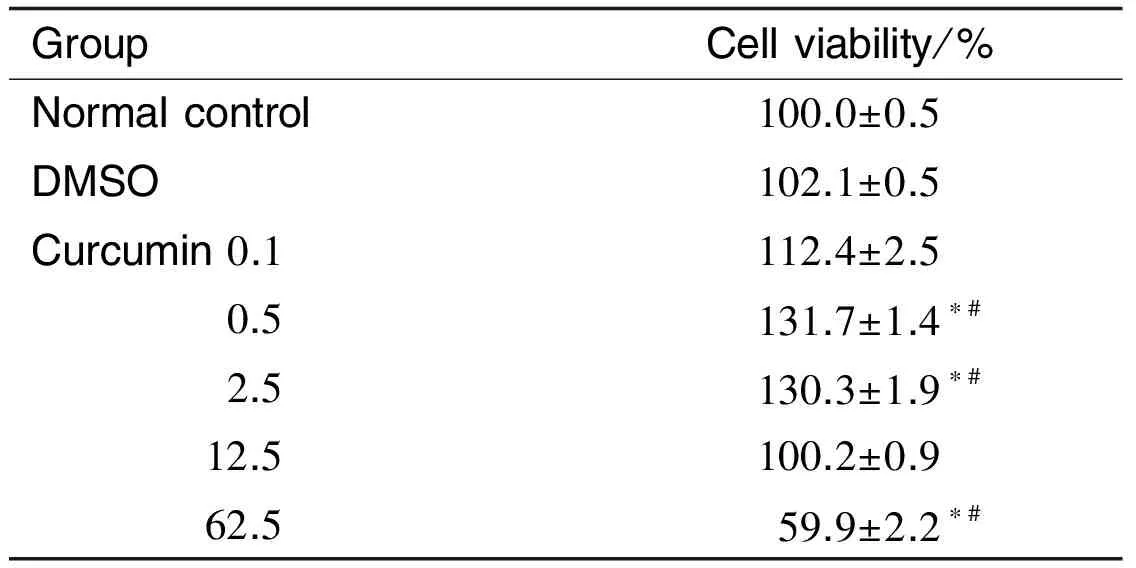
GroupCellviability/%Normalcontrol100.0±0.5DMSO102.1±0.5Curcumin0.1112.4±2.5 0.5131.7±1.4∗# 2.5130.3±1.9∗# 12.5100.2±0.9 62.559.9±2.2∗#

2.3 姜黄素对神经干细胞增殖的影响
如表3所示,与溶剂组相比,姜黄素0.1,0.5和2.5 μmol·L-1组NSC增殖百分率显著升高(P<0.05),其中0.5 μmol·L-1组NSC增殖百分率增高最明显,促增殖作用最强;而姜黄素12.5和62.5 μmol·L-1组NSC明显降低(P<0.05),说明高浓度抑制NSC增殖。
Tab.3 Effect of curcumin on NSCs proliferation by BrdU assay
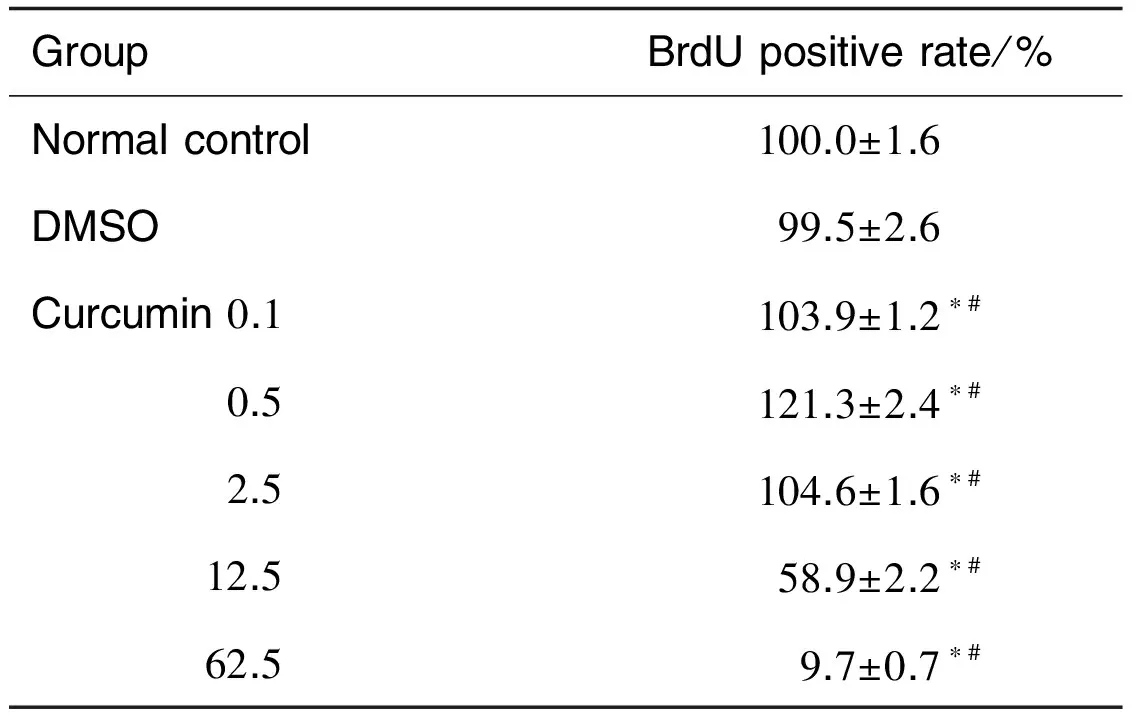
GroupBrdUpositiverate/%Normalcontrol100.0±1.6DMSO99.5±2.6Curcumin0.1103.9±1.2∗# 0.5121.3±2.4∗# 2.5104.6±1.6∗# 12.558.9±2.2∗# 62.59.7±0.7∗#

2.4 姜黄素对神经干细胞增殖相关基因表达的影响
荧光定量PCR(表4)显示,与溶剂组相比,经姜黄素0.5 μmol·L-1处理后的NSC GR基因的表达显著下降(P<0.05),但对Stat3, Notch1和p21 mRNA无影响。
Tab.4 Effect of curcumin on mRNA expression of GR, SOX2, Notch1 and p21 by qRT-PCR
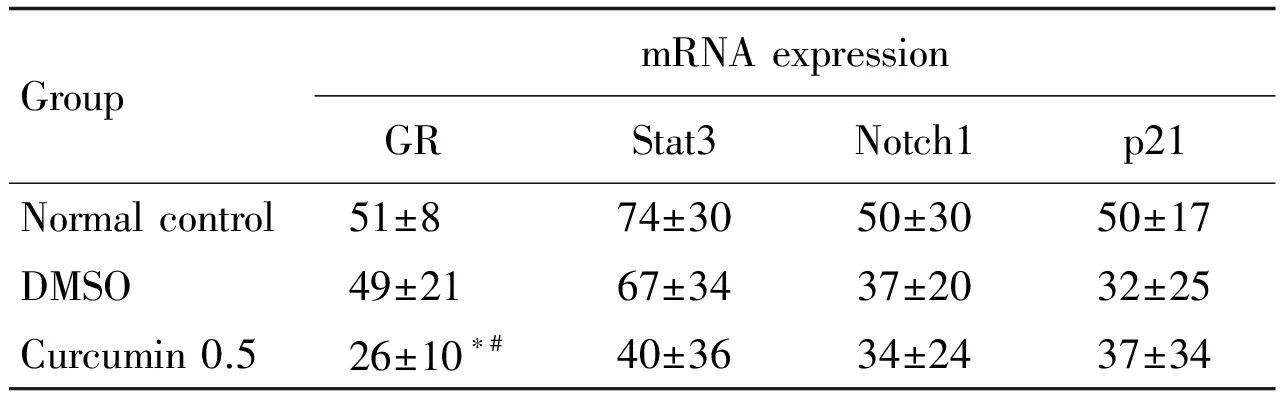
GroupmRNAexpressionGR Stat3Notch1p21Normalcontrol51±874±3050±3050±17DMSO49±2167±3437±2032±25Curcumin0.526±10∗#40±3634±2437±34

2.5 姜黄素对神经干细胞增殖相关蛋白表达的影响Western蛋白印迹结果显示(表5和图2),与溶剂组相比,姜黄素0.5 μmol·L-1处理后,GR, Stat3和p-Stat3蛋白的相对表达显著降低(P<0.05)。
Tab.5 Effect of curcumin on GR, Stat3 and p-Stat3 protein expression
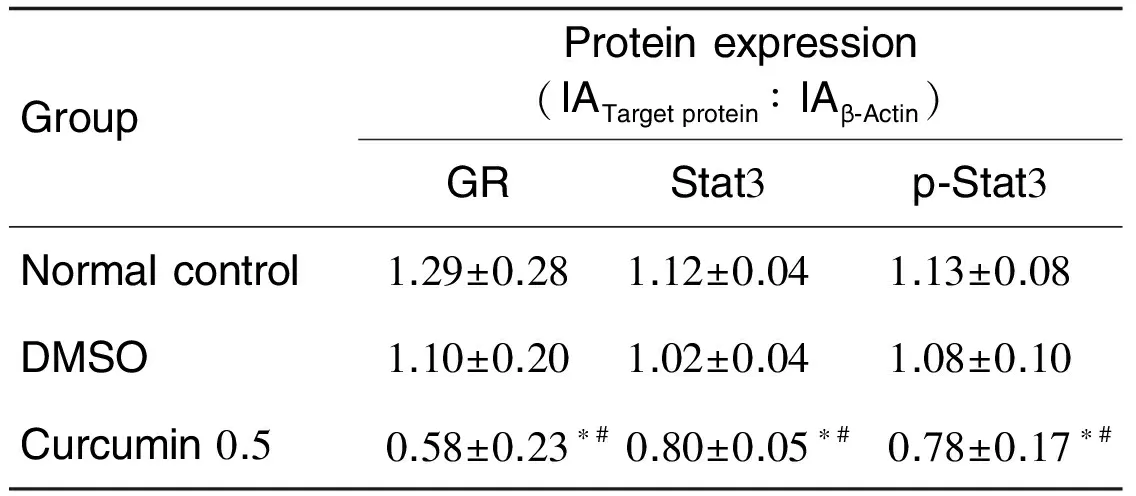
GroupProteinexpression(IATargetprotein∶IAβ⁃Actin)GRStat3p⁃Stat3Normalcontrol1.29±0.281.12±0.041.13±0.08DMSO1.10±0.201.02±0.041.08±0.10Curcumin0.50.58±0.23∗#0.80±0.05∗#0.78±0.17∗#

Fig.2 Effect of curcumin on GR(A)and Stat3 and p-Stat3 protein expression(B) by Western blotting. Lane 1: control; lane 2: DMSO; lane 3: curcumin 0.5 μmol·L-1for 24 h.
3 讨论
本研究结果发现,姜黄素低浓度组促进NSC增殖,其中以姜黄素0.5 μmol·L-1组对NSC的增殖促进作用最强;而姜黄素高浓度组抑制NSC的增殖。qRT-PCR及Western蛋白印迹结果显示,姜黄素0.5 μmol·L-1处理组中NSC GR的mRNA表达明显降低,GR蛋白的表达水平也明显降低;Stat3 mRNA的表达有一定的下降趋势但没有统计学意义上的改变,Stat3总蛋白及p-Stat3蛋白的表达水平却发生降低。说明姜黄素抑制了GR的转录过程和蛋白翻译过程,同时可能也抑制了Stat3的转录过程但其抑制作用不明显,通过蛋白的级联放大作用后,总蛋白水平发生降低。研究表明,GR是类固醇/甲状腺激素受体超家族的一个受体依赖性的转录因子,可通过经典信号通路与核内糖皮质激素反应元件(glucocorticoids response element,CRE)结合,然后导致含有GR结合元件的靶基因激活或抑制[14]。然而,GR也可以通过非经典信号通路(直接蛋白-蛋白间的相互作用)与其他相关信号通路相互作用发生反应。研究表明,GR的DNA结合元件和Stat3结合元件具有相同的DNA序列,两者结合至相应的DNA结合元件后,GR和Stat3可通过直接蛋白-蛋白的相互作用调控彼此的下游靶基因表达[15]。另有研究表明,快速GR通路可激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路[16],MAPK信号通路主要包括ERK、c-Jun氨基端激酶(c-Jun N-terminal kinase, JNK)和P38。其中ERK途径参与细胞因子、生长因子、激素和丝裂原受体活化信号的转导,细胞的增殖主要与这条通路有关。在Kuroki等[17]实验中,姜黄素激活了细胞外的ERK和P38激酶;而另有研究表明,ERK信号通路的激活可以作用于Stat3上的共激活位点Ser-727抑制其磷酸化。STAT是近年来研究发现的一条由细胞因子刺激的信号转导通路,参与细胞的增殖、分化、凋亡以及免疫调节等许多重要的生物学过程。研究表明,Stat3促进小鼠胚胎干细胞中神经元的分化[18],维持NSC的自我更新[19]。因此可推断GR可能在该作用机制中起到主导作用,作为ERK信号通路的上游分子调节ERK信号通路的下游分子Stat3的表达。通过与其他信号通路或直接蛋白-蛋白接触的相互作用,参与姜黄素对NSC的增殖促进作用。Notch1能维持NSC或神经前体细胞的更新分裂能力,提高NSC的增殖存活能力,维持NSC稳定。p21是一种能够调节细胞周期的基因,属于细胞周期蛋白激酶抑制剂家族一员。当处于应激状态,正常发育过程以及分化时,能够被诱导产生。但在本研究中,二者的表达水平未发生改变,因此认为姜黄素对大鼠NSC的增殖促进作用可能与这两个基因无关。综上所述,姜黄素对NSC的增殖作用可能与GR信号通路有关,其具体机制可能是姜黄素抑制GR mRNA 和蛋白水平的表达,进而通过ERK通路调节Stat3蛋白表达或GR与Stat3之间直接相互作用,最后调控细胞的增殖。本研究结果显示,GR参与了NSC增殖的调控,但其中具体调控机制仍需GR基因沉默的技术进一步来证明。由于本研究是在离体实验中进行的,需要进一步的动物实验证明。
[1] Lim GP, Chu T, Yang F, Beech W, Frautschy SA, Cole GM. The curry spice curcumin reduces oxidative damage and amyloid pathology in an Alzheimer transgenic mouse[J].JNeurosci, 2001, 21(21):8370-8377.
[2] Nam SM, Choi JH, Yoo DY, Kim W, Jung HY, Kim JW,etal. Effects of curcumin (Curcumalonga) on learning and spatial memory as well as cell proliferation and neuroblast differentiation in adult and aged mice by upregulating brain-derived neurotrophic factor and CREB signaling[J].JMedFood, 2014, 17(6):641-649.
[3] Rajasekar N, Dwivedi S, Tota SK, Kamat PK, Hanif K, Nath C,etal. Neuroprotective effect of curcumin on okadaic acid induced memory impairment in mice[J].EurJPharmacol, 2013, 715(1-3):381-394.
[4] Tiwari V, Chopra K. Protective effect of curcumin against chronic alcohol-induced cognitive deficits and neuroinflammation in the adult rat brain[J].Neuroscience, 2013, 244:147-158.
[5] Huang Z, Zhong XM, Li ZY, Feng CR, Pan AJ, Mao QQ. Curcumin reverses corticosterone-induced depressive-like behavior and decrease in brain BDNF levels in rats[J].NeurosciLett, 2011, 493(3):145-148.
[6] Tiwari SK, Agarwal S, Seth B, Yadav A, Nair S, Bhatnagar P,etal. Curcumin-loaded nanoparticles potently induce adult neurogenesis and reverse cognitive deficits in Alzheimer′s disease model via canonical Wnt/β-catenin pathway[J].ACSNano, 2014, 8(1):76-103.
[7] Doggui S, Sahni JK, Arseneault M, Dao L, Ramassamy C. Neuronal uptake and neuroprotective effect of curcumin-loaded PLGA nanoparticles on the human SK-N-SH cell line[J].JAlzheimersDis, 2012, 30(2):377-392.
[8] Zhu YG, Chen XC, Chen ZZ, Zeng YQ, Shi GB, Su YH,etal. Curcumin protects mitochondria from oxidative damage and attenuates apoptosis in cortical neurons[J].ActaPharmacolSin, 2004, 25(12):1606-1612.
[9] Xu Y, Li S, Vernon MM, Pan J, Chen L, Barish PA,etal. Curcumin prevents corticosterone-induced neurotoxicity and abnormalities of neuroplasticity via 5-HT receptor pathway[J].JNeurochem, 2011, 118(5):784-795.
[10] Kim SJ, Son TG, Park HR, Park M, Kim MS, Kim HS,etal. Curcumin stimulates proliferation of embryonic neural progenitor cells and neurogenesis in the adult hippocampus[J].JBiolChem, 2008, 283(21):14497-14505.
[11] Bose R, Moors M, Tofighi R, Cascante A, Hermanson O, Ceccatelli S. Glucocorticoids induce long-lasting effects in neural stem cells resulting in senescence-related alterations[J].CellDeathDis, 2010, 1:e92.
[12] David DJ, Samuels BA, Rainer Q, Wang JW, Marsteller D, Mendez I,etal. Neurogenesis-dependent and -independent effects of fluoxetine in an animal model of anxiety/depression[J].Neuron, 2009, 62(4):479-493.
[13] Fujioka A, Fujioka T, Ishida Y, Maekawa T, Nakamura S. Differential effects of prenatal stress on the morphological maturation of hippocampal neurons[J].Neuroscience, 2006, 141(2):907-915.
[14] Cato AC, Nestl A, Mink S. Rapid actions of steroid receptors in cellular signaling pathways[J].SciSTKE, 2002, 2002(138):re9.
[15] Langlais D, Couture C, Balsalobre A, Drouin J. The Stat3/GR interaction code: predictive value of direct/indirect DNA recruitment for transcription outcome[J].MolCell, 2012, 47(1):38-49.
[16] Samarasinghe RA, Witchell SF, DeFranco DB. Cooperativity and complementarity: synergies in non-classical and classical glucocorticoid signaling[J].CellCycle, 2012, 11(15):2819-2827.
[17] Kuroki M, O′Flaherty JT. Extracellular signal-regulated protein kinase (ERK)-dependent and ERK-independent pathways target STAT3 on serine-727 in human neutrophils stimulated by chemotactic factors and cytokines[J].BiochemJ, 1999, 341(Pt 3):691-696.
[18] Wei ZZ, Yu SP, Lee JH, Chen D, Taylor TM, Deveau TC,etal. Regulatory role of the JNK-STAT1/3 signaling in neuronal differentiation of cultured mouse embryonic stem cells[J].CellMolNeurobiol, 2014, 34(6):881-893.
[19] Matsuda T, Nakamura T, Nakao K, Arai T, Katsuki M, Heike T,etal. STAT3 activation is sufficient to maintain an undifferentiated state of mouse embryonic stem cells[J].EMBOJ, 1999, 18(15):4261-4269.
(本文编辑: 乔 虹)
Curcumin stimulates proliferation of rat neural stem cellsby inhibiting glucocorticoid receptors
MA Xiao-xiao, WANG Chun-man, ZHANG Gao-long, ZUO Chun-long, HUANG Yi-xiang,LIU Jin, LIAN Qing-quan, LIN Han
(DepartmentofAnesthesiology,theSecondAffiliatedHospitalofWenzhouMedicalUniversity,Wenzhou325000,China)
OBJECTIVE To investigate the effect of curcumin on proliferation of neural stem cells (NSCs) of rats and the mechanism. METHODS NSCs derived from the forebrain of rat E15 embryos were culturedinvitroand identified by neuroepithelial stem cell protein (nestin and SOX2) staining. NSCs were treated with curcumin 0.1, 0.5, 2.5, 12.5 and 62.5 μmol·L-1for 24 h, respectively. The cytotoxicity was estimated by measuring the release of lactate dehydrogenase(LDH). Cell viability and proliferation were analyzed respectively by MTT and BrdU assay. The mRNA expression levels of glucocorticoid receptor (GR), Stat3, Notch1 and p21 were detected by qRT-PCR. The protein expression levels of total GR, Stat3 and phosphorylated Stat3 were measured by Western blotting. RESULTS The primary neural stem cells were identified as NSCs. Curcumin 12.5 and 62.5 μmol·L-1had cell cytotoxicity(P<0.05). Cell viability assay indicated that curcumin 0.5 and 2.5 μmol·L-1enhanced NSCs viability(P<0.05), but in 62.5 μmol·L-1group the cell cytotoxicity was inhibited(P<0.05). Curcumin 0.1, 0.5 and 2.5 μmol·L-1increased NSCs proliferation(P<0.05), whereas 12.5 and 62.5 μmol·L-1caused a decrease in NSCs proliferation(P<0.05). The mRNA expression level of GR in 0.5 μmol·L-1group was significantly reduced(P<0.05). Western blotting analysis revealed that the protein expression of GR, Stat3 and p-Stat3 was inhibited by curcumin in 0.5 μmol ·L-1group(P<0.05). CONCLUSION Curcumin stimulates NSCs proliferation, possibly by inhibiting GR mRNA and related protein expression.Key words: curcumin; neural stem cells; cell proliferation; receptors, glucocorticoid
LIN Han, E-mail: nanlinhannansh@qq.com; LIAN Qing-quan, E-mail: lianqingquanmz@163.com
浙江省科技厅钱江人才计划(2012R10073);浙江省自然科学基金(Y14H090071);浙江省医药卫生平台重点资助计划(2012ZDA037);浙江省卫生厅中医药优秀青年人才基金计划(2010ZQ011)
马晓晓,女,硕士研究生,主要从事神经毒理学研究;林 函,男,博士,主要从事麻醉药神经发育毒性的研究;连庆泉,男,博士,主要从事麻醉药成瘾性研究。
林 函, E-mail: nanlinhannansh@qq.com; 连庆泉, E-mail: lianqingquanmz@163.com
R962,R285.5
A
1000-3002(2015)02-0202-06
10.3867/j.issn.1000-3002.2015.02.003
Foundation item: The project supported by Qianjiang Talents Program of Zhejiang Provincial Science and Technology Bureau(2012R10073); Zhejiang Provincial Natural Science Foundation(Y14H090071); Zhejiang Provincial Medical and Health Platform(2012ZDA037); and Youth Talents Funding Program of Zhejiang Provincial Health Bureau of Traditional Chinese Medicine(2010ZQ011)
2014-12-02 接受日期: 2015-03-05)
--------------------
