抗氧化剂阿魏酸自组装金纳米颗粒的体外抗氧化
2015-03-01张晗李砚超姜玉刚杜立波施维刘扬
张晗, 李砚超, 姜玉刚, 杜立波, 施维, 刘扬
(1. 吉林大学 分子酶学工程教育部重点实验室, 吉林 长春 130012;
2. 中国科学院化学研究所 分子动态与稳态结构国家重点实验室, 北京 100190)
抗氧化剂阿魏酸自组装金纳米颗粒的体外抗氧化
张晗1, 李砚超2, 姜玉刚2, 杜立波2, 施维1, 刘扬2
(1. 吉林大学 分子酶学工程教育部重点实验室, 吉林 长春 130012;
2. 中国科学院化学研究所 分子动态与稳态结构国家重点实验室, 北京 100190)
摘要:对纳米阿魏酸抗氧化剂在巨噬细胞上的抗氧化保护作用进行检测,并采用电子顺磁-自旋捕获技术和光谱法对纳米阿魏酸在细胞水平上清除自由基的能力进行检测.实验结果表明:与抗氧化剂单体相比,纳米阿魏酸抗氧化剂可以更为有效地清除由细胞外界叔丁基过氧化物(t-BuOOH)刺激所产生的活性氧自由基.同时,通过光谱法对细胞膜脂质过氧化物指标丙二醛进行检测,证明纳米抗氧化剂可以更为有效地保护经受外界刺激的巨噬细胞.通过自组装方式可将抗氧化剂纳米化有利于提高抗氧化剂的抗氧化水平.
关键词:电子自旋共振; 抗氧化剂; 自旋捕获; 纳米金; 脂质过氧化
氧化应激是很多慢性疾病如癌症、动脉粥样硬化和神经退行性疾病等的重要诱因之一[1-2].抗氧化剂对这些疾病的抵御作用吸引学者们对其进行了广泛的研究[3-5],并且促进了用于治疗氧化应激相关疾病的新型抗氧化剂的开发.抗氧化剂的体内抗氧化活性强弱是其应用于疾病治疗的决定因素之一[6].因此,目前大部分抗氧化剂研究主要集中于高活性抗氧化剂的设计和合成[7].然而,尽管已有大量高活性的抗氧化剂出现,但这些抗氧化剂常常伴随着不可预期的细胞毒性等生物相容性问题[8-9].如何在不改变抗氧化剂功能基团的前提下,增强其抗氧化活性并且最大程度提高其生物相容性,对于抗氧化剂的设计和应用具有重要的意义.Du等[10]为这一问题的解决提供了一种可行的方案,即将抗氧化剂自组装到纳米颗粒表面后,在不改变功能基团的前提下,实现抗氧化活性的提高.然而该纳米抗氧化剂的生物相容性还不理想,限制了其在生物体内的广泛应用.为此,在前期工作的基础上,设计并合成了一种聚乙二醇作为配基、阿魏酸功能化的具有高生物相容性的纳米抗氧化剂,进一步检验这一高生物相容性的纳米抗氧化剂是否兼具良好的抗氧化能力,本文对该纳米抗氧化剂在细胞水平上的抗氧化活性进行了测试.
1实验部分
1.1 实验材料
试剂.佛波酯(PMA)、L-精氨酸(L-Arg)、N-硝基-L-精氨酸(N-L-Arg)(美国Sigma公司);氯金酸(沈阳市金科试剂厂);微量丙二醛 (MDA) 检测试剂盒(南京碧云天生物科技有限公司);自由基捕获探针BMPO和纳米阿魏酸为本实验室合成;其余试剂均购自北京化学试剂公司.
仪器.Burker ESP 300型顺磁共振波谱仪;Hitachi UV 3310型紫外-可见分光光度计.
1.2 电子自旋共振(ESR)捕获实验
用含10%胎牛血清的DMEM完全培养基培养RAW 264.7细胞,待细胞生长至80%融合度时,消化离心,并用pH值为7.4的PBS缓冲液悬浮,调整细胞密度为5.0×106cell·mL-1.每孔1 mL细胞悬液置于12孔培养板内,分别设置空白对照组、PMA对照组和药物保护组,加入相同浓度的L-Arg(用PBS配制,0.1 mmol·L-1)孵育30 min,每组设3个重复.药物保护组分别加入阿魏酸(或者纳米阿魏酸),混匀并孵育1 min后,加入20 μg·mL-1PMA,随即进行ESR测试.
1.3 MDA测试实验
含10%胎牛血清的DMEM完全培养基悬浮RAW 264.7细胞,调整细胞密度为1.0×105cell·mL-1,每孔3 mL细胞悬液接种于6孔培养板,每组设3个重复.待细胞贴壁生长12 h后,弃去原培养液,分别加入含一定浓度阿魏酸和纳米阿魏酸的培养基孵育2 h,之后加入相同浓度的t-BuOOH(用含2%胎牛血清的DMEM维持培养基配制).作用1 h后,裂解细胞,用微量MDA测定试剂盒进行检测.
2结果与讨论
2.1 纳米抗氧化剂的体外抗氧化保护实验
PMA刺激巨噬细胞除产生一氧化氮自由基外,还会产生大量的超氧自由基,而超氧阴离子自由基又极易与NO反应,生成过氧亚硝基自由基,从而造成蛋白和DNA的损伤,引起细胞的凋亡[11-12].因此,PMA刺激巨噬细胞产生超氧自由基可以作为评价细胞产生氧化应激的模型.以此模型为例,检测了抗氧化剂保护的金纳米颗粒在细胞层面的抗氧化保护效果.
目前,细胞自由基清除效果可用活性氧荧光探针,通过检测细胞活性氧荧光强度的变化来判断[13],然而金纳米颗粒容易造成荧光的淬灭,会对荧光检测产生干扰[14].因此,采用电子顺磁-自旋顺磁共振(ESR-spin trapping)法,通过间接检测自旋捕获探针捕获自由基信号强度的变化,实现细胞层面上的抗氧化保护效果评价.首先,在BMPO[15]存在下,用PMA刺激经L-Arg孵育的巨噬细胞.一方面,刺激细胞产生NO (约1.8 μmol·L-1)[16];另一方面,PMA可以直接刺激NADPH酶产生超氧阴离子自由基.NO易与超氧阴离子自由基反应形成过氧亚硝酰自由基,而且NO与超氧阴离子自由基的反应速率较快(109(mol· s)-1)[17],但使用的BMPO捕捉剂的浓度高达100 mmol·L-1,其捕获超氧的速率为102(mol· s)-1[18].同时,考虑到刺激产生的NO与超氧阴离子之间的扩散速率因素,所以通过BMPO捕获实验,仍可以得到超氧阴离子自由基加合物的信号.在此条件下,提前加入SOD孵育后,可以明显地观察到自由基加合物的信号峰消失,进一步说明BMPO捕获的是超氧阴离子自由基.
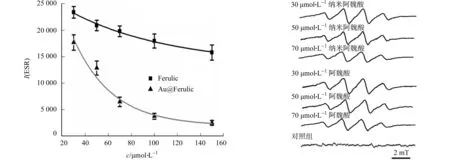
图1 不同浓度阿魏酸单体和纳米阿魏酸 图2 不同浓度纳米阿魏酸和阿魏酸 清除细胞氧化应激产生的自由基 清除细胞内自由基(O2·-)的ESR谱图 Fig.1 Free radical-inhibiting activities of different Fig.2 Cellular free radical (O2·-) scavenging concentrations of Ferulic acid and Au@Ferulic acid ESR spectra of Ferulic acid and Au@Ferulic acid
随着L-Arg浓度(0~2 mmol·L-1)的增加,其超氧自由基加合物的信号也逐渐增加,这表明PMA刺激巨噬细胞产生超氧阴离子自由基有可能依赖于NO的产生.前期研究中也证明,随着L-Arg量的增加,巨噬细胞内产生的NO量也逐渐增加[16],而且NO的产生与ROS的产生有着密切的关系,其浓度每增加1倍, ROS增加约1.5倍[19].加入L-Arg的抑制剂N-L-Arg,可以观察到超氧自由基加合物的信号出现了明显的降低,进一步说明NO的产生与超氧阴离子自由基的产生有着密切的联系.综上所述,这种由PMA刺激巨噬细胞的模型可以用于细胞的抗氧化保护检测.在本实验中,金纳米颗粒的浓度指的是其表面抗氧化剂阿魏酸的总浓度,这样方便与游离抗氧化剂进行抗氧化活性的比较.分别考察不同浓度纳米阿魏酸(Au@Ferulic)和阿魏酸单体对细胞内产生活性氧的浓度效应,如图1,2所示.图1中:c是阿魏酸的浓度;I(ESR)是电子自旋共振波谱的强度.图2中的ESR条件:微波功率为12.9 mW;信号增益为1×104;调制幅度为0.1 mT;扫宽为10 mT;时间常数为0.164 s;扫描时间为84 s.
实验结果表明:只需要30 μmol·L-1的纳米阿魏酸就可以达到细胞内所产生活性氧的半数抑制率;相反,对于单体而言,其清除活性氧的浓度则需要150 μmol·L-1.由此可知,将阿魏酸包裹在金纳米颗粒上与阿魏酸单体相比,能够显著提高细胞内活性氧自由基清除速率.

图3 阿魏酸和纳米阿魏酸抑制叔丁基过氧化物刺激细胞产生MDA实验Fig.3 Inhibition of intracellular malondialdehyde (MDA) by Ferulic acid and Au@Ferulic acid
2.2 抑制细胞脂质过氧化实验
为进一步验证Au@Ferulic在细胞层面的抗氧化保护效果,利用硫代巴比妥酸(TBA)法对细胞内的脂质过氧化产物丙二醛(MDA)进行了检测,结果如图3所示.由图3可知:由t-BuOOH处理的巨噬细胞组,其MDA值增长了4倍;而由阿魏酸单体和纳米阿魏酸处理的巨噬细胞,与t-BuOOH处理组相比,其MDA值分别降低了39.2%和60.5%.由此可知:抗氧化剂特别是纳米抗氧化剂,可以明显地抑制t-BuOOH引起的细胞脂质过氧化损伤,起到保护细胞免受氧化应激的作用.大量实验表明:金纳米颗粒易于通过内吞作用进入细胞内,达到在细胞内富集的作用[20];金纳米颗粒表面PEG化也有利于提高金纳米颗粒在体内的循环时间和药物的生物相容性, 进而增加药效[21].因此,纳米抗氧剂产生高抗氧化活性的原因可能是抗氧化剂纳米化后更易透过细胞膜进入细胞内,从而快速发挥抗氧化作用.
3结束语
以设计合成的抗氧化剂阿魏酸保护的金纳米颗粒为基础,利用电子顺磁-自旋顺磁共振法对其在细胞层面上的抗氧化效果进行了检测.证明了纳米抗氧化剂可以有效地抑制由外界刺激所产生的活性氧对细胞的损害.结果表明:纳米抗氧化剂具有潜在的生物学应用前景,更为重要的是,通过将抗氧化剂修饰到纳米颗粒表面来制备纳米抗氧化剂的方式,为新型抗氧化剂的设计和合成提供了一种全新的策略.
参考文献:
[1]HALLIWELL B,GUTTERIDGE J M C.Free radicals in biology and medicine[M].New York:Oxford University Press,1999:617-783.
[2]SIES H.Antioxidants in disease mechanisms and therapy[M].San Diego:Academic Press,1997:1-691.
[3]MARGAILL I,PLOTKINE M,LEROUET D.Antioxidant strategies in the treatment of stroke[J].Free Radic Biol Med,2005,39(4):429-443.
[4]PRYOR W A.Vitamin E and heart disease: Basic science to clinical intervention trials[J].Free Radic Biol Med,2000,28(1):141-164.
[5]BURTON G W,INGOLD K U.Vitamin E: Application of the principles of physical organic chemistry to the exploration of its structure and function[J].Acc Chem Res,1986,19(7):194-201.
[6]HABTEMARIAM S.Methyl-3-O-methyl gallate and gallic acid from the leaves of peltiphyllum peltatum: Isolation and comparative antioxidant, prooxidant, and cytotoxic effects in neuronal cells[J].J Med Food,2011, 14(11): 1412-1418.
[7]MUKAI K,OKABE K,HOSOSE H.Synthesis and stopped-flow investigation of antioxidant activity of tocopherols: Finding of new tocopherol derivatives having the highest antioxidant activity among phenolic antioxidants[J].J Org Chem,1989,54(3):557-560.
[8]CERECETTO H,LOLEZ G V.Antioxidants derived from vitamin E: An overview[J].Mini-Rev Med Chem,2007,7(3):315-338.
[9]NIE Zhou,LIU Ke-jian,ZHONG Chuan-jian,et al.Enhanced radical scavenging activity by antioxidant-functionalized gold nanoparticles: A novel inspiration for development of new artificial antioxidants[J].Free Radic Biol Med,2006,43(9):1243-1254.
[10]DU Li-bo,SUO Si-qin-gao-wa,WANG Guang-qing,et al.Mechanism and cellular kinetic studies of the enhancement of antioxidant activity by using surface-functionalized gold nanoparticles[J].Chem Eur J,2013,19(4):1281-1287.
[11]BEDARD K,KRAUSE K H.The NOX family of ROS-generating NADPH oxidases: Physiology and pathophysiology[J].Physiol Rev,2007,87(1):245-313.
[12]ROTA C,CHIGNELL C F,MASON R P.Evidence for free radical formation during the oxidation of 2′,7′-dichlorofluorescin to the fluorescent dye 2′,7′-dichlorofluorescein by horseradish peroxidase: Possible implications for oxidative stress measurements[J].Free Radic Biol Med,1999,27(7/8):873-881.
[13]ERATHODIYIL N,YING J Y.Functionalization of inorganic nanoparticles for bioimaging applications [J].Acc Chem Res,2011,44(S1):925-935.
[14]刘扬,杜立波.中国自由基捕获技术发展30年[J].波谱学杂志,2010,27(1):39-50.
[15]王广清,杜立波,刘扬,等.链接琥珀酰亚胺的线性硝酮的合成与ESR研究[J].波谱学杂志,2010,27(1):80-87.
[16]LI Hai-tao,HU Jun-gai,XIN Wen-juan,et al.Production and interaction of oxygen and nitric oxide free radicals in PMA stimulated macrophages during the respiratory burst[J].Redox Report,2000,5(6):353-358.
[17]AMATORE C,ARBAULT S,BOUTON C,et al.Real-time amperometric analysis of reactive oxygen and nitrogen species released by single immunostimulated macrophages[J].ChemBioChem,2008,9(9):1472-1480.
[18]VILLAMENA F A,XIA S J,MERLE J K,et al.Reactivity of superoxide radical anion with cyclic nitrones: Role of intramolecular H-bond and electrostatic effects[J].J Am Chem Soc,2007,129(26):8177-8191.
[19]ZHAO Kai,HUANG Zhen,LU Hong-ling,et al.Induction of inducible nitric oxide synthase increases the production of reactive oxygen species in RAW 264.7 macrophages[J].Biosci Rep,2010,30(4):233-241.
[20]MA Xiao-wei,WU Yan-yang,JIN Shu-bin,et al.Gold Nanoparticles induce autophagosome accumulation through size-dependent nanoparticle uptake and lysosome impairment[J].ACS Nano,2011,5(11):8629-8639.
[21]OH E,DELEHANTY J B,SAPSFORD K E,et al.Cellular uptake and fate of PEGylated gold nanoparticles is dependent on both cell-penetration peptides and particle size[J].ACS Nano,2011,5(8):6434-6448.
(责任编辑: 黄晓楠 英文审校: 刘源岗)
In Vitro Antioxidant Activity Study of Ferulic Acid
Self-Assembled Gold Nanoparticles
ZHANG Han1, LI Yan-chao2, JIANG Yu-gang2,
DU Li-bo2, SHI Wei1, LIU Yang2
(1. Key Laboratory for Molecular Enzymology and Engineering, the Ministry of Education,
Jilin University, Changchun 130012, China;
2. State Key Laboratory for Structural Chemisty of Unstable and Stable Species,
Institute of Chemistry Chinese Academy of Sciences, Beijing 100190, China)
Abstract:The antioxidant protection effects of ferulic acid nanoantioxidant on macrophage cells were studied and the free radical-inhibiting activities of ferulic acid nanoantioxidant were determined at the cellular level using electron spin resonance-spin trapping and UV-spectrum method. The results illustrates that the nanoantioxidant could eliminate the reactive oxygen species stimulated by t-BuOOH in cells more effectively than that of antioxidants monomers. Meanwhile, the lipid peroxide detection of malondialdehyde by spectrum method also proved that the nanoantioxidant have a high antioxidant activity on t-BuOOH stimulated macrophage cells. Therefore, it could be concluded that the self-assembled nanoantioxidant have a potential for the enhancement of antioxidant activity.
Keywords:electron spin resonance; antioxidant; spin trapping; gold nanoparticles; lipid peroxide
基金项目:国家自然科学基金资助项目(31300697, 91227122)
通信作者:杜立波(1980-),男,副研究员,主要从事自由基与生命科学的研究.E-mail:dulibo@iccas.ac.cn.
收稿日期:2014-07-02
中图分类号:O 482.53
文献标志码:A
doi:10.11830/ISSN.1000-5013.2015.01.0060
文章编号:1000-5013(2015)01-0060-04
