血小板衍生生长因子调节休克血管反应性的非MLC20磷酸化机制与HSP27和Caldesmon的关系
2015-03-01彭小勇
朱 娱,彭小勇,蓝 丹,李 涛
严重创伤/休克晚期常出现血管的低反应性,表 现为全身血管对缩血管物质或舒血管物质的反应降低或不反应,是导致休克后期血压不能有效提升、组织灌注难以改善、组织缺氧和损伤进行性加重的重要原因[1-2]。已有研究发现血管低反应性的发生与肾上腺能受体失敏、血管平滑肌细胞(vascular smooth muscle cell,VSMC)钾、钙功能失常及细胞膜超极化有关[3]。这些机制均通过抑制MLC20磷酸化发挥作用。近来研究表明:非MLC20磷酸化也参与血管平滑肌细胞的收缩。Lee等[4]报道了ET-1诱导兔子主动脉的收缩,但MLC20磷酸化水平没有增加;Su等[5]发现组胺能使猪平滑肌细胞收缩,PI3K的抑制剂wortmannin能减少组胺引起的平滑肌细胞收缩,但不减少MLC20磷酸化水平。这些结果均表明非MLC20磷酸化通路参与平滑肌细胞收缩的调节。然而,非MLC20磷酸化通路是否参与休克后血管低反应性的发生,以及怎样调节血管低反应性,尚不清楚。
许多研究证实:Caldesmon和27-kDa的热休克蛋白(HSP27)通过调节肌球蛋白和肌动蛋白(不涉及MLC20磷酸化通路),参与平滑肌细胞的收缩。Caldesmon是调节细肌丝的蛋白,其C端结合肌动蛋白,抑制肌球蛋白ATP酶活性,导致平滑肌收缩减弱[6-9]。HSP27是热休克蛋白家族的一员,广泛分布于不同组织和细胞中。在平滑肌和心肌细胞,HSP27作为肌动蛋白的分子伴侣与细肌丝一起参与细胞骨架的调节。Caldesmon和HSP27是否通过非MLC20磷酸化参与休克后血管低反应性的发生尚不清楚。
血小板衍生的生长因子(platelet derived-growth factor,PDGF)是血管内皮生长因子中的重要成员,在许多组织和细胞中均有表达,包括血管内皮细胞、巨噬细胞和单核细胞[10]。PDGF除了在急性损伤和一些慢性损伤中能够加速组织修复和伤口愈合外,还能引起血管平滑肌细胞收缩[11-13]。通过预实验发现,PDGF能够激活平滑肌细胞中Caldesmon和HSP27的表达。因此本实验采用失血性休克和缺氧处理的肠系膜上动脉(SMA)作为模型,来探讨PDGF在血管低反应中调节非MLC20磷酸化的机制,以及与Caldesmon和HSP27的关系。
材料与方法
1 动物模型及方法
动物模型:SD大鼠(200~250g),雌雄不拘,由第三军医大学第三附属医院实验动物中心提供(所有动物遵照第三军医大学实验动物指南规范操作),禁食过夜,自由饮水,3%戊巴比妥钠麻醉,行左股动脉插管,用于监测血压。插管后稳定10min,从左股动脉抽血使平均动脉压降至40mmHg,维持2h,制成失血性休克模型。
血管的准备:从休克或假手术组的大鼠取出SMA,去掉周围的结缔组织后,将其切成2~3mm长的动脉环,用于张力测定。根据实验要求,对血管环行缺氧或不缺氧处理,缺氧组血管环放到缺氧罐中,95%N2和 5%CO2以 10L/min充氧 15min,平衡10min,重复3次直到氧浓度<0.2%,维持2h,制成缺氧模型。
血管反应性测定:将已处理的血管环悬挂于一对不锈钢丝上,一端置于固定柱上,另一端与肌张力换能器相连,放入注有K-H液[Krebs-Henseleit solution,组成(mM):NaCl 118、KCl 4.7、NaHCO325、KH2PO4 1.03、MgSO4·7H2O 0.45、CaCl22.5、葡萄糖11.1、pH 7.4]的离体器官灌流浴槽中,持续充入95%O2和5%CO2混合气体,给予血管环初张力0.5g、37℃恒温孵育120min,每30min换液1次,待张力曲线平稳后,依次加入终浓度分别为 10-9、10-8、10-7、10-6、10-5和 10-4mol/L 的去甲肾上腺素(NE)。血管环对NE的反应性用浓度累计法测定,记录不同NE浓度下各血管环产生的最大收缩力,以收缩力/血管环重量(g/mg组织)为量化标准,作量-效曲线和Emax图评价血管收缩反应性。
MLC20磷酸化:取大鼠的肠系膜动脉置于含丙酮、二硫苏糖醇(DTT)的保存液中-70℃保存固定3d,然后将血管晾干后剪碎,加蛋白提取液混匀后在摇床上振荡1.5h,15 000rmp离心15min后取上清,即为蛋白。
HSP27和Caldesmon的表达:制备蛋白样品后置于-70℃保存备用。变性后用10%SDS-PAGE凝胶电泳分离蛋白,湿转法将蛋白转移到PVDF膜上,用5%脱脂奶粉封闭2h后,三羟甲基氨基甲烷缓冲液(TBST)洗涤3次,用HSP27和HSP27磷酸化(p-HSP27)抗体1∶1000,CaD和 CaD磷酸化(p-CaD)抗体1∶1000孵育4℃过夜,TBST洗涤3次后,与二抗1∶10000室温孵育1h,TBST洗涤4次后,使用电化学发光液(ECL)进行反应,暗室曝光。使用β-肌动蛋白(β-actin)作为阳性对照。
2 实验步骤
2.1 非MLC20磷酸化途径在PDGF调节休克后血管反应性中的作用 将48只大鼠随机分成6组,每组8只,分别为:假手术组、休克组、休克+PDGF(40、60、80、100ng/ml)组。SMA 用于测定对 NE 的反应性[14](AD 设备,Castle Hill,NSW,澳大利亚),剩下的肠系膜动脉用于测定MLC20磷酸化水平。在休克+PDGF(40、60、80、100ng/ml)组,SMA 和肠系膜动脉均孵育 PDGF(40、60、80、100ng/ml)15min,再观察血管的收缩反应和MLC20磷酸化水平。用甘油聚丙烯凝胶电泳测定MLC20磷酸化水平,用累积的去甲肾上腺素浓度来反映SMA的反应性[15]。
2.2 Caldesmon和HSP27在PDGF调节血管反应性中的作用及与MLC20途径的关系 为了观察Caldesmon和HSP27在PDGF是否通过非MLC20磷酸化调节血管的收缩反应中的作用,用不同浓度的PDGF作用后,观察 Caldesmon(p-Caldesmon)和HSP27(p-HSP27)的蛋白水平变化,以及用Caldesmon和HSP27的反义寡核苷酸(AODN)抑制后(CaldesmonAODN序列:5-TCTCTTCCTCCTCCTCCTCCT-3';HSP27AODN序列:5-ATCTCCACCACGCCTTCCTT-3'),观察PDGF在非MLC20磷酸化中调节血管的收缩反应性和MLC20磷酸化水平。Caldesmon或HSP27AODN(终浓度100u M)与转染试剂以体积比5∶1转染正常大鼠血管环,24h后行缺氧处理,同时用100ng/ml PDGF孵育血管环。实验当天,血管环按上述方法缺氧,观察SMA对NE的收缩反应及Caldesmon和HSP27的表达情况。
3 统计分析
结 果
1 非MLC20磷酸化途径在PDGF调节休克后血管反应性中的作用
血管反应性:与假手术组比较,休克后SMA的血管反应性显著下降,不同浓度的 PDGF(40、60、80、100ng/ml)可以改善血管反应性,呈剂量依赖性;用不同浓度 PDGF(40、60、80、100ng/ml)孵育后,血管反应性从休克组的0.708(g/mg组织)分别增加到1.232、1.371、1.671、1.803(g/mg 组织)。与休克组比较,PDGF不同浓度增加血管反应性比例分别为74.01%、93.64%、136.01%、154.66%(图1)。
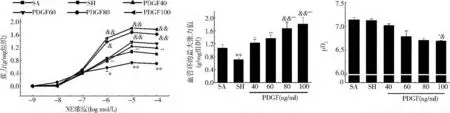
图1 不同浓度PDGF对血管反应性的影响
MLC20磷酸化:与假手术组比较,肠系膜动脉的MLC20磷酸化显著降低,从假手术组的32.56%降低到休克组10.26%。不同浓度的PDGF增加MLC20磷酸化,但PDGF不同浓度间的MLC20磷酸化水平无显著性差异,分别为 30.23%(40ng/ml)、31.25%(60ng/ml)、31.02%(80ng/ml)、31.56%(100ng/ml)(图2)。
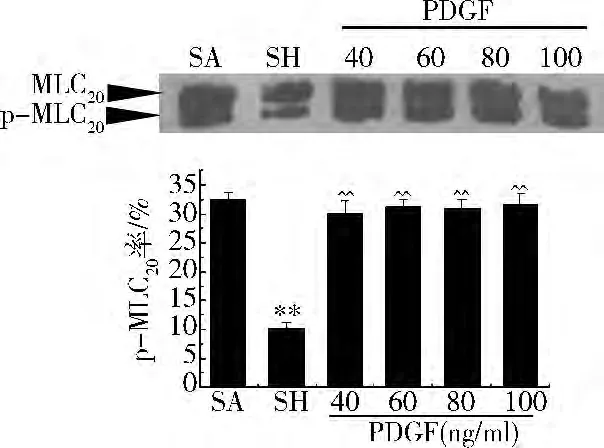
图2 不同浓度PDGF的MLC20磷酸化
2 Caldesmon和HSP27在非MLC20磷酸化途径中调节血管反应性的作用
Caldesmon和HSP27磷酸化:在对照组、休克组和不同浓度的PDGF组中,Caldesmon和HSP27的蛋白表达无显著性变化,但休克后Caldesmon的磷酸化增加而 HSP27的磷酸化降低,不同浓度的PDGF(40、60、80和100ng/ml)可以逐渐降低休克引起的Caldesmon磷酸化的增加,而增加休克导致的HSP27磷酸化的下降(图3)。
血管反应性:与对照组比较,缺氧后血管反应性降低,PDGF100ng/ml可以增加SMA的血管反应性,HSP27AODN可以抑制PDGF引起的血管反应性的增加,CaldesmonAODN可进一步增加PDGF诱导的血管反应性的增加(图4)。
MLC20磷酸化:与对照组比较,休克组的肠系膜动脉的MLC20磷酸化降低,PDGF100ng/ml可以增加休克后肠系膜动脉的MLC20磷酸化,HSP27和CaldesmonAODN不能抑制PDGF引起的MLC20磷酸化的增加(图5)。
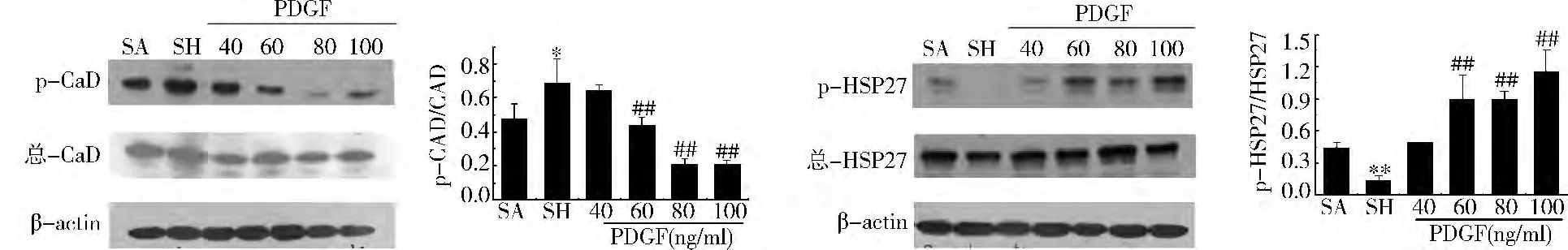
图3 不同浓度PDGF对Caldesmon和HSP27磷酸化水平的影响
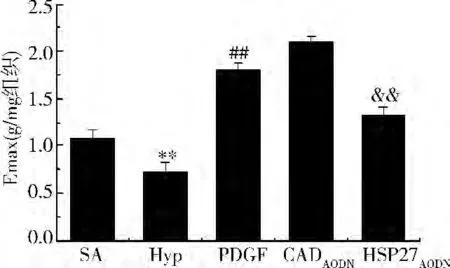
图4 HSP27AODN和CaldesmonAODN在PDGF调节休克血管反应性中的作用
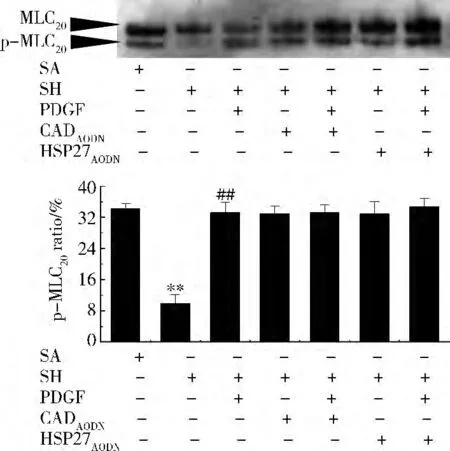
图5 HSP27AODN和CaldesmonAODN对MLC20磷酸化的影响
讨 论
血管低反应严重影响着疾病的发生、发展和治疗,它是许多危重症的重要死亡原因之一。目前的研究表明休克后血管低反应性的发生机制与平滑肌细胞受体失敏、膜超极化以及我们实验室提出的钙失敏有关。严重创伤或休克后,高浓度的血管活性物质,大量的一氧化氮(NO)、内皮素、肿瘤坏死因子(TNF)、白细胞介素(IL)或内源性的阿片肽引起受体降解、内化或去磷酸化;在休克或创伤时,三磷酸腺苷(ATP)缺乏导致了ATP敏感的ATP依赖的钾离子通道(KATP)激活,细胞内钙浓度降低,MLC20磷酸化和血管反应性下降。我们先前的实验进一步证明了钙敏感性的降低,Rho蛋白(Rho kinase)和蛋白激酶 C(PKC)通过抑制 MLCP的活性,增加MLC20磷酸化调节钙敏感性[16-18]。这些引起休克后血管低反应性的机制主要是通过降低MLC20磷酸化水平从而降低血管的收缩反应。
目前的研究表明,非MLC20磷酸化通路参与了休克后血管低反应性的发生。Caldesmon和HSP27也参与休克后血管低反应性的调节。Caldesmon是一种特殊的肌动蛋白结合蛋白,在体内广泛存在,分为轻型和重型。重型钙调蛋白结合蛋白只在血管和内脏平滑肌以及肌上皮细胞有表达,其C端包括肌动蛋白结合域,原肌球蛋白结合域和钙调蛋白结合域,在N端具有肌球蛋白结合域[18]。重型钙调蛋白不仅可以起到抑制肌球蛋白Mg-ATP酶活性的作用,还可以抑制平滑肌磷酸化肌球蛋白所引发的肌动蛋白丝的移动,是一种重要的调节蛋白。Caldesmon磷酸化后不再抑制ATP酶活性,有利于肌肉收缩。当平滑肌受外界刺激时,可通过特异性激活PKCε,启动促分裂原活化蛋白激酶(MAPK)途径,通过一系列级联反应,引起Caldesmon间接磷酸化,进而调节平滑肌的收缩。
HSP27是小分子量HSPs(small HSPs,sHSPs)亚家族中的重要一员,具有保护细胞免受各种应激因素的损伤的功能,促进蛋白质的正确折叠;与细胞的增殖、分化及细胞凋亡的信号转导调节密切相关。在多种应激条件下,HSP27作为分子伴侣发挥保护细胞的功能。黄捷等[19]研究结果显示HSP27直接参与了PDGF诱导的细胞迁移过程,论证了HSP27是血管平滑肌细胞迁移的关键调节因子。
本实验结果证实,休克后血管反应性明显降低,不同浓度PDGF能剂量依赖地增加休克血管反应性,却不能剂量依赖地增加MLC20磷酸化水平。休克后Caldesmon的磷酸化增加而HSP27的磷酸化降低,不同浓度的 PDGF(40、60、80和100ng/ml)可以逐渐降低休克引起的Caldesmon磷酸化的增加,而逐渐增加休克导致的HSP27磷酸化的下降。说明PDGF调节休克血管反应性的非MLC20磷酸化机制与HSP27和Caldesmon相关。
[1]陈垦,刘良明.缺氧诱导因子1ɑ对失血性休克大鼠肠系膜上动脉血管环舒张反应性的调控作用[J].第三军医大学学报,2010,32(4):319 -323.
[2]Liu LM,Yang GM,Zhu Y,et al.Role of non - MLC20 phosphorylation pathway in the regulation of vascular reactivity during shock[J].J Surg Res,2014,187(2):571 -580.
[3]Liang JL,Yang GM,Li T,et al.Interleukin 1βattenuates vascular α1 adrenergic receptors expression following lipopolysaccharide-induced endotoxemia in rabbits:involvement of JAK2 - STAT3 pathway[J].J Trauma Acute Care Surg,2014,76(3):762 -770.
[4]Lee HM,Won KJ,Kim J,et al.Endothelin - 1 induces contraction via a syk-mediated p38 mitogen-activated protein kinase pathway in rat aortic smooth muscle[J].J Pharmacol Sci,2007,103(4):427 -434.
[5]Su XL,Smolock EM,Marcel KN,et al.Phosphatidylinositol 3-kinase modulates vascular smooth muscle contraction by calcium and myosin light chain phosphorylation-independent and-dependent pathways[J].Am J Physiol Heart Circ Physiol,2004,286(2):657 -666.
[6]周琴,易光辉.HSP27对动脉损伤的细胞保护机制[J].中国优生与遗传杂志,2010,18(11):137-139.
[7]Lee YR,Lee CK,Park HJ,et al.c - Jun N-terminal kinase contributes to norepinephrine-induced contraction through phosphorylation of caldesmon in rat aortic smooth muscle[J].J Pharmacol Sci,2006,100(2):119 -125.
[8]徐彦龙,高靓,等.针刺调节脑梗死大鼠脑血管平滑肌CaP、CaD变化的实验研究[J].辽宁中医杂志,2012,39:(9):1864-1866.
[9]Mayanagi T,Sobue K.Diversification of caldesmon-linked actin cytoskeleton in cell motility[J].Cell Adh Migr,2011,5(2):150 -159.
[10]Hoch RV,Soriano P.Roles of PDGF in animal development[J].Development,2003,130(20):4679 - 4784.
[11]Judith R,Nithya M,Rose C,et al.Application of a PDGF- containing novel gel for cutaneous wound healing[J].Life Sci,2010,87(1):1 -8.
[12]Mulder G,Tallis AJ,Marshall VT,et al.Treatment of nonhealing diabetic foot ulcers with a platelet-derived growth factor gene-activated matrix(GAM501):results of a phase 1/2 trial[J].Wound Repair Regen,2009,17(6):772-779.
[13]Zhao Y,Lv W,Piao H,et al.Role of platelet- derived growth factor-BB(PDGF-BB)in human pulmonary artery smooth muscle cell proliferation[J].J Recept Signal Transduct Res,2014,[Epub ahead of print].
[14]Li T,Yang GM,Zhu Y,et al.The mechanism by which RhoA regulatesvascularreactivity afterhemorrhagic shock in rats[J].Am J Physiol,2010,299(2):H292 -299.
[15]刘嘉,梁新华,焦炎.小鼠胃和阑尾组织中h-CD降解规律与死亡时间的相关性究[J].中国医学导报,2011,8(6):17 -19.
[16]Li T,Fang YQ,Zhu Y,et al.Beneficial effect of activation of PKC on hemorrhagic shock in rats[J].J Trauma,2010,68(4):865 -873.
[17]闵清,白育庭,刘晶,等.山楂叶总黄酮对大鼠血管环的作用及其机制探讨[J].中国药理学通报,2011,27(4):585-590.
[18]Li T,Fang YQ,Yang GM,et al.Effects of the balance in activity of RhoA and Rac1 on the shock-induced biphasic change of vascular reactivity in rats[J].Ann Surg,2011,253(1):185 -193.
[19]黄捷,谢良地,许昌声,等.RNA干扰热休克蛋白27基因对自发性高血压大鼠血管平滑肌细胞增殖、迁移的影响[J].中华高血压杂志,2010,18(8):761 -764.
