贴壁法和密度梯度离心法分离经血源性子宫内膜间充质干细胞的比较研究
2015-03-01袁碧波
袁 晴,杜 雪,袁碧波,屈 野,周 园,石 慧
(1.天津医科大学总医院妇产科,天津300052;2.武警后勤学院病原生物与免疫学教研室,天津300309;3.中国医学科学院、北京协和医学院血液病医院血液学研究所,实验血液学国家重点实验室,干细胞医学中心,天津300020)
论著
贴壁法和密度梯度离心法分离经血源性子宫内膜间充质干细胞的比较研究
袁 晴1,杜 雪1,袁碧波1,屈 野2,周 园3,石 慧3
(1.天津医科大学总医院妇产科,天津300052;2.武警后勤学院病原生物与免疫学教研室,天津300309;3.中国医学科学院、北京协和医学院血液病医院血液学研究所,实验血液学国家重点实验室,干细胞医学中心,天津300020)
目的:比较贴壁法和密度梯度离心法对经血源性子宫内膜间充质干细胞(MB-MSCs)的分离效果。方法:选择25~35岁月经周期正常的健康女性的月经血,分别采用贴壁法和密度梯度离心法分离MB-MSCs并进行传代。镜下观察原代细胞形态变化;对比原代及第2、3代细胞传代时间;流式细胞仪检测表面标志物;阿尔辛兰染色检测其成软骨能力。结果:贴壁法分离的原代细胞呈聚集样生长,密度梯度离心法分离的原代细胞6 d后也呈聚集样生长。贴壁法分离原代细胞的传代时间(14.58±1.31)d明显快于密度梯度离心法(19.17±1.34)d,差异有显著意义(P<0.05);第2、3代细胞的传代时间两种分离方法差异无统计学意义(P>0.05)。经流式细胞仪检测,两种方法分离的MB-MSCs阳性表面标志物CD44、CD29、CD105、CD73含量和阴性表面标志物CD31、CD45含量比较差异无统计学意义(P>0.05),两种方法分离的第3代细胞经成软骨诱导后比较无显著差别。结论:采用贴壁法与密度梯度离心法分离MB-MSCs效果相似,但贴壁法更适用于早期快速获得纯度较高的细胞。
间充质干细胞;子宫内膜;经血;贴壁法;密度梯度离心法
目前,干细胞在组织工程、细胞工程领域潜在应用价值越来越受到人们重视,迄今,已从成年人的骨髓、胚胎、脐血、外周血[1-4]等中发现了间充质干细胞。2007年,Meng等[5]从健康女性的月经血中分离出干细胞,这是一种新型的干细胞称为经血源性间充质干细胞(menstrual blood mesenchymal stem cells,MB-MSCs)。与其他干细胞相比,该干细胞不但具有高度增殖、自我更新及多向分化潜能,还具有来源广、含量丰富、取材方便、安全无创等优势,而且不存在伦理、免疫排斥[6]问题,因此能够进一步完善相关MB-MSCs体外分离方法,具有重大意义。目前用于间充质干细胞分离的方法主要有4种:细胞贴壁法、密度梯度离心法、流式细胞仪分离法和免疫磁珠法。由于流式细胞仪法、免疫磁珠法操作繁琐,成本高,且对细胞活性影响大,较少采用这两种方法。而分离培养MB-MSCs方法据有关文献报道只有密度梯度离心法,本研究旨在应用贴壁法和密度梯度离心法分离培养MB-MSCs,并对两种方法的分离效果进行比较,以此建立一套稳定有效、重复性好的MB-MSCs体外分离、培养、扩增和成软骨诱导分化的方法,为经血组织工程的种子细胞的获取奠定实验基础。
1 材料与方法
1.1 主要试剂及仪器 月经杯购自中国广州美帆乐橡胶制品有限公司;1.073 g/L Ficoll液、地塞米松、β-甘油磷酸钠、维生素C、TGFβ-3购自美国SIGMA公司;DMEM/12培养基、胰酶、胎牛血清、青霉素-链霉素混合液购自美国GIBCO公司;抗人CD45 PITC、CD31 PE、CD44 APC-CY7、CD29 APC、CD105 PERCP-CY55、CD73 PE抗体购自美国BD公司;FACS Calibur流式细胞仪购自美国BD公司。
1.2 MB-MSCs分离及培养 选择25~35岁月经周期正常的健康女性的月经血,共3名,均已排除乙肝、丙肝、梅毒、艾滋病等疾病。捐赠者在参与实验之前被赋予一个月经杯,彻底消毒后,置入阴道内,在月经初期量最多的时候,收集月经血约10 mL,将收集到的月经血转移至含体积分数为1%的青霉素和链霉素的PBS缓冲液中(经血-PBS),4℃条件下保存,在24 h内转运至实验室。采用以下两种方法分离培养MB-MSCs。
1.2 .1 贴壁法分离MB-MSCs 将经血-PBS混合液转移至dish培养皿,吸取经血-PBS混合液至离心管,弃掉子宫内膜组织,加入含10%FBS的DMEM/ F12培养基至体积为16 mL,混匀,取半量经血-DMEM/F12混合液接种于4个六孔培养板内每孔约2 mL,置于37℃、5%CO2及饱和湿度培养。次日换液,以后每2~3 d更换培养基,逐步弃去未贴壁细胞。细胞长至80%融合,传代。
1.2.2 密度梯度离心法分离培养MB-MSCs 取另一半月经血-DMEM/12混合液,转移至4个离心管内每管约2 mL,混合液与PBS等体积混匀,将稀释后的月经血缓慢叠加于相同体积的Ficoll分离液上,2 000 r/min离心30 min后,小心吸取中间白膜层的单个核细胞,加入2倍体积PBS缓冲液,1 200 r/min,10 min洗涤2次,弃上清液,用含10%FBS的DMEM/F12培养基2 mL重悬细胞,接种于5个六孔培养板内,置于37℃、5%CO2及饱和湿度培养。次日换液,以后每2~3d换液,细胞长至80%融合,传代。
1.3 检测指标
1.3.1 细胞形态学观察 观察两种方法分离的原代细胞的形状、轮廓,贴壁情况和集落生长状况。
1.3.2 细胞传代时间 取两种方法分离的原代及第2、3代细胞进行培养,观察其传代时间并进行比较。每孔加入0.25%胰酶1 mL消化,待细胞皱缩、体积逐渐变小,终止消化并吹打细胞,1 200r/min离心5 min后,弃上清。用含10%胎牛血清的DMEM/F12培养基重悬细胞,调整细胞密度以5×105个/mL接种于25 cm2培养瓶,标记为P1,按1∶2比例进行传代。每2~3 d换液。重复上述步骤进行P2、P3代的传代培养。
1.3.3 表面标志物检测 取两种方法分离的生长良好的第3代MB-MSCs,至80%~90%融合后,予0.25%胰酶消化,1 200 r/min离心10 min,弃上清,PBS漂洗2遍;再用PBS重悬细胞,调整细胞密度至1×106个/mL,予待测的样本中各加CD45 PITC、CD31PE、CD44APC-CY7、CD29APC、CD105 PERCP-CY55、CD73 PE抗体1μL,同时用PBS作为空白对照。混匀,室温避光孵育30 min;PBS洗涤1次,1 500 r/min离心5 min后,加入PBS重悬细胞,流式细胞仪检测细胞表面标志物。
1.3.4 MB-MSCs成软骨诱导分化 取两种方法分离生长良好的第3代细胞接种至6孔培养板,置于37℃、5%CO2及饱和湿度培养过夜,贴壁后加入含10%FBS的成软骨诱导培养基(含1×10-8mol/L地塞米松、10 mmol/Lβ-甘油磷酸钠、100 mmol/L维生素C、10 ng/mLtgf β-3)培养。每孔3 mL,每3 d更换培养液,21 d后行阿尔辛兰染色:先弃掉培养基,PBS洗1遍,4%多聚甲醛室温固定30 min。PBS洗2遍,每孔加2 mL阿尔辛兰染色液,室温避光染色过夜,PBS洗1遍,在显微镜下观察并照像。阳性细胞浆染为蓝色,观察细胞浆是否染色及染色程度。
1.4 统计学方法 采用SPSS13.0统计软件包进行分析。数据以±s表示,组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 细胞形态学观察 全月经血在接种24 h后可见部分贴壁的圆形细胞、梭形细胞以及大量悬浮细胞,首次换液后,可见贴壁的MB-MSCs细胞形态呈纺锤形、梭形、多角形、成纤维细胞样,细胞体积较小,部分细胞重叠交织集落样生长(图1a);增殖速度快,细胞形态大体一致,培养4 d后,成簇生长的细胞形成明显的克隆,细胞从克隆中央呈放射样向四周排列生长,集落之间相互靠近(图1b);原代培养约14 d可达到80%~90%融合,但杂细胞很多(图1c)。密度梯度离心法培养的原代细胞,第一天即贴壁,呈单个、散在分布于培养皿底,细胞呈长梭形,贴壁培养后无明显悬浮细胞(图1d);6 d后单个细胞形成集落(图1e),原代培养约19 d可达到80%~90%融合(图1f),生长情况同贴壁法。
2.2 细胞传代时间 贴壁法分离原代细胞的传代时间明显快于密度梯度离心法,差异有显著意义(P<0.05),两种分离方法第2、3代细胞的传代时间差异无统计学意义(P>0.05)。见表1。
2.3 表面标志物检测 经流式细胞仪检测,贴壁法分离培养MB-MSCs高表达CD44、CD29、CD105、CD73,低表达CD31、CD45,见图2。两种方法分离的MB-MSCs阳性表面标志物CD44、CD29、CD105、 CD73和阴性表面标志物CD31、CD45含量比较差异无统计学意义(P>0.05),见表2。

图1 贴壁法和密度梯度离心法分离培养的原代MB-MSCs的形态Fig 1 Observation of primary cells obtained by two isolation methods
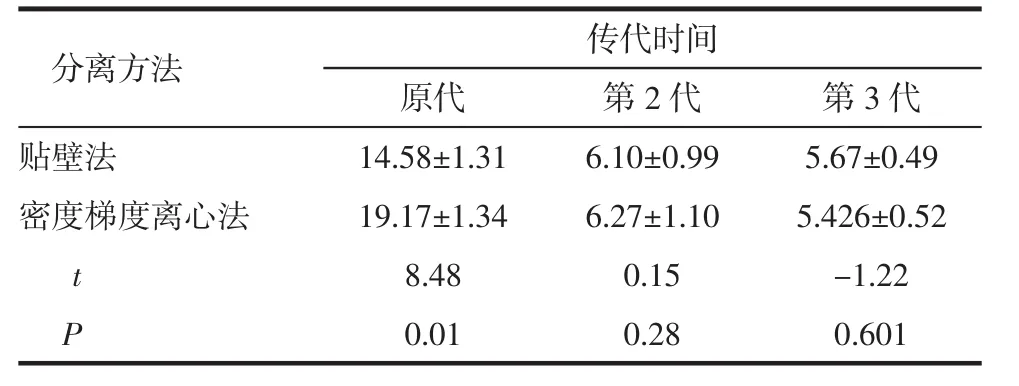
表1 两种分离方法细胞传代时间比较Tab 1 Comparison of generation time of MB-MSCs between two isolation methods
2.4 MB-MSCs成软骨诱导分化 成软骨诱导培养后1周,细胞形态由梭形变为多角形,且细胞体积变大,诱导培养21 d后阿尔辛兰染色,胞浆呈现弥漫蓝色,见图3。两种分离方法MB-MSCs染色阳性比例和染色程度基本一致。
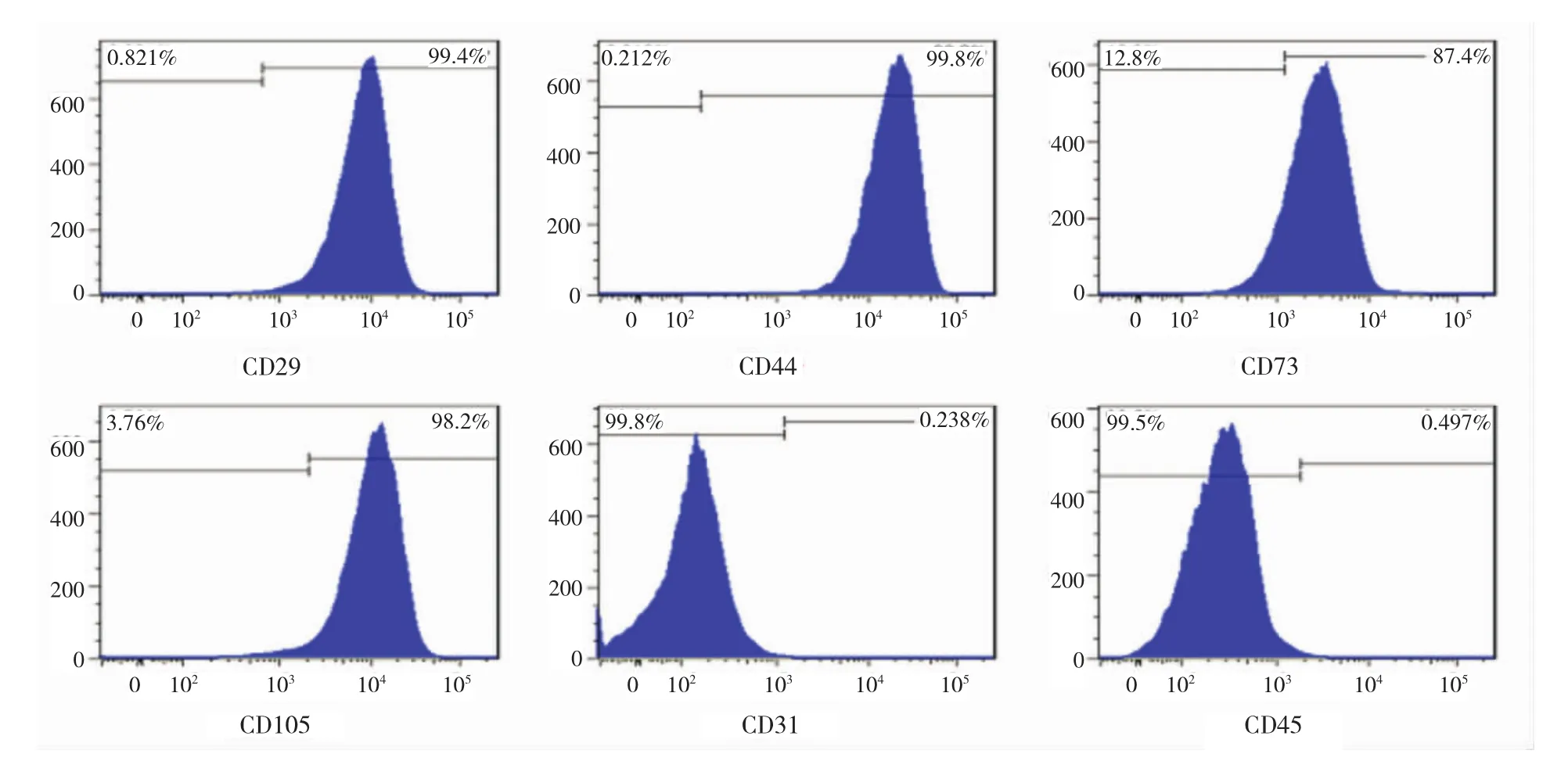
图2 贴壁法分离培养MB-MSCs的流式鉴定结果Fig 2 Results of flow cytometry of the surface markers of MB-MSCs obtained by adherence culture method
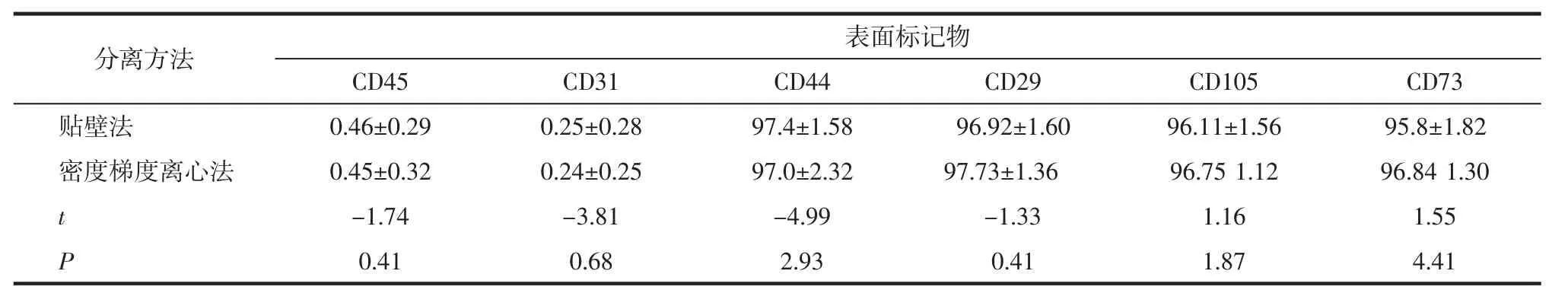
表2 两种分离方法培养的MB-MSCs表面标志物含量比较Tab 2 Comparison of cell surfacial markers of MB-MSCs between two isolation methods

图3 两种分离方法培养的第3代MB-MSCs成软骨染色观察Fig 3 Observation of Aldrich staining by two methods
3 讨论
干细胞是指在一定条件下具有无限制自我更新和增殖分化能力的一类细胞。按其存在的不同时期可分为胚胎干细胞和成体干细胞。成体干细胞是存在于各种已分化组织中的未分化细胞。目前已经发现多种成体干细胞的存在,如骨髓干细胞、胚胎干细胞、脐血干细胞、外周血干细胞[1-4]。1978年Prianishnikov因子宫内膜具有周期性增殖、分化和脱落的特点而提出存在子宫内膜干细胞的可能,又指出干细胞可能存在于子宫内膜基底层,从而使功能层内膜增生修复,始而往复[7]。在2008年,Meng等[5]从健康女性的月经血中分离出干细胞,又因其来源于经血,故称为经血源性间充质干细胞。研究者也相继证实了MB-MSCs的存在并发现其在特定条件下可分化为多谱系细胞,如成骨细胞、软骨细胞、成脂细胞、神经细胞、心肌细胞等[8-12]。因此可被应用于骨组织工程、软骨修复及神经组织工程,是组织工程研究、细胞替代治疗的良好种子细胞。现一些学者已证明MB-MSCs对中风有明显修复作用[13]。与胚胎干细胞、骨髓间充质干细胞相比,目前,经血源性的间充质干细胞研究还处于初级阶段,但MBMSCs是一种新型的干细胞来源,无论是从来源、体外培养、伦理道德方面都有一定的优势。
研究发现,贴壁法分离的细胞经两次换液后,可在培养皿底部看见梭形的细胞。部分细胞重叠交织集落样生长,经多次换液后,聚集生长的长梭形细胞在瓶底形成4~6个克隆,细胞从克隆中央呈放射状生长,集落之间相互靠近,此后增生成为形态相对均一的梭形细胞,培养14 d左右细胞融合可达80%以上。采用密度梯度离心法分离的贴壁细胞,散在于培养皿生长,以长梭形为主,细胞与细胞之间的间距较远,培养后3~5 d细胞增殖缓慢,之后生长迅速,间距较近的细胞也可形成明显的细胞集落。培养19 d左右,可迅速铺满瓶底。细胞传代时间检测表明:贴壁法分离原代细胞的传代时间明显快于密度梯度离心法,差异有统计学意义,而在2代以后两者差异无统计学意义,表明贴壁法主要对原代细胞培养产生影响,适用于早期快速获得纯度较高的细胞培养方式,该法操作简便,可以获取纯度较高的MB-MSCs,较其他方法节省费用,并可最大程度地减少污染的机会。而密度梯度离心法虽然能够获得纯度较高的单个核细胞,但由于多次离心,可造成细胞的大量流失,且影响细胞贴壁率及生长速度。从细胞的形态来看,贴壁法和密度梯度离心法分离出来的细胞是同一类细胞,细胞形态均表现均一的成纤维细胞形态。
由于MB-MSCs是一个异质细胞群,缺乏特异的表面标志物,我们采用多个表面分子对分离的细胞进行联合鉴定。其中CD44、CD29、CD105、CD73为MB-MSCs的阳性表面标志物,CD31、CD45为MB-MSCs的阴性表面标志物。结果表明,所有细胞均符合阳性MB-MSCs的一般表型,提示两种方法分离的细胞均为MB-MSCs。我们对实验结果分析发现,两种方法分离的MB-MSCs阳性表面标志物CD44、CD29、CD105、CD73和阴性表面标志物CD31、CD45含量比较,差异无统计学意义。研究结果提示贴壁方法和密度梯度离心方法分离经血MB-MSCs纯度相似。
多向分化潜能是判断MSC的条件之一,目前对MB-MSCs的鉴定尚无特异性的表面标志,国际细胞治疗学会间充质及组织干细胞委员会提出的鉴定MSCs的3条最低标准,除生长特性和细胞表型外,最终判定主要通过其多向分化能力(成脂肪、成骨和成软骨分化)来鉴定[11]。因此,我们利用MBMSCs可分化为成软骨细胞这一特点[9],采用阿尔辛兰染色对成软骨诱导的MB-MSCs进行了比较,检测其细胞功能,结果表明这两种方法分离的细胞在阿尔辛兰染色阳性细胞基本一致。
以上结果均表明,采用贴壁法与密度梯度离心法分离MB-MSCs效果相似,但贴壁法更适用于早期快速获得纯度较高的细胞。
[1] Fridenshtein A J,Petrakova K V,Kuralesova A I,et al.Heterotopic transplants of bone marrow,analysis of precurs or cells,for osteogenic and hematotoxictissues[J].Transplantation,1968,6(2):230
[2] Evans M J,Kaufman M H.Establishment in culture of pluripotential cells from mouse embryo[J].Nature,1981,292(5819):154
[3] Erices A,Conget P,Minguell J J.Mesenchymal progrnitor cells in humanblilical cord blood[J].Br J haematol,2000,109(1):235
[4] Zvaifler N J,Marinova M L,Adams G,et al.Mesenchymal precursorcecells in the blood of normal lindividuals[J].Arthritis Res,2000, 2(6):477
[5] Meng X,Ichim T E,Zhong J,et al.Endometrial regenerative cells:a novel stem cell population[J].J Transl Med,2007,5:57
[6] Zhong Z,Patel A N,Ichim T E,et al.Feasibility investigation of allogenetic endometrial regenerative cells[J].J Transl Med,2009,7:15
[7] Prianishnikov V A.On the concept of stem cell and a model of functional-morphological structure of the endometrium[J].Contraception,1978,18(3):213
[8] Patel A N,Park E,Kuzman M,et al.Multipotent menstrual blood stromal stem cells:isolation,characterization,and differentiation[J]. Cell Transplant,2008,17(3):303
[9] Musina R A,Belyavski A V,Tarusova O V,et al.Endometrial mesenchymal stem cells iso-lated from the menstrual blood[J].Bull Exp Biol Med,2008,145(4):539
[10]Kazemnejad S,Najafi R,Zarnani A H.Comparative effect of human platelet derivativeson proliferation and osteogenic differentiation of menstrual[J].Mol Biotechnol,2014,56(3):223
[11]Dominici M,Le Blanc K,Mueller I,et al.Minimal criteria for definin gmultipoten tmesenchyma lstroma lcells.The International Society for Cellular Therapy postion statement[J].Cytotherapy,2006,8 (4):315
[12]Toyoda M,Cui Ch,Umezawa A.Myogenic transdiffer-entiation of menstrual blood-derived cells[J].Acta Myol,2007,12,26(3):176
[13]Borlongan C V,Kaneko Y,Maki M,et al.Menstrual blood cells display stem cell-like phenotypic markers and exert neuroprotection following transplantation in experimental stroke[J].Stem Cells Dev, 2010,19(4):439
(2015-04-03收稿)
Comparison of adherence culture method and density gradient centrifugation method in isolating endometrial mensenchymal stem cells isolated from menstrual blood
YUAN Qing1,DU Xue1,YUAN Bi-bo1,QU Ye2,ZHOU Yuan2,SHI Hui3
(1.Department of Obstetrics and Gynecology,General Hospital,Tianjin Medical University,Tianjin 300052,China;2.Department of Pathogenic Biology and Immunology Logistics,College of Chinese People’s Armed Police Forces,Tianjin 300309,China;3.State Key Laboratory of Experimental Hematology,Institute of Hematology&Blood Diseases Hospital,Chinese Academy of Medical Science&Peking Union Medical College,Tianjin 300020,China)
Objective:To compare the effects of adherence culture method and density gradient centrifugation method in isolating endometrical mensenchymal stem cells isolated from menstrual blood(MB-MSCs).Methods:MB-MSCs were obtained from healthy female volunteers aged from 25 to 35 years and isolated by adherence culture method and density gradient centrifugation method.Observation of primary cell morphology characteristics,the generation time of the primary,2nd and 3rd passage MB-MSCs were compared between two methods and the surface markers were detected by flow cytometer.In addition,chondrogenic differentiation of MSCs was examined by Aldrich staining.Results:Primary cells isolated by adherence culture method showed aggregation growth,while cells isolated by density gradient centrifugation method showed diffusion growth.The generation time of primary cells isolated by adherence culture method(14.58± 1.31)was significantly shorter than that of cells isolated by density gradient centrifugation method(19.17±1.34)days(P<0.05),while the generation time of the 2nd and 3rd passage cells showed no statistically significant differences between these methods(P>0.05).The content of positive surface markers CD44,CD29,CD105,CD73,CD44 and negative surface marker CD31,CD45 showed no significant difference between these two isolation methods(P>0.05);no significant difference at passage 3 was found by Aldrich staining in chondrogenic cells.Conclusion:MB-MSCs could be isolated by adherence culture method,and the cell isolation effects of adherence culture method are equal to that of density gradient centrifugation method.Adherence culture applies to early and rapid high purity cell culture methods.The method is simple,economical,and efficient than other methods and can reduce the chance of contamination to the lowest level.
mesenchymal stem cell;endometrial;menstrual blood;adherence culture;density gradient centrifugation method
Q813
A
1006-8147(2015)06-0525-05
国家自然科学基金资助项目(81303108)
袁晴(1989-),女,硕士在读,研究方向:妇科肿瘤;通信作者:袁碧波,E-mail:yuanbibotj@163.com。
