粗毛淫羊藿幼叶愈伤组织诱导及其总黄酮含量
2015-02-28张锦阁闫玉莹陈庆富
张锦阁, 闫玉莹, 黄 莎, 陈庆富
(贵州师范大学 生命科学学院, 植物遗传育种研究所, 荞麦产业技术研究中心, 贵州 贵阳 550001)
粗毛淫羊藿幼叶愈伤组织诱导及其总黄酮含量
张锦阁, 闫玉莹, 黄 莎, 陈庆富*
(贵州师范大学 生命科学学院, 植物遗传育种研究所, 荞麦产业技术研究中心, 贵州 贵阳 550001)
为了对粗毛淫羊藿野生资源的保护及淫羊藿黄酮离体生产体系提供技术参考,以粗毛淫羊藿幼叶为外植体,研究粗毛淫羊藿愈伤组织诱导的灭菌剂、消毒条件、培养基、激素配比和光照条件,并测定愈伤组织中总黄酮的含量。结果表明:利用粗毛淫羊藿幼叶进行愈伤组织培养,用2%的NaClO消毒14 min,接种于培养基MS+2,4-D 2.0 mg/L+6-BA 0.5 mg/L+IBA 0.5 mg/L+NAA 1 mg/L,在24℃光照强度为1 000 lx条件下进行诱导效果最好,继代和保存应在适宜的黑暗条件下进行;诱导出的胚性愈伤组织总黄酮含量较高,达5.38%,与野生粗毛淫羊藿总黄酮含量想当,高于药典规定的标准。
粗毛淫羊藿; 幼叶; 愈伤组织; 消毒; 总黄酮
粗毛淫羊藿(EpimediumacuminatumFranch)系小檗科(Berberidacea)淫羊藿属(EpimediumL.)多年生宿根性草本植物。其全草入药,辛、甘、温,补肾阳,强筋骨,能治疗风湿痛和更年期高血压等症[1]。地上、地下部分主要含有黄酮类化合物,夏、秋两季采收。《贵州省中药材标准》(1998版)收载其入药。粗毛淫羊藿在贵州分布地域广,蕴藏量大,质量较好,是中药淫羊藿的主要原料植物[2]。随着现代中药产业的发展,以淫羊藿为主要原料的中成药、民族药产品不断问世,市场对淫羊藿需求量也愈来愈大,其野生资源供不应求[3]。近年来,研究人员利用现代生物技术,通过细胞培养、组织培养生产植物的有效成分已在当归、金荞麦等多种植物上取得一定的成果[4-5],但其在粗毛淫羊藿上的应用少见报道。因此,对粗毛淫羊藿愈伤组织诱导条件进行优化,同时对其有效成分黄酮类化合物进行定量分析,以探讨建立粗毛淫羊藿悬浮培养的技术体系,为粗毛淫羊藿野生资源的保护及建立淫羊藿黄酮离体生产体系提供技术参考。
1 材料与方法
1.1 材料
粗毛淫羊藿采于四川省峨眉山大峨村,经贵州师范大学陈庆富教授鉴定,2006年移栽至贵州师范大学植物遗传育种研究所药圃。淫羊藿苷为大连美仑生物技术有限公司生产。紫外可见分光光度计为北京普析通用仪器有限责任公司生产。
1.2 外植体灭菌
于晴天中午采集粗毛淫羊藿幼叶作为外植体,浸入稀释的洗洁精(或洗衣粉)液中浸泡5 min,再用软刷或油画笔轻轻洗刷外植体表面附着的尘土和菌体,流水冲洗2~3 h,在超净工作台上用75%的酒精消毒35 s,期间轻轻摇动,用无菌水清洗3~4次。选用升汞或次氯酸钠对外植体进行灭菌:灭菌时,在消毒液中加入少量表面活性剂吐温-80,使消毒剂更能渗入外植体的组织表面,从而达到较好的灭菌效果;用0.1%HgCl2灭菌,灭菌时间分别设为6 min、7 min、8 min和9 min;用2%NaClO灭菌,灭菌时间分别设为10 min、12 min、14 min和16 min。灭菌后用无菌水清洗5~6次,每次摇洗时间1 min。把消毒后的幼叶置于铺有无菌滤纸的盘中,吸干幼叶表面水分,将切除边缘的叶片切成0.5 cm×0.5 cm的小片,接种在附加激素的MS培养基上(蔗糖30 g/L,琼脂7.0 g/L,pH 5.8~6.0),于24℃黑暗条件下培养,15 d后统计污染率、死亡率和存活率,比较消毒效果。
污染率=(污染外植体数/接种外植体数)×100%
死亡率=(未污染死亡外植体数/接种外植体数)×100%
存活率=(消毒后存活的外植体数/接种外植体数)×100%
1.3 愈伤组织的诱导
1.3.1 基本培养基诱导 将经最佳方案消毒处理的幼叶分别接种到MS、B5和LS基本培养基,并附加激素2,4-D 2.0 mg/L和6-BA 0.5 mg/L,置于黑暗和1 000 lx光照8 h或3 000 lx光照16 h,温度24℃条件下培养,30 d后观察统计愈伤组织的诱导情况,并计算诱导率。分别采用MS和B5培养基进行继代培养,并附加不同浓度的激素,在24℃,黑暗条件下进行增殖培养,愈伤组织1个月继代1次,计算愈伤组织的增殖系数。
诱导率=(形成愈伤组织的外植体个数/接种的外植体总数)×100%
增殖系数=继代后成活愈伤质量/用于继代愈伤质量
1.3.2 不同激素配比的诱导 以幼叶为外植体,分别以MS和B5为基础培养基,附加激素2,4-D(1.0 mg/L,2.0 mg/L,4.0 mg/L),6-BA(0.5 mg/L,1.0 mg/L,2.0 mg/L),IBA(0 mg/L,0.5 mg/L,1.0 mg/L),NAA(0 mg/L,0.5 mg/L,1.0 mg/L),采用L9(34)正交试验设计,共9个处理(表1),考察不同激素配比对粗毛淫羊藿幼叶愈伤组织诱导的影响。
1.4 愈伤组织中总黄酮的测定
参照《中国药典》2010年版用紫外分光光度法测定[6]。取愈伤组织于60℃烘箱中烘至恒重,研细,过40目筛,精确称取0.2 g置于三角瓶中,精密加入75%乙醇20 mL,称定质量,超声处理1 h,再称定质量,用乙醇补足减失的质量,摇匀,滤过,取滤液0.5 mL,置50 mL量瓶中,加甲醇至刻度,摇匀得样品液。以甲醇为空白,参照紫外-可见分光光度法,在270 nm波长处测定吸光度。淫羊藿苷对照品以同样方法测得吸光度,以淫羊藿苷对照品溶液浓度为横坐标,吸光度为纵坐标,得线性回归方程y=39.688x+0.101 5,r=0.999 6。
表1 粗毛淫羊藿幼叶不同激素配比诱导的L9(34) 正交试验因子及水平
Table 1 Factors and levels of L9(34) orthogonal test of different hormone-induced ratio onE.acuminatumyoung leaves mg/L

水平Level因子 FactorA(2,4-D)B(6-BA)C(IBA)D(NAA)110.5002210.50.534211
总黄酮测定:分别取样品溶液和对照品溶液,以甲醇为空白,参照紫外分光光度法[6],在270 nm波长测定吸光度,代入回归方程,计算含量。
1.5 统计分析
试验所得数据用Excel进行简单处理作图,用Spss17.0软件对正交试验结果进行方差分析,同时用LSD法对每因素各处理水平之间进行多重比较;采用极差分析法分析正交试验的结果。
2 结果与分析
2.1 不同消毒处理幼叶的灭菌效果
从表2看出,用HgCl2消毒处理7 min时,组织成活率最高为40%;而用NaClO消毒处理14 min时,组织成活率最高为63.3%,显著高于其他处理(P<0.05)。总体上,2种消毒处理的成活率均随消毒时间的增加先升高后降低,HgCl2的污染率比NaClO处理的低,但死亡率却高出很多。各种消毒处理均不能达到污染率为0,升汞虽是一种极有效的杀菌剂,但对于植物本身伤害较大,易残留。综合考虑组织块损伤、死亡率和成活率,最佳消毒处理应为2%的NaClO消毒14 min。
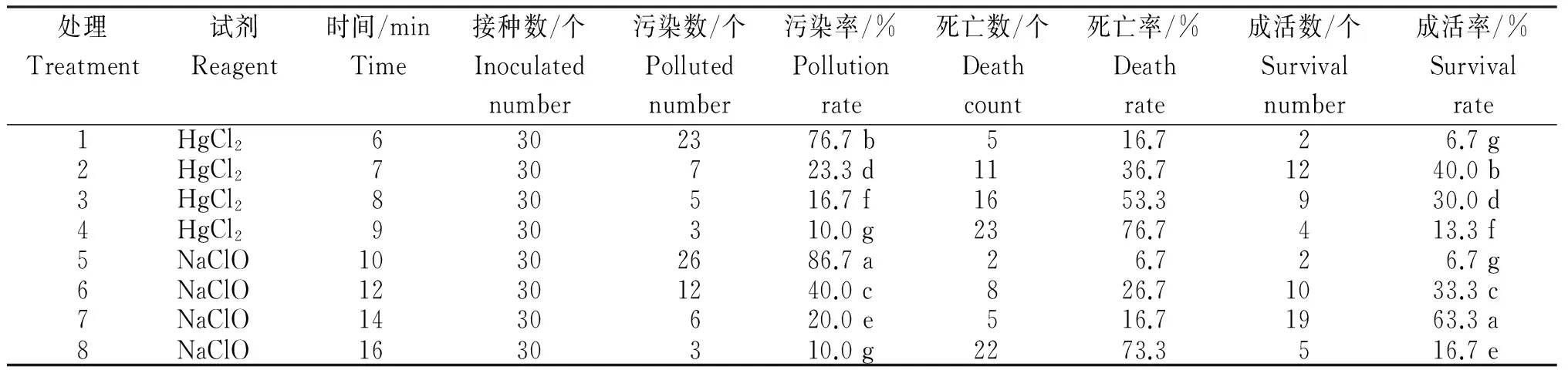
表2 不同消毒处理粗毛淫羊藿幼叶的灭菌效果
注:表中同列的小写字母表示差异显著(P<0.05)(下同)。
Note: Lowercase letters.
2.2 不同培养基和激素配比对愈伤组织的诱导效果
2.2.1 基本培养基 从表3看出,接种27 d后,外植体在MS、B5培养基中均能诱导出结构疏松、淡黄色胚性愈伤组织,且MS诱导率为68%,B5的诱导率为66%,差异不显著(P>0.05);LS培养基上的外植体诱导率最差,仅为16%,显著低于MS和B5的诱导率(P<0.05)。MS和B5培养基均适于淫羊藿幼叶形成愈伤组织,可进行最佳激素配比的进一步筛选。
2.2.2 激素配比 从表4看出,与B5基本培养基相比,MS基本培养基更适合诱导粗毛淫羊藿幼叶的愈伤组织,最佳的是组合4,愈伤组织诱导率高,达85%,愈伤组织结构致密,呈淡黄色或浅绿色,其因素位级组合为A2B1C2D3。为了进一步反映各因子之间的差异,以便获得最佳激素水平,经方差和极差分析(表5),4种因子对幼叶愈伤组织作用显著(P<0.01),依次是2,4-D>6-BA>IBA>NAA,而对于各因素,K值愈大影响程度愈大。因此,以MS为基础培养基的最佳激素组合为2,4-D 2.0 mg/L+6-BA 0.5 mg/L+IBA 0.5 mg/L+NAA 1 mg/L。

表3 基本培养基对粗毛淫羊藿叶愈伤组织的诱导效果
表4 MS和B5培养基附加不同激素配比粗毛淫羊藿幼叶愈伤组织的诱导率
Table 4 Callus induction of young leaves ofE.acuminatumleaves with different ratio of hormones on medium MS

组合Combination因素FactorABCD愈伤组织诱导率/%CallusinductionMSB5110.50033.012.22110.50.519.816.03121124.530.0420.50.5185.061.05211061.042.062200.535.033.0740.510.556.845.08410142.052.09420.5057.38.8
表5 附加不同激素配比各因素诱导率的极差分析结果
Table 5 Callus induction of young leaves ofE.acuminatumleaves with different ratio of hormones on medium MS

项目Item因素 FactorABCDK125.76758.26736.66750.433K260.33340.93354.03337.200K352.03338.93347.43350.500R34.56619.33417.36613.300K'119.40039.40032.40021.000K'245.33336.66728.60031.333K'335.26723.93339.00047.667R25.93315.46710.40026.667
注:表中,K和R为MS培养基附加不同激素配的极差分析结果,K′和R′为B5培养基附加不同激素配的极差分析结果。
Note:KandR, range analysis results of MS;K′ andR′, range analysis results of B5.
2.2.3 光照条件 从表6看出,在不同光照条件下,粗毛淫羊藿幼叶均能诱导愈伤组织,但愈伤组织的数量、颜色、质地和出现时间均存在一定的差异。1 000 lx光照和全黑暗条件下的诱导率显著高于3 000 lx(P<0.05)光照的,随着光照时间和光照强度的增加,愈伤组织生长受到抑制,褐化数和死亡率均增加。因此,粗毛淫羊藿的愈伤组织诱导适合在光照强度较弱、光照时间短或全黑暗的条件下进行,但之后进行的继代培养发现,光照条件下的胚性愈伤组织容易褐化死亡。因此,以黑暗条件对胚性愈伤组织进行继代和保存较好。
2.2.4 继代培养基 表7表明,以B5培养基继代的愈伤组织褐化较严重,且结构变致密,胚性细胞较少。以MS+2,4-D 2.0 mg/L+6-BA 0.5 mg/L+IBA 0.5 mg/L+NAA 1 mg/L组合的继代培养,增殖系数为2.1,显著高于其他培养基(P<0.05),且培养出的愈伤组织较疏松,颗粒状,胚性细胞多,有利于继代培养与保存,为最适增殖愈伤组织培养基。
2.3 愈伤组织中的总黄酮含量
在愈伤组织继代培养过程中,出现了不同类型的愈伤组织(图示),选取各种不同颜色、质地的愈伤组织测定黄酮含量结果表明:黄酮含量以浅黄色疏松颗粒状的愈伤组织(图示-C)含量较高,为5.38%(高于药典规定的不得少于5%),绿色致密状愈伤组织(图示-A)的含量居中,为3.27%,乳白色致密愈伤组织(图示-B)的含量最低,为2.93%。因此,为了在以后的悬浮体系中获得高产黄酮含量愈伤组织细胞,在以后的继代培养中应选择表面干燥、颗粒状、生长旺盛、质地疏松的浅黄色愈伤组织(图示-C)。
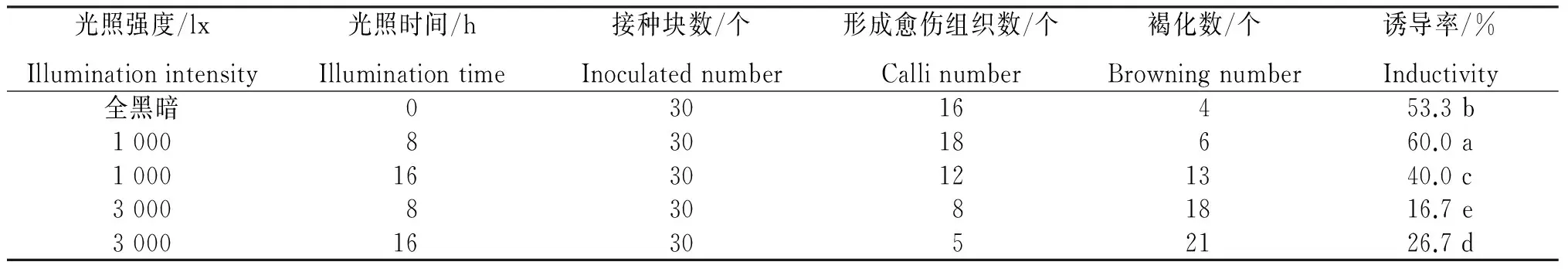
表6 不同光照条件粗毛淫羊藿幼叶愈伤组织的诱导效果

表7 粗毛淫羊藿愈伤组织继代培养的增殖效果
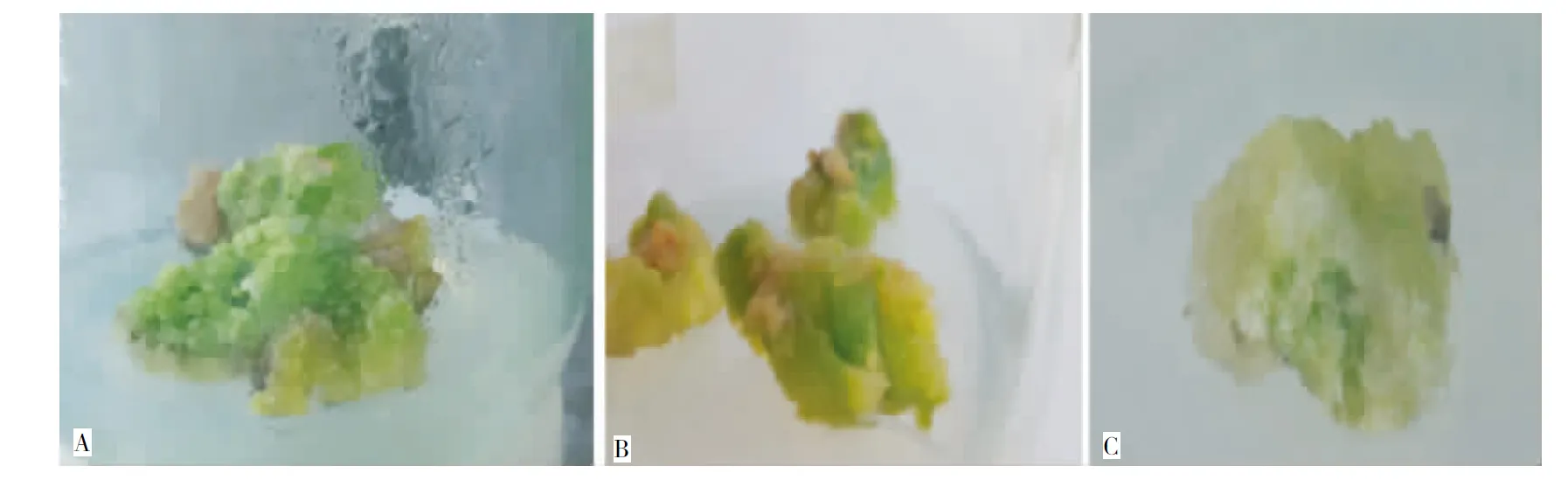
图示 粗毛淫羊藿幼叶诱导的愈伤组织
Fig. Callus induced fromE.acuminatumyoung leaves
3 结论与讨论
1) 在植物组织培养中,外植体的消毒处理是试验能否成功的首要条件,灭菌的时间长短也直接影响外植体的污染率和存活率[7-8]。罗莉等[9]对柔毛淫羊藿幼叶采用0.1%的HgCl2灭菌3 min。本研究结果表明,2%的NaClO进行14 min的消毒处理,成活率为63.3%,效果最好。
2) 作为建立再生体系的前提和基础,愈伤组织的诱导非常关键。植物生长调节剂是愈伤组织诱导和分化的重要因素之一,能否诱导出优良的愈伤组织,使用的植物生长调节剂的种类和浓度最为重要[10]。中、低浓度的生长素与低浓度的细胞分裂素相结合,能更好地诱导愈伤组织[11]。本研究结果表明,在NAA、IBA中加入低浓度的6-BA和高浓度的2,4-D,能有效地促进愈伤组织的诱导和生长,并随着2,4-D浓度的升高,愈伤组织的诱导率呈先上升后下降的趋势,在2,4-D浓度为2.0 mg/L时诱导率达最大,这与周海琴[12]等对巫山淫羊藿愈伤组织诱导、韩素菊[3]等对箭叶淫羊藿愈伤组织诱导的研究结果一致。盛茂银等[13]对粗毛淫羊藿进行愈伤组织诱导,最佳外植体是幼叶。韩素菊等[3]对箭叶淫羊藿、罗莉等[10]对柔毛淫羊藿进行的愈伤组织诱导的最佳外植体也均是幼叶,且越靠近叶片中脉的组织,越容易诱导出愈伤组织,组织越嫩越容易诱导出。王晶[14]等对朝鲜淫羊藿研究认为,茎尖的诱导率最高。本研究结果表明,采用幼叶为外植体,以MS为基本培养基,激素组合为2,4-D 2.0 mg/L+6-BA 0.5 mg/L+IBA 0.5 mg/L+NAA 1 mg/L,于24℃,弱光或黑暗条件下培养,愈伤组织诱导的效果最好,而胚性愈伤组织应在黑暗条件下继代和保存。这与之前研究者对其他品种的淫羊藿试验得出的最佳诱导培养基方案有所不同,可能与外植体的生理状态、幼嫩程度、取材时期和材料的生长环境不同所致。
3) 试验诱导的胚性愈伤组织总黄酮含量较高达5.38%,与野生粗毛淫羊藿总黄酮含量相差0.5%左右,同时也高于药典所规定的标准(5.0%)。因此,本研究可为今后建立稳定细胞悬浮体系生产高产淫羊藿总黄酮奠定基础。
[1] 陈秋华.森林旅游资源P-R评价方法的研究[J].福建林学院学报,2003,23(1):57-60.
[2] 郭泽贵.贵州森林旅游资源评价[J].贵州农业科学,2003,31(6):68-70.
[3] 韩素菊,黎云祥,胥 晓,等.箭叶淫羊藿胚性愈伤组织诱导诱导及其黄酮类化合物的总含量测定[J].中国中药杂志,2007,32(23):2551-2553.
[4] 陶金华,江 曙,杨念云,等.当归愈伤组织诱导及细胞悬浮培养的研究[J].2013,41(2):46-49.
[5] 林 静,刘 群,李艳冬,等.金荞麦愈伤组织诱导及其总黄酮含量测定方法的建立[J].西南民族大学学报:自然科学版,2010,36(2):230-233.
[6] 国家药典委员会.《中华人民共和国药典》(一部)[S].北京:化学工业出版社,2010:306-308.
[7] 王桂梅,杨林栋.马铃薯茎尖组织培养方法优化研究[J].安徽农学通报,2012,18(9):48-49.
[8] 李永文,刘新波.植物组织培养技术[M].北京:北京大学出版社,2007.
[9] 罗 莉,李 燕,杨瑞武,等.柔毛淫羊藿愈伤组织诱导及其总黄酮含量测定[C].第九届全国药用植物及植物药学术研讨会,2010.
[10] 王玉英,高新一.植物组织培养技术手册[M].北京:金盾出版社,2006.
[11] 吴春霞.植物细胞悬浮培养的影响因素[J].安徽农业科学,2009,37(1):36-28.
[12] 周海琴,朱国胜,郭巧生,等.巫山淫羊藿离体胚培养的研究[J].中国中药杂志,2012,37(13):7-12.
[13] 盛茂银,杨政富,陈庆富,等.粗毛淫羊藿幼叶愈伤组织的生产[J].种子,2005,24(9):22-24.
[14] 王 晶,李 静,贾凌云,等.朝鲜淫羊藿愈伤组织诱导研究[J].北方园艺,2013(12):106-108.
(责任编辑: 聂克艳)
Callus Induction ofEpimediumacuminatumYoung Leaves and Its Flavonoid Content
ZHANG Jinge, YAN Yuying, HUANG Sha, CHEN Qingfu*
(ResearchCenterofBuckwheatIndustryTechnology,InstituteofPlantGeneticsandBreeding,SchoolofLifeScience,GuizhouNormalUniversity,Guiyang,Guizhou550001,China)
To provide technical references for protection of wildE.acuminatumresources and in vitro production system of flavonoids, the young leaves ofE.acuminatumwere used as explants for callus induction and its factors including different sterilization agent, medium, hormone combinations and illumination conditions which affect the callus induction ofE.acuminatumwere studied. Besides, the content of flavonoids in the calli was studied by means of the ultraviolet spectrophotometric analysis. The results indicate that the callus culture ofE.acuminatumleaves can be induced under the following conditions:disinfection of 2% NaClO for 14 minutes, the medium MS + 2,4-D 2.0 mg/L+ 6-BA 0.5 mg/L+ IBA 0.5 mg/L+ NAA 1 mg/L, at 24℃ 1 000 lx illumination conditions. The subculture and preservation is much appropriate under dark conditions. Total flavonoid content of induced embryonic calli is up to 5.38%, higher than that of pharmacopoeia standard.
Epimediumacuminatum; young leaf; callus; sterilize; total flavonoids
2015-01-23; 2015-05-10修回
国家现代化农业产业技术体系荞麦育种岗位科学家专项资金项目“荞麦育种”(CARS-08-A4);国家自然科学基金项目“荞麦属植物落粒相关基因研究”(31471562);国家自然科学基金委项目“荞麦属植物种子蛋白亚基基因序列及其在染色体上分布研究”(31171609)
张锦阁(1987-),男,在读硕士,研究方向:植物遗传育种。E-mail:gezi9777@163.com
*通讯作者:陈庆富(1966-),男,教授,博士,从事植物遗传育种研究。E-mail:cqf1966@163.com
1001-3601(2015)05-0242-0079-04
S567
A
