浓香型大曲中1株高液化力功能细菌的筛选与鉴定
2015-02-28陈晓旭明红梅罗惠波许德富朱莉莉薛登文
陈晓旭, 明红梅*, 罗惠波, 许德富, 朱莉莉, 姚 霞, 薛登文
(1.四川理工学院 生物工程学院, 四川 自贡 643000; 2.泸州老窖股份有限公司, 四川 泸州 646000)
浓香型大曲中1株高液化力功能细菌的筛选与鉴定
陈晓旭1, 明红梅1*, 罗惠波1, 许德富2, 朱莉莉1, 姚 霞1, 薛登文1
(1.四川理工学院 生物工程学院, 四川 自贡 643000; 2.泸州老窖股份有限公司, 四川 泸州 646000)
为探寻大曲微生物与风味物质之间的相关性,为构建大曲功能菌群及实现制曲生产异地化奠定基础,采用平板筛选、固态发酵、16S rDNA鉴定及HS-SPME-GC-MS等方法对浓香型大曲中的高液化力菌株进行筛选与鉴定。结果表明:菌株X20与枯草芽孢杆菌的16S rDNA序列同源性高达99%,可确定其为枯草芽孢杆菌;该菌株的液化力高达11.756 g/(g·h),其代谢产物含有吡嗪类物质、愈创木酚和苯甲醛等多种重要的大曲风味物质,可初步确定其为大曲的功能菌株。
浓香型大曲; 高液化力; 细菌; 功能菌株; HS-SPME-GC-MS; 16S rDNA
浓香型白酒具有窖香浓郁、绵甜爽洌、香味协调、尾净味长等特点[1]而广受大众喜爱。曲为酒之骨,有好酒必有好曲。大曲中的微生物大体可分为细菌、霉菌和酵母菌三大类[2],其在曲块上生长、繁殖、代谢产生各种酶系,使大曲具有液化、糖化和蛋白质分解等能力,该功能特性指标也是大曲培养和产品质量的关键所在[3]。
大曲中的细菌具有水解淀粉和蛋白质的能力,有的细菌能代谢产生酒中的芳香成分前体物质乙偶姻、二乙酰等[4]。杨帆等[5]对茅台大曲中芽孢杆菌的代谢产物进行比对分析发现,其代谢产物中含有大曲重要的风味物质且浓度较高。大曲淀粉水解酶中液化酶是影响白酒产量和质量的重要因素[6],细菌的液化力是指大曲中多种酶对淀粉水解的综合能力,主要是α-淀粉酶的作用。α-淀粉酶能首先将淀粉分解为糊精、少量麦芽糖等,然后其他淀粉酶进一步将其水解,促进大曲的糖化[7],进而形成大曲中众多的风味成分。
目前,浓香型大曲微生物的研究主要集中在优良菌种的筛选、鉴定和应用于强化大曲[8-10]等方面,而对于大曲微生物与风味物质之间相关性研究较少。为此,笔者采用平板透明圈初筛和固态发酵产物的产酶分析,结合检测挥发性代谢产物等方法,对中高温浓香型大曲中的细菌进行筛选,初步探寻大曲微生物与风味物质之间的联系,以期筛选出高液化力的制曲功能菌株,构建大曲的功能菌群,使大曲的生产发酵过程简单化,为制曲生产异地化再现提供条件。
1 材料与方法
1.1 供试材料
1.1.1 大曲 由泸州老窖制曲生态园提供。
1.1.2 仪器与设备 RT-34型静音研磨粉碎机,北京环亚天元机械技术有限公司;MJ-250型恒温培养箱,上海和羽电子科技有限公司;TW-200W型可控调温电炉,天津市泰斯特仪器有限公司;HH-4型数显恒温水浴锅,金坛市杰瑞尔电器有限公司;50 μm/30 μm DVAB/CAR/PDMS 固相微萃取头,美国Supelco 公司;手动SPME进样器,美国Supelco公司;Agligent 6890N-5975B气相色谱-质谱联用仪,美国安捷伦公司;毛细管色谱柱为DB-WAX,规格为(60 m×250 μm×0.25 μm)。
1.1.3 培养基 牛肉膏蛋白胨培养基:牛肉膏3.0 g/L、蛋白胨10.0 g/L、氯化钠5.0 g/L、琼脂17.5 g/L,pH 7.4~7.6,121℃灭菌30 min。α-淀粉酶筛选培养基:牛肉膏5.0 g/L,氯化钠5.0 g/L,蛋白胨10.0 g/L,可溶性淀粉20 g/L,琼脂17.5 g/L,121℃灭菌30 min。小麦固体培养基:每80 g小麦粉分装于250 mL锥形瓶,调节小麦原料含水36%左右, 121℃灭菌20 min。
1.2 浓香型大曲高液化力细菌的筛选
无菌条件下取约15 g大曲样品放入研钵中,待样品充分分散后无菌称取10 g样品放入装有90 mL无菌水的灭菌三角瓶,置于摇床(37℃,200 r/min)震荡30 min,然后逐步稀释至10―7。选取10―5、10―6和10―73个稀释度,各吸取150 μL涂布于牛肉膏蛋白胨培养基上,每个稀释度做3个平行,将涂布后的平板倒置于37℃下培养24 h,挑取培养基上不同形态的菌落进一步纯化培养,直至形成单菌落的细菌菌株再接入牛肉膏蛋白胨斜面培养基培养,然后于4℃保存备用。
1.3 浓香型大曲高液化力细菌的平板初筛
将斜面保藏的细菌菌株活化后点接到α-淀粉酶筛选培养基上,于37℃恒温培养箱中倒置培养12 h。取出后滴碘液于培养好的平板上,使碘液覆盖整个平板,待显色后观察水解透明圈的大小并用游标卡尺测量透明圈直径(H)和菌落直径(C),计算两者比值(H/C),通过比值的大小初步筛选出能产α-淀粉酶的菌株。比值越大,说明该菌株产α-淀粉酶的能力较强。
1.4 高液化力细菌的固态发酵
无菌操作条件下,用移液枪将产α-淀粉酶优良菌株的种子培养液以10%的接种量接种到装有80 g小麦固体培养基的三角瓶中并拌匀,用八层纱布封口,将接种好的小麦培养基于37℃恒温培养箱中静置培养96 h,中间间歇手工震荡,发酵结束后检测所接优良菌株(X20,X8,X2,X19,X11)的液化力指标。
1.5 细菌液化力的测定
1) 称取相当于10.0 g绝干的细菌固态发酵试样,加20 mL pH4.6的醋酸钠缓冲溶液,用水调至总体积200 mL,充分搅拌。将装有试样的烧杯置于35℃恒温水浴锅中保温浸渍1 h,过滤取滤液,制得5%试样酶液备用。
2) 吸取20 mL淀粉溶液(20 g/L)于150 mL锥形瓶中,加入5 mL pH4.6的醋酸钠缓冲溶液摇匀,于水浴中预热至试液为35℃时,加入10 mL 5%试样酶液充分摇匀并立即记时,用胶头滴管吸取反应液2~3滴滴入预先滴有1滴碘液的白瓷盘中进行呈色反应,直至试液不变色(碘液本色)为终点,记下反应时间[11]。
1.6 HS-SPME-GC-MS法测定细菌固态发酵产物的挥发性物质
将固相微萃取装置的萃取头在气相色谱的进样口老化,温度为250℃,时间为15 min。称取5 g发酵产物于15 mL装样瓶中,在60℃条件下平衡15 min。将固相微萃取器的萃取头插入装样瓶,吸附30 min后缩回纤维头,再插入GC-MS中检测发酵产物的挥发性物质。
GC-MS操作条件:最高温度230℃,程序升温;进样量1 μL,进样方式为手动不分流,进样口温度为230℃;质谱电离源EI;采集方式为全扫描;容积延迟3 min;离子源温度为230℃,四级杆温度为150℃;增益系数1。
1.7 细菌菌株分子生物学(16S rDNA)鉴定
引物:27F∶5’-GAGTTTGATCMTGGCTCAG-3’;1492R∶5’-TACGGYTACCTTGTTACG-3’,由上海英潍捷基合成。PCR反应体系(50 μL):10×buffer 5 μL,dNTPs 4 μL, Mg2+3 μL,引物2 μL,Taq酶1 μL,ddH2O 34 μL,模板1 μL。PCR反应程序:95℃预变性5 min;95℃变性1 min,58℃退火30 s,72℃延伸1 min 30 s,循环30次。4℃保存。
基因测序由上海杰李公司完成,采用DNAstar将测序结果进行序列拼接和去除多余碱基后,登陆NCBI进行BLAST分析,采用MEGA6进行发育树构建,重复取样1 000次进行bootstrap。
2 结果与分析
2.1 浓香型大曲中高液化力细菌的初筛
菌株X11、X20碘液显色结果如图1所示,菌株X11周围的透明圈较小,菌株X20周围的透明圈明显较大。从表可见,筛选出的20株细菌中菌株X20、X8、X2、X19和X11的H/C较大,说明该5株细菌的液化能力较强。其中,菌株X20的H/C最大,为1.76;X11的H/C最小,为1.34;5株细菌H/C比值的排序为X20>X2>X8>X19>X11。平板比值可初步体现菌株液化力高低,液化力大小还需通过进一步测定。
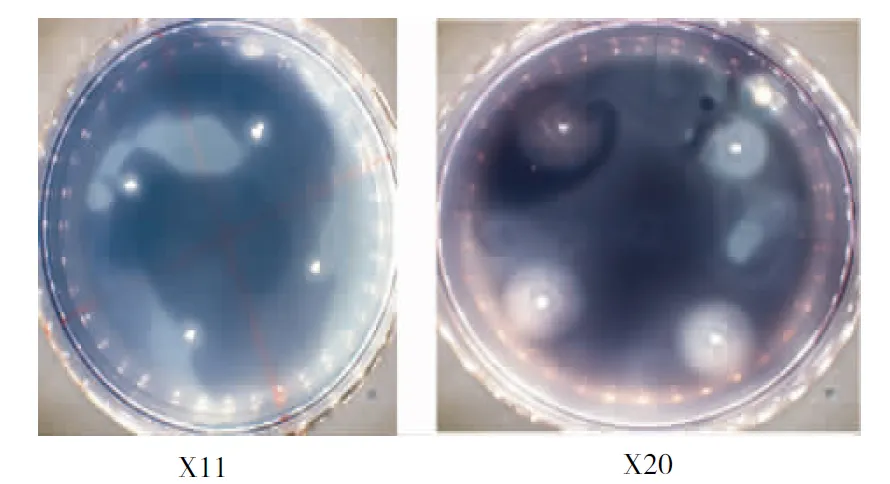
图 1 液化力细菌的碘液显色反应
Fig.1 Chromogenic reaction of bacteria liquefying power
表 液化力细菌的平板初筛
Table Results of liquefying power preliminary screening
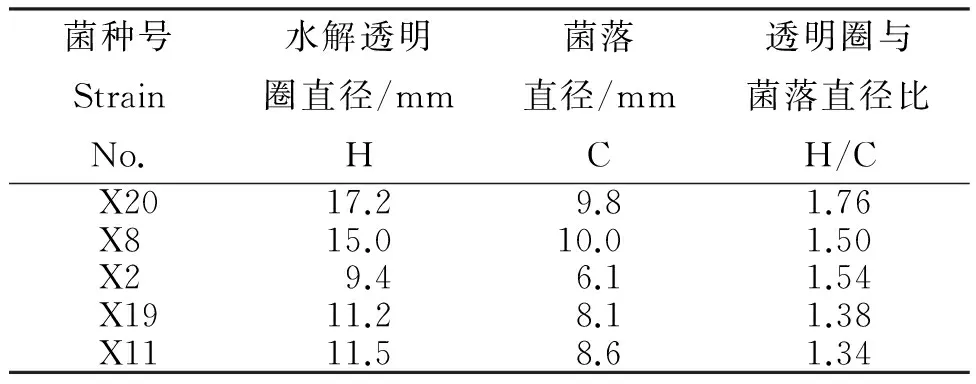
菌种号StrainNo.水解透明圈直径/mmH菌落直径/mmC透明圈与菌落直径比H/CX2017.29.81.76X815.010.01.50X29.46.11.54X1911.28.11.38X1111.58.61.34
2.2 细菌液化力的测定
选取初筛结果中H/C比值较大的X20、X8、X2、X19和X11细菌菌株进行固态发酵,并对其发酵产物的液化力进行定量测定(重复5次测定值)的结果表明,菌株的液化力依次为X20>X19>X2>X8>X11。其中,菌株X20的液化力最高,为(11.756±0.15)g/(g·h);其次是菌株X19,其液化力为(0.817±0.10)g/(g·h);菌株X2、X8和X11的液化力分别为(0.496±0.47)g/(g·h)、(0.468±0.23)g/(g·h)和(0.407±0.36)g/(g·h)。由方差分析可知,菌株X20、X8、X2、X19和X11的液化力之间差异均显著,固态发酵结果与液化力细菌的平板初筛结果基本一致,其液化力均高于传统大曲质量指标认定的质量上乘标准[≥0.5 g/(g· h)][12]。因此,选取液化力最高的菌株X20进行后续试验。
2.3 菌株X20发酵产物的GS-MS分析
从图2可见,菌株X20的发酵产物中共检测到挥发性风味物质14种,主要包括吡嗪类、酚类、醇类和醛类等。吡嗪类物质一般都具有烘焙和坚果香[13],醇类、醛类均会产生使人愉快的气味,有些醛、醇本身还具有花草和水果的香气,这些风味成分对浓香型大曲复合曲香的形成有一定的贡献[14]。发酵产物中检测到的2,3,5-三甲基吡嗪、2,5-二甲基吡嗪、2,3,5,6-四甲基吡嗪、愈创木酚和苯甲醛等均属于大曲中的重要风味物质[15-16],吡嗪类物质、愈创木酚、苯甲醛的形成与淀粉水解及蛋白质水解作用相关[17]。菌株X20的高液化力特性有助于淀粉水解和糖化,糖和氨基酸等物质经过一系列复杂的生物化学变化,产生大曲中重要的风味物质。因此,可初步确定菌株X20为大曲的功能菌株。
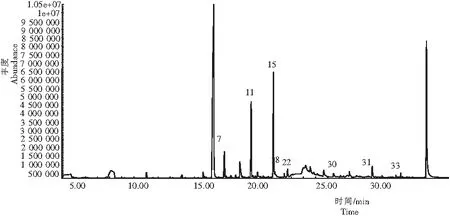
注:7为2, 5-二甲基吡嗪;11为 2,3,5-三甲基吡嗪;15为 2,3,5,6-四甲基吡嗪;18为苯甲醛;22为2,3-丁二醇;30为萘;31为愈创木酚;33为 4-乙基愈创木酚;34为对乙烯基愈创木酚。
Note: 7, 2,5-dimethylpyrazine;11, 2,3,5-trimethylpyrazine; 15, 2,3,5,6-tetramethylpyrazine; 18, benzaldehyde; 22, 2,3-butanediol; 30, naphthalene; 31, guaiacol; 33, 4-ethylguaiacol; 34, vinyl guaiacol.
图2 菌株X20挥发性化合物的总离子流
Fig.2 Total ion chromatograms for the volatile compounds in X20 strain
2.4 菌株X20的菌落形态及其16S rDNA的鉴定
2.4.1 菌株X20的菌落形态 从图3可见,菌株X20在牛肉膏蛋白胨培养基上培养12 h后形成乳白色、不规则圆形、不透明、湿润并有光泽的菌落,菌落边缘较中间厚,不产色素。同时,菌株X20经革兰氏染色显阳性,在显微镜下观察,细胞呈杆状。
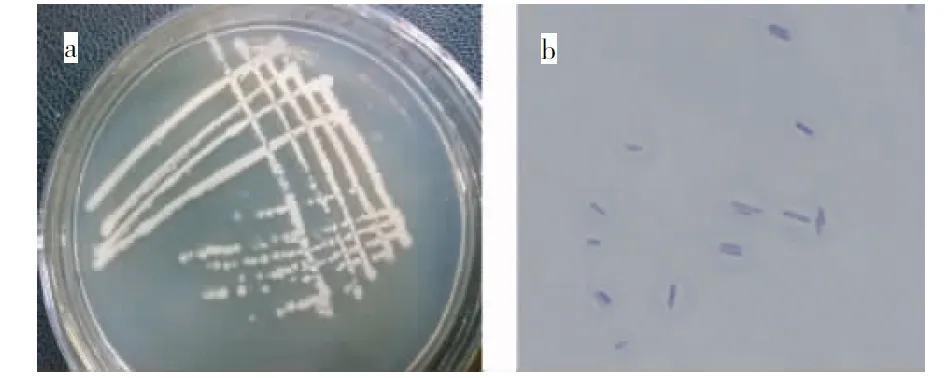
注: a,菌株X20的菌落形态;b,菌株X20的细胞革兰氏染色。
Note: a,colony morphology of X20;b,cell gram stain of X20.
图3 菌株X20的细胞形态及其菌落形态特征
Fig.3 Gram dyeing and colony morphology of X20
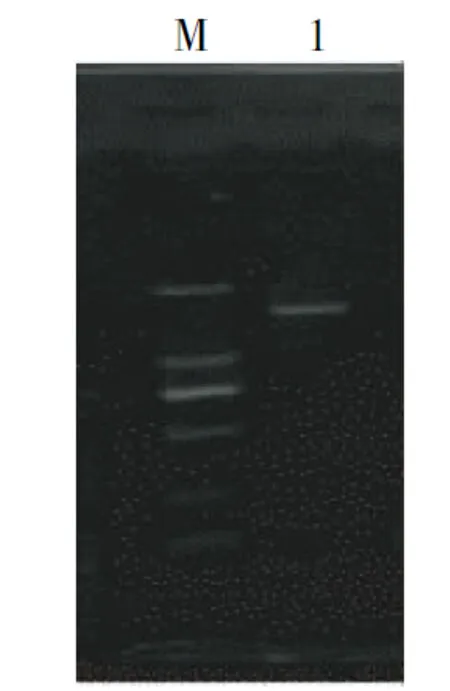
注:M为0.1~2 Kb分子质量Marker;1为16S rDNA PCR片段。
Note: M, 0.1~2 Kb molecular mass Marker; 1, 16S rDNA PCR fragment.
图4 菌株X20的16S rDNA扩增
Fig.4 PCR amplification results of X20
2.4.2 菌株X20的分子生物学鉴定 从图4可见,菌株X20的PCR扩增产物大小约为1.5 Kb,与预期值相吻合。将菌株X20的16S rDNA序列通过BLAST同源性分析发现,97%的比对序列都为芽孢杆菌属的菌株,同源性最高的序列中有11个为枯草芽孢杆菌,序列同源性达99%。由图5可知,从NCBI上选取最具代表性的18株菌株构建系统发育树,进行1 000次重复获得自展检验Bootstrap值, 菌株X20与枯草芽孢杆菌落在同一分支上,置信度为89%。因此,可初步判断菌株X20为枯草芽孢杆菌。

图5 菌株X20的系统发育树
Fig.5 Phylogenetic tree of strain X20
3 结论与讨论
从浓香型大曲中分离出一株高液化力细菌X20,其液化力达11.756 g/(g· h)。经16S rDNA鉴定结果显示,该菌株与枯草芽孢杆菌同源性最高,达99%,可初步鉴定为枯草芽孢杆菌。HS-SPME-GC-MS结果显示,菌株X20发酵产物中富含大曲中的重要风味成分,如吡嗪类物质、愈创木酚、苯甲醛等。菌株X20不仅具有高液化力并且其发酵产物中富含大曲中的重要风味成分,可初步确定为大曲的功能菌株。
由于传统优质大曲的生产受到地理、气候、水质等环境条件以及在此环境中滋生和孕育的其他微生物的影响,从而阻碍了制曲生产异地化发展。本研究从名优白酒企业的菌种资源中筛选高液化力功能菌株,进一步改良大曲发酵功能菌群,为制曲生产异地化再现奠定了基础。由于时间关系,仅对其主要功能特性及其代谢产物进行初步探究,关于菌株功能特性和大曲风味成分之间的联系还有待进一步研究。
[1] 李付丽,吴鑫颖,王晓丹,等.微生物技术在浓香型白酒增香方面的应用[J].中国酿造,2014(1):9-13.
[2] 唐 婧,苏 迪,徐小蓉,等.基于宏基因组学的茅台酒酒曲细菌的多样性分析[J].贵州农业科学,2014,42(11):180-185.
[3] 吕云怀,王 莉,汪地强,等.不同香型白酒大曲风味物质与其产品风格特征关系的分析[J].酿酒科技,2012(7):72-75.
[4] 罗建超,谢 和.大曲中产酱香芽孢杆菌的筛选及其代谢产香探析[J].酿酒科技,2012(5):35-40.
[5] 杨 帆,林 琳,王玉和,等.茅台大曲中3株芽孢杆菌代谢产物的比对分析[J].酿酒科技,2011(8):42-46.
[6] 张春林.泸州老窖大曲的质量、微生物与香气成分关系[D].无锡:江南大学,2012.
[7] 王宏彬.基于仿生味觉阵列传感器的白酒检测研究[D].重庆:重庆大学,2013.
[8] Wang C,Shi D,Gong G.Microorganisms in Daqu: a starter culture of Chinese Maotai-flavor liquor[J].World J Microb Biot.,2008,24(10):2183-2190.
[9] 施安辉,张文璞.徐坊大曲的微生物区系及其优势菌的鉴定[J].酿酒科技,2001,108(6):26-28.
[10] 李云英,李能树.大曲酒微生物区系的初步研究[J].生物学杂志,1996,13(3):19-21.
[11] 沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,2007.
[12] 敖宗华,陕小虎,沈才洪,等.国内主要大曲相关标准及研究进展[J].酿酒科技,2010(2):104-108.
[13] Plutowska B,Wardencki W. Application of gas chromatography-olfactometry (GC-O) in analysis and quality assessment of alcoholic beverages-A review[J].Food chem.,2008,107(1):449-463.
[14] Williams A A.The development of a vocabulary and profile assessment method for evaluating the flavour contribution of cider and perry aroma constituents[J].Journal of the Science of Food and Agriculture,2006,26(5):567-582.
[15] 肖 澎,袁华伟,何桂强,等.4-乙基愈创木酚转化菌的筛选、鉴定及转化性能的研究[J].食品与发酵工业,2014(6):44-49.
[16] 周 健,郭 志,明红梅,等.优质中高温浓香型大曲主要香味成分的初步研究[J].酿酒科技,2014(4):11-14.
[17] 黄永光,杨国华,张肖克,等.产酱香风味芽孢杆菌类菌株发酵代谢产物及其酶分析研究[J].酿酒科技,2013(1):41-45.
(责任编辑: 王 海)
Isolation and Identification of a Bacteria from Luzhou-flavor Daqu
CHEN Xiaoxu1, MING Hongmei1*, LUO Huibo1, XU Defu2,ZHU Lili1, YAO Xia1, XUE Dengwen2
(1.EngineeringofBioengineeringInstitute,SichuanUniversityofScience,Zigong,Sichuan643000; 2.LuzhoulaojiaoCompanyLimited,Luzhou,Sichuan646000,China)
In order to filter out high stress liquefaction bacteria and provide references for Daqu functional bacteria flora construction, the authors usedplate screening test, solid state fermentation experiment, 16S rDNA and HS-SPME-GC-MS to seek the relationship between mieroorganism in Daqu and flower compounds. Results: The bacterial strain X20 had the highest liquefaction ability, up to 11.756 g/(g· h),the 16S rDNA sequence about X20 andBacillussubtilishomology as high as 99%, which could be identified asB.subtilis, the metabolites contained pyrazines, guaiacol, benzaldehyde and some other kinds of daqu important flavor. It could be initially identified as functional strain of Daqu.
Luzhou-flavor Daqu; high liquefaction ability; bacteria; functional strain; HS-SPME-GC-MS;16S rDNA
2015-03-24; 2015-07-01修回
酿酒生物技术及应用四川省重点实验室项目“浓香型大曲优势菌的筛选及微生态制剂的研发”(NJ2011-13);泸州老窖科研奖学金项目“浓香型大曲中产香微生物的筛选及应用研究”(13ljzk04);四川省教育厅重点科研项目“浓香型大曲微生态特征及立体制曲工艺优化的研究”(15ZA0219);四川省大学生创新训练计划项目“浓香型大曲中产香菌的筛选及香曲制备研究”(201410622004)
陈晓旭(1990-),女,在读硕士,研究方向:发酵工程。E-mail: 623086967@qq.com
*通讯作者:明红梅(1971-),女,副教授,硕士生导师,从事酿酒生物技术及应用研究。E-mail:839403036@qq.com
1001-3601(2015)07-0374-0110-04
S182; Q93-3; TS261.1
A
