泸宁鸡和米易鸡MSTN基因多态性及其与生长性状的关联性
2015-02-27任冰冰蒋小松熊应龙王康环刘光伟徐亚欧
左 斌, 任冰冰, 蒋小松, 熊应龙, 王康环,蒋 利, 刘光伟 , 王 海, 徐亚欧*
(1.西南民族大学 生命科学与技术学院, 四川 成都 610041; 2.四川省畜牧科学研究院, 四川 成都 610066; 3.凉山州原生农业综合开发有限责任公司, 四川 冕宁 615600)
泸宁鸡和米易鸡MSTN基因多态性及其与生长性状的关联性
左 斌1, 任冰冰1, 蒋小松2, 熊应龙3, 王康环1,蒋 利1, 刘光伟1, 王 海1, 徐亚欧1*
(1.西南民族大学 生命科学与技术学院, 四川 成都 610041; 2.四川省畜牧科学研究院, 四川 成都 610066; 3.凉山州原生农业综合开发有限责任公司, 四川 冕宁 615600)
为探明泸宁鸡、米易鸡肌肉生长抑制素(myostatin,MSTN)基因多态性与生长性状的关联性,采用PCR-SSCP法对MSTN基因的多态性进行检测,同时对泸宁鸡、米易鸡的主要生长性状进行测定,并对MSTN基因多态性与生长性状的关联性进行分析。结果表明:MSTN基因外显子1中有2 100 bp(C/T)和2 109 bp(C/T)2个SNPs位点,未引起氨基酸变异,为同义突变,表现出CT、TT(2 100 bp)和CC、CT、TT(2 109 bp)5种基因型,与心脏重、胫围和屠宰率有相关性;泸宁鸡存在CC、CT和TT 3种单倍型,米易鸡存在CC、TC和TT 3种单倍型。内含子1中有4 295 bp(T/C)、4 359 bp(T/C)和4 404 bp(A/C)3个SNPs位点,表现出CT(4 295 bp)、CT(4 359 bp)、TT、CT和CC(4 404 bp)5种基因型,与腺胃重有显著相关;泸宁鸡存在CCC和TTT 2种单倍型,米易鸡存在CCC、TTC和TTT 3种单倍型。3’非编码区有7 637 bp(A/G)和7 725 bp(A/G)2个SNPs位点,表现出AG(7 637 bp)、AA、AG和GG(7 725 bp)4种基因型,与腺胃重、腹脂重和半净膛率具有相关性;泸宁鸡存在AG、GA和GG 3种单倍型。MSTN基因是影响泸宁鸡、米易鸡主要生长性状的主效基因之一,可以作为地方鸡品种选育的候选基因。
泸宁鸡; 米易鸡; 肌肉生长抑制素; PCR-SSCP; 生长性状; 单倍型
肌肉生长抑制素(MSTN)基因是1997年MePherron等从小鼠骨骼肌cDNA文库中克隆出的一个新基因,该基因转录合成的蛋白质是一种生长因子,被命名为生长分化因子-8(Growth and Differential Factor-8,GDF-8)[1-2]。该基因的缺失和突变会使一些动物表现出明显的双肌现象[3]。在畜牧业上,筛选出MSTN基因突变个体,可通过育种培育出产率高的优良畜禽品种。胡兰等[4]研究表明,在大骨鸡胸肌、腿肌、心肌、肾脏、脑、舌中均有MSTN基因表达,其中骨骼肌中表达水平较高。顾志良等[5]对明星肉鸡和丝羽乌骨鸡杂交产生的F2代群体进行研究发现,MSTN基因核苷酸突变(G→A,A→G,C→T)导致其5′调控区呈现出多态性,G→A和A→T的突变造成MSTN 3′调控区的多态性,MSTN基因多态性不仅影响骨骼肌和肌肉生长发育,还可能与脂肪沉积有关。隐性白羽鸡在MSTN基因5′调控区和3′调控区存在SNPs位点[6]。到目前为止,未见MSTN基因多态性在四川优良地方鸡品种泸宁鸡、米易鸡上的研究报道。为探明四川优良地方鸡品种MSTN基因多态性及其与生长性状的关联性,找出该基因与生长性状相关的遗传标记,运用PCR-SSCP技术筛选MSTN基因SNPs变异位点,分析其与生长性状的关系,以期为培育出生长速度快的优良地方鸡品种提供理论依据。
1 材料与方法
1.1 鸡品种
泸宁鸡(64只)、米易鸡(64只)取自凉山州冕宁县泸沽镇秧草坝养殖场,由专人管理,单笼饲养,管理和营养水平一致,自由采食、饮水。分别在81 d、119 d、154 d、210 d进行屠宰性能测定,同时用真空采血管收集血样EDTA.K2抗凝带回实验室,于-80℃保存备用。
1.2 生长性状测定
屠宰前测定体斜长、胸宽、胸深、胸骨长、盆骨宽、胫围和胫长等指标。屠宰性能测定参照杨宁[7]的方法进行,指标包括活重、屠体重、全净膛重、半净膛重、胸肌重、腿肌重、腹脂重、肝重、肌胃和腺胃重,半净膛率、全净膛率、腹脂率、胸肌率、腿肌率等。
1.3 引物设计及DNA池构建
根据GenBank登录的MSTN基因序列(登录号:AF346599)用Primer5.0软件设计特异性引物(表1),并由上海Invitrogen公司合成,扩增包含该基因3个外显子序列及含有SNPs位点的特异性序列。用DNA试剂盒提取血液基因组DNA,经TE溶解后,-20℃保存备用。每个品种随机抽取30个DNA样品,用紫外分光光度计测量每个DNA样品浓度各3次,取平均值,将样品稀释到终浓度为100 ng/μL,从30个样品中各取5 μL混合构建成DNA池[8-10]。

表1 试验所用引物信息
1.4 PCR扩增
以DNA池为模板扩增MSTN基因3个外显子片段。PCR反应体系(25 μL):超纯水9.5 μL,上下游引物(10 μmol/L)各1 μL,DNA模板(100 ng/μL)1 μL,Master Mix 12.5 μL。PCR反应程序:94℃预变性3 min;94℃变性30 s,复性30 s,72℃延伸30 s,30个循环;72℃延伸10 min,4℃保存。1.5%琼脂糖凝胶电泳检测PCR产物的亮度及纯度。
1.5 SSCP分析及测序
取PCR产物1.5 μL与变性缓冲液(10%蔗糖,0.01%溴酚,0.01%二甲精)20 μL混合,97℃变性3 min后立即冰浴5 min,产物经12%非变性聚丙烯酰胺凝胶[m(Arc)∶m(Bis)=29∶1]在200 V、400 mA条件下电泳3~4 h后银染显色。经PCR-SSCP[11-13]分析后,挑选每个不同基因型个体的PCR产物送上海Invitrogen公司测序。用DNAMAN软件将测序结果与GenBank登陆的序列进行比对分析,找出突变位点。
1.6 统计分析
根据电泳结果不同带型的差异,判断个体的基因型,用EXCEL软件进行数据统计和SPSS17.0软件进行差异显著性比较,进行基因型与生长性状间的关联分析。利用POPGENE软件计算各等位基因在各品种中的基因频率和基因型频率,用卡方值判断鸡群是否处于哈代-温伯格平衡,用Nei氏计算法检测MSTN基因杂合度、纯合度和多态信息含量,用SHEsis对SNPs位点进行单倍型构建并计算其频率。
2 结果与分析
2.1 PCR扩增、SSCP检测及测序
针对MSTN基因外显子1,内含子1及3’非编码区设计3对引物的扩增片段与预期大小一致,没有非特异性条带(图1),可以用于进一步分析。经SSCP分析(图2)发现,MSTN基因外显子1变异位点表现出5种带型,分别命名为TT、CT(2 100 bp)和CC、CT、TT(2 109 bp);内含子1变异位点表现出CT(4 295 bp),CT(4 359 bp),TT、CT、CC(4 404 bp) 5种基因型;3′非编码区变异位点表现出AG(7 637 bp)和AA、AG、GG(7 725 bp) 4种基因型。经测序后序列比对发现,外显子1有2个SNP位点,分别为2 100 bp(C/T)和2 109 bp(C/T);内含子1有3个SNP位点,分别为4 295 bp(T/C)、4 359 bp(T/C)和4 404 bp(A/C);3′非编码区有2个SNP位点,为7 637 bp(A/G)和7 725 bp(A/G)。

注:M为Marker D2000,1~3为外显子1突变位点,4~6为内含子1突变位点,7~9为3′非编码区突变位点。
Note: M, Marker D2000; 1~3, Mutation loci of exon 1; 4~6, Mutaion loci of intron 1; 7~9, Mutation loci of 3′ noncoding region(A7637G and A7725G).
图1MSTN基因的PCR产物电泳图谱
Fig.1 Electrophoretoesis pattern of PCR product ofMSTNgene

图2MSTN基因的SNPs分析及基因型(从左到右是外显子1,内含子1,3′非编码区)
Fig.2 SNPs analysis and genotype ofMSTNgene (From left to right are exon 1, intron 1 and 3′ noncoding region)
2.2 基因型频率和基因频率
从表2可知,MSTN基因外显子1中泸宁鸡的2个位点均是CC基因型频率、C等位基因频率最高;米易鸡2 109 bp位点CT基因型、C等位基因频率最高,2 100 bp位点T为优势等位基因。内含子1中泸宁鸡的3个位点均是TT基因型频率最高,T为优势等位基因;米易鸡4 295 bp、4 359 bp位点是CT基因型频率最高,4 404 bp位点CC基因型频率最高,4 295 bp、4 359 bp位点T为优势等位基因,4 404 bp位点C为优势等位基因。3′非编码区泸宁鸡7 637 bp位点GG基因型频率最高,G为优势等位基因,米易鸡在该位点未发生突变;7 725 bp位点GG基因型频率均最高,G为泸宁鸡和米易鸡的优势等位基因。经卡方适合性检验,泸宁鸡在各个变异位点均处于Hardy-Weinberg平衡,米易鸡在2 109 bp、4 295 bp和4 359 bp位点均极显著偏离Hardy-Weinberg平衡。
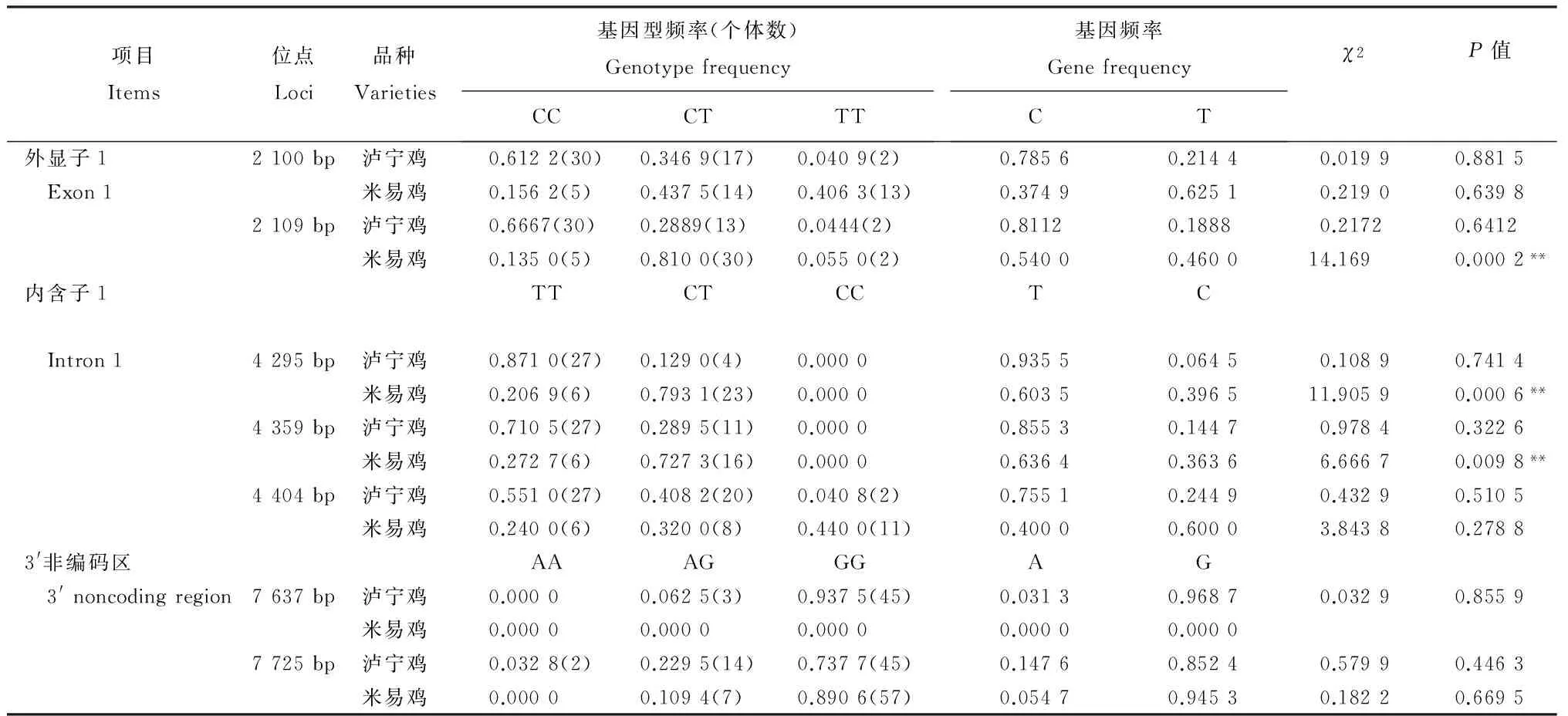
表2 MSTN基因的基因型频率和基因频率及χ2 检验
2.3 基因杂合度和多态信息含量
一般认为,基因杂合度(Ho)和多态信息含量(PIC)是度量各群体在位点上遗传变异的最适参数,其数值大小反映出遗传结构变异程度的高低,数值越低,表明群体的遗传多样性越低。从表3看出:各位点的Ho在0~0.496 7。在2 109 bp、4 359 bp和7 725 bp位点,泸宁鸡的PIC在0.25~0.5,表现出中度多态;在4 295 bp和7 637 bp位点泸宁鸡和7 725 bp位点米易鸡的PIC<0.25,表现出低度多态;其他各位点均表现出高度多态。
2.4 多态性与生长性状间的关联性
经多态性与生长性状间的关联性分析,外显子1中2 100 bp位点CC基因型米易鸡的心脏重显著高于TT型,TT基因型的屠宰率显著高于CC型,TT基因型的胫围极显著大于CC型;内含子1中4 359 bp位点TT基因型泸宁鸡的腺胃重极显著高于CT型; 3′非编码区7 725 bp位点AG基因型泸宁鸡的腺胃重、米易鸡的腹脂重显著高于GG型,GG基因型的半净膛率显著高于AG型。表明,突变位点对泸宁鸡生长性状的影响较米易鸡更为明显。各位点其他性状间差异不显著。
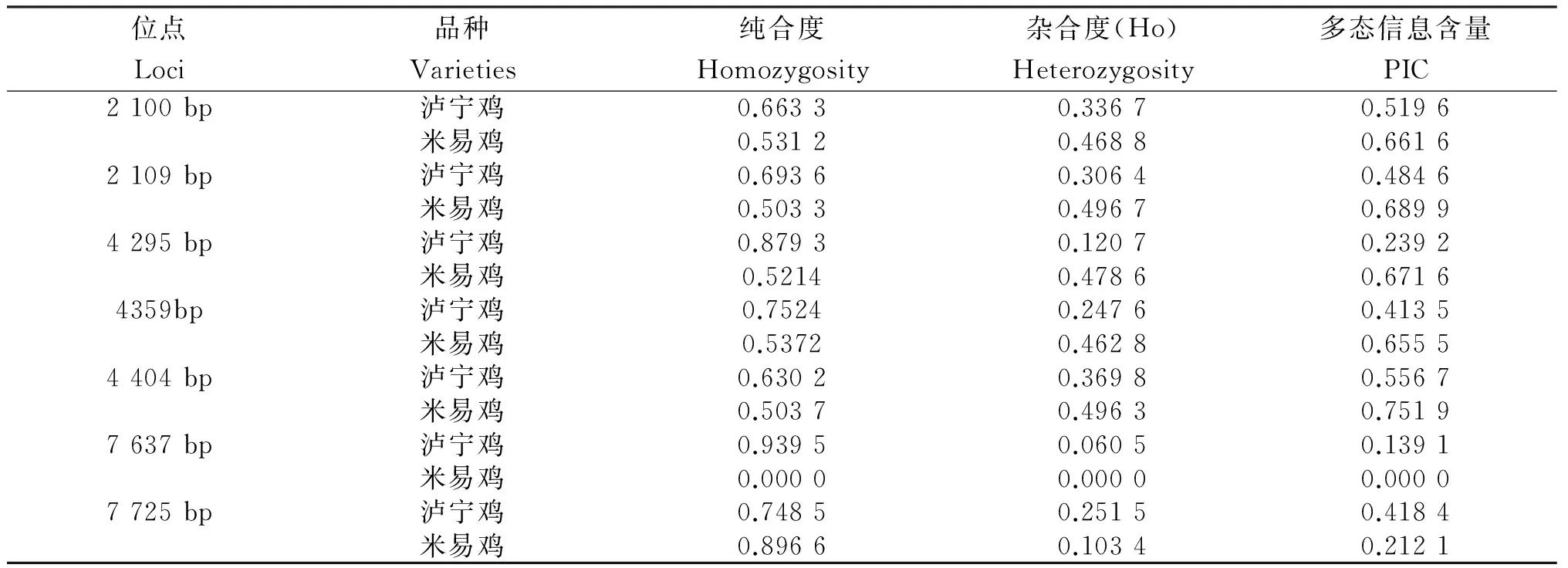
表3 MSTN各位点基因的纯合度、杂合度和多态信息含量

表4 泸宁鸡和米易鸡MSTN基因的单倍型及频率
2.5MSTN基因的单倍型
从表4看出:在外显子1上泸宁鸡和米易鸡分别检测到3种单倍型,泸宁鸡CC单倍型频率最大,CT频率最小;米易鸡3种单倍型分布差距较小。内含子1上泸宁鸡有2种单倍型,TTT单倍型明显高于CCC单倍型;米易鸡有CCC、TTC和TTT 3种单倍型,TTT单倍型的频率最高。 3′非编码区上只在泸宁鸡中发现AG、GA和GG 3种单倍型,GG单倍型的频率明显高于AG和GG型。若位点间无连锁,n个突变位点应产生2n种单倍型,而在本研究中利用软件均未检测到全部单倍型,说明位点间可能处于紧密连锁不平衡状态[14]。
3 结论与讨论
颜文锦等[15]对MSTN基因单核苷酸多态性与京海黄鸡初生重和1、4、8、12周龄体重等性状进行方差分析表明,各多态位点对体重有显著影响(P<0.05)。朱智等[16]对温岭鸡外显子1研究表明,不同基因型的活重、屠宰重、半净膛重、全净膛重、腿肌重、胸肌重、腹脂重和胸肌率、腹脂率、屠宰率有显著或极显著差异(P<0.05或P<0.01)。研究结果表明,泸宁鸡和米易鸡MSTN基因共发现7个SNPs位点,外显子12 100 bp(C/T)位点对鸡群心脏重、屠宰率和胫围有显著影响(P<0.05);内含子1中4 359 bp(T/C)位点鸡群的腺胃重差异极显著(P<0.01);3′非编码区7637(A/G)位点鸡群的腹脂重差异显著,7 725 bp(A/G)位点鸡群的腺胃重和半净膛率差异显著。外显子1的2个突变位点均未引起氨基酸变异,为同义突变,可能是由于MSTN基因DNA序列和结构的高度保守性,密码子的简并性使DNA分子上碱基组成有较大余地的变动,碱基发生改变氨基酸并未产生变异;但对鸡的生长性状产生了显著影响,推测可能是核苷酸的变化导致一些顺式作用元件的调控功能改变,影响MSTN基因的表达,进而对生长性状产生影响[17]。内含子1上碱基发生突变可能会影响基因转录、剪接、mRNA的稳定性,影响最终的翻译;或是内含子上SNPs与基因的表达调控有关[18]。3′非编码区虽然不直接参与转录翻译过程,但是碱基的突变可能导致某个转录因子的结合部位发生改变,从而导致基因的表达水平发生变化。3′末端发生变异可能影响DNA二级结构,进而影响转录稳定性及翻译效率等。
多数位点的基因杂合度(Ho)和多态信息含量(PIC)表现出米易鸡高于泸宁鸡,说明米易鸡群体的遗传多样性较泸宁鸡群高。泸宁鸡在各个变异位点均处于Hardy-Weinberg平衡状态,米易鸡在C2109T、C4295T和4359(C/T)位点都极显著偏离Hardy-Weinberg平衡,这可能与人工选择某种性状有关。顾志良等[6]研究发现,MSTN基因SNPs位点对腹脂重、腹脂率、初生重、胸肌重和胸肌率有影响。本研究未检测全部基因型,可能造成某些生长性状差异不显著的结果。
由于SNP属于二态性遗传标记,多态信息含量较低,对于复杂的多基因性状,分析某一基因中单个位点的多态性往往不能准确得出基因或等位基因与性状真实的相关性,而需要同时对多个位点组成的单倍型进行分析,才能找出与某种表型相关联的遗传标记[19]。研究结果表明,泸宁鸡在外显子1上有优势单倍型CC,频率为0.811;在内含子1上和3′非编码区都检测到具有明显优势的单倍型,分别为TTT(0.935)和GG(0.938)。米易鸡在外显子1和内含子1各位点上单倍型频率差异不大,因其在7 637 bp处未发生突变,所以没有构建单倍型。单倍型各位点处于连锁不平衡状态。
MSTN基因突变影响心脏重、腺胃重、腹脂重、胫围、屠宰率和半净膛率,单倍型分析各位点处于连锁不平衡状态。因此,可将MSTN基因作为地方鸡生长性状的候选基因。
[1] Mcpherron A C,Lee S J.Double muscling in cattle due to mutationsin the myostatin gene[J].Proc Natl Acad Sci,1997,94:12457-12461.
[2] Lee S J.RegμLation of muscle mass by myostatin[J].Annual Review of Cell and Developmental Biology,2004,20:61-81.
[3] Lee S J,Mcpherron A C.Myostatin and the control of skeletal muscle mass[J].Curr Opin Genet Dev,1999,9(5):604-607.
[4] 胡 兰,王 娜,胡 锐,等.大骨鸡MSTN基因的表达检测[J].中国家禽学报,2003,7(1):46-48.
[5] 顾志良,朱大海,李 宁,等.鸡Myostatin基因单核苷酸多态性与骨骼肌和脂肪生长的关系[J].中国科学:C辑,2003,33(3):273-280.
[6] 顾志良,张海峰,朱大海,等.鸡Myostatin基因单核苷酸多态性的群体遗传学分析[J].遗传学报,2002,29(7):565-570.
[7] 杨 宁.现代养鸡生产[M].北京:北京农业大学出版社,1993.
[8] 肖 雄,罗庆斌.利用DNA池技术分析鹅HSP70基因的多态性[C].杨凌:第十五次全国动物遗传育种学术讨论会论文集,2009.
[9] 宋桃伟,李敬瑞,刘若余,等.利用DNA池技术研究猪GH基因启动子序列的多态性[J].生物技术,2011,21(6):43-46.
[10] 崔建勋,杜红丽,张细权.利用DNA池和测序技术快速筛查SNPs及估算基因频率[J].遗传学报,2005,32(4):372-377.
[11] 汤贤春,路 健,李学英.PCR-SSCP技术在基因多态分析中的应用[J].中国西部科技,2010,6(9):55-57.
[12] 赵 爽,潘秋丽,姜宫凌侠.PCR-SSCR的效果分析[J].生物技术通报,2010(4):132-134,155.
[13] 张 利.黎晓敏.PCR-SSCP技术研究现状[J].饲料博览,2011(6):16-18.
[14] 刘铮铸,李祥龙,巩元芳,等.绵羊MSTN基因内含子2和外显子3部分序列的SNP检测和单倍型分析[J].中国畜牧杂志,2010,46(7):9-11.
[15] 颜文锦,李宁川,于佳慧,等.Myostatin基因单核苷酸多态性与京海黄鸡体重的相关性分析[J].上海畜牧兽医通讯,2007(5):15-17.
[16] 朱 智,吴登俊,徐宁迎.鸡Myostatin基因单核苷酸多态性及其对屠体性状的遗传效应分析[J].遗传,2007,29(5):593-598.
[17] 温彦涛,武子寅,赵振华,等.鸡MSTN基因多态性及其与屠体性状的关联分析[J].中国家禽,2012,34(16):29-32.
[18] 王悦冰,郎志宏,黄大昉.内含子对真核基因表达规律的影响[J].生物技术通报,2008(4):1-4.
[19] 张根喜,丁馥香,赵秀华,等.肌肉生长抑制素基因外显子3的多态性及其与边鸡繁殖性状的关联分析[J].中国畜牧杂志,2012,48(1):9-11.
(责任编辑: 冯 卫)
Polymorphism of Myostatin (MSTN) Gene and Correlation BetweenMSTNPolymorphism and Growth Traitss in Luning and Miyi Chicken
ZUO Bin1, REN Bingbing1, JIANG Xiaosong2, XIONG Yinglong3, WANG Kanghuan1,JIANG Li1, LIU Guangwei1, WANG Hai1, XU Ya’ou1*
(1.CollegeofLifeScienceandTechnology,SouthwestUniversityforNationalities,Chengdu,Sichuan610041, 2.SichuanAcademyofLivestockSciences,Chengdu,Sichuan610066; 3.YuanshengAgriculturalIntegratedDevelopmentLLC.,Mianning,Sichuan615600,China)
MSTN polymorphism of Luning Chicken and Miyi Chicken was detected by PCR-SSCP and main growth traits of Luning Chicken and Miyi Chicken were determined to analyze the correlation betweenMSTNpolymorphism and growth traits of Luning Chicken and Miyi Chicken. Results:There are two SNPs loci of 2 100 bp(C/T) and 2 109 bp(C/T)in exon 1 ofMSTNgene and there are 5 genotypes of CT, TT(2 100 bp), CC, CT and TT(2 109 bp) related to heart weight, shank girth and slaughter rate. Three haplotypes of CC,CT and TT are identified in Luning Chicken and Miyi Chicken. There are three SNPs loci of 4 295 bp(T/C), 4 359 bp(T/C) and 4 404 bp(A/C) in intron 1 and there are CT(4 295 bp), CT(4 359 bp), TT, CT and CC(4 404 bp)genotypes related to glandular stomach weight significantly. Luning Chicken has two haplotypes of CCC and TTT but Miyi Chicken has three haplotypes of CCC, TTC and TTT. There are two SNPs loci of 7 637 bp(A/G) and 7 725 bp(A/G) in 3’ non-coding region and there are AG(7 637 bp), AA, AG and GG(7 725 bp)genotypes related to glandular stomach weight, abdominal fat weight and half-eviscerated weight. Luning Chicken has three haplotypes of AG, GA and GG.MSTNgene is one of major genes influencing main growth traits of Luning and Miyi Chicken and should be used as a candidate gene for breeding of local chicken varieties.
Luning Chicken; Miyi Chicken; myostatin (MSTN); PCR-SSCP; growth trait; haplotype
2015-03-05; 2015-05-28修回
四川省畜禽育种攻关项目“肉鸡配套系选育”(2011NZ0099-6);四川省应用基础项目“四川民族地区主要地方鸡种遗传资源及肉质性状的遗传特性研究”(2013JY0044);西南民族大学研究生创新型科研项目(CX2014SZ105)
左 斌(1991-),男,在读硕士,研究方向:分子遗传育种。E-mail:990363506@qq.com
*通讯作者:徐亚欧(1957-),男,教授,从事动物遗传资源研究。E-mail:xuyaou@163.com
1001-3601(2015)07-0353-0026-05
S831
A
