裸花紫珠的组培快繁技术体系
2015-08-13朱红林陈健晓熊怀阳王效宁
朱红林,徐 靖,陈健晓,熊怀阳,王效宁
(海南省农业科学院 粮食作物研究所/农业部作物基因资源与种质创制海南科学观测试验站,海南 海口571100)
裸花紫珠(Callicarpa nudiflora)为马鞭草科紫珠属植物,是我国珍稀药材之一,主要分布于海南、广东、广西地区,生于平地至海拔1 200m的山坡、谷地、溪旁林中或灌木丛中[1]。干燥地上部分为药用,化学成分主要包括黄酮类、萜类、挥发油和酚类等,具有抗菌止血、消炎解毒、散瘀消肿、驱风祛湿之功效[2]。一直以来,裸花紫珠的原材料供给主要是依靠采挖野生资源,随着市场需求量逐年增加,野生资源逐年锐减,已不能满足生产需要。由于裸花紫珠种子最佳采种时间短以及种子不宜储藏,分株繁殖苗的系数和效率较低[3-4],无法提供大批优质种苗,以满足产业化基地生产的需要。目前,国内研究报道侧重在药理分析、治疗效果等方面[2,5],但在组培快繁方面较少,且仍停留在试验阶段,还未应用于规模化产业生产[6-7]。因此,笔者以实现裸花紫珠快速繁殖为目的,进行外植体消毒时间、6-BA和NAA及不同基质对成苗的影响试验,建裸花紫珠组培快繁技术体系,为裸花紫珠种苗的规模化生产提供可靠的技术途径。
1 材料与方法
1.1 植物
野生裸花紫珠当年生茎段,植株采自海南五指山。
1.2 外植体消毒及接种
于晴天午后,剪取当年生茎段置流水冲洗2~3h,晾干水分,分成5份。在超净工作台上用75%酒精消毒30s,再用0.1%升汞溶液分别振荡浸泡灭菌3min、5min、8min、10min、12min,无菌水冲洗5遍。将消毒的外植体,切成约1.5~2.0cm的单节茎段,接种到诱导培养基中。外植体接种培养20d后,统计污染率、萌芽率和不定芽长势。
1.3 诱导培养
以MS为基本培养基,分别添加6-BA 0mg/L、0.5mg/L、1.0mg/L、1.5mg/L、2.0mg/L 5个浓度水平,每瓶接种4个外植体,每处理接种10瓶。接种30d后统计茎段芽诱导率,其间观察诱导出芽的生长状况。
1.4 继代增殖培养
当诱导出的芽长4cm左右时,将其切割成单节茎段,接种到以MS为基本培养基、分别添加不同浓度 6-BA (0.5mg/L,1.0mg/L,1.5mg/L,2.0mg/L)和 NAA (0mg/L,0.05mg/L,0.1mg/L,0.2mg/L)的培养基中,共16个处理,每个处理5瓶,每瓶5个单节茎段,培养30d后记录生长情况,并统计诱导产生丛生芽数,计算繁殖系数。
1.5 生根培养
当增殖培养过程中无根试管苗长至1.5cm左右时,从基部切下转接到生根培养基上。以1/2MS为基本培养基,添加IBA(0mg/L,0.5mg/L,1.0mg/L,1.5mg/L,2.0mg/L)5个浓度水平,共5个处理,每个处理10瓶,每瓶5株。观察记录开始生根天数及根生长情况,30d后统计生根率。
1.6 炼苗与移栽
当苗高4~6cm、生根4条以上时移入拱棚炼苗7~10d,洗净根部培养基后,放入0.2%高锰酸钾浸泡1~2min,取出晾干后,栽入基质①红土、②河沙+红土(河沙∶红土=1∶1)、③河沙+椰糠+红土(河沙∶椰糠∶红土=2∶1∶1)、④河沙+椰糠+红土(河沙∶椰糠∶红土=1∶1∶1),栽后浇透定根水,盖遮阳网,20d后揭去遮阳网,30d后随机抽查100株统计移栽成活率,计算公式:
移栽成活率=(成活苗数/统计苗数)×100%
1.7 培养条件
诱导培养和增殖培养基中添加白砂糖30g/L,生根培养基中加白砂糖20g/L,卡拉胶均为6.0g/L,培养基pH 5.8。培养温度(28±1)℃,光照10h/d,光照强度为2 000Lx。
1.8 数据处理
用Excel 2007数据分析库进行数据统计、方差分析和多重比较。
2 结果与分析
2.1 消毒时间的确定
从表1看出,随着消毒时间的延长,外植体的污染率下降,在3~10min,萌芽率随消毒时间的增加而增加,高达70%,且不定芽长势较壮(图示A),而当消毒时间增加到12min时萌芽率下降,不定芽长势弱,说明消毒时间长,消毒效果好,但时间过长,消毒剂对外植体也会产生伤害。综合考虑污染率和萌芽率,裸花紫珠当年生茎段最佳的升汞消毒时间为10min。
2.2 6-BA对芽诱导的影响
接种培养10d后,外植体在诱导培养基上直接从茎节处分化出芽点。6-BA对裸花紫珠茎段芽诱导影响很大,当培养基中未加6-BA时,芽诱导率仅12.5%;而当6-BA浓度为0.5mg/L时,萌发率最高,达87.5%;随6-BA浓度的升高,芽诱导率反而下降,且叶片玻璃化;当6-BA浓度高达2.0mg/L时,只有愈伤组织,不分化芽(表2)。
2.3 激素组合对芽增殖的影响

表1 不同消毒时间裸花紫珠的外植体Table 1 Explants of C.nudifloratreated with different sterilization time

表2 不同6-BA浓度裸花紫珠的芽诱导与生长状况Table 2 Bud induction of C.nudifloratreated with different 6-BA concentration
从表3看出,单节茎段(图示B、C)在16种激素组合处理中的增殖系数差异很大,最高的达12.7,最低的只有3.2。6-BA浓度为0.5mg/L时,丛生芽增殖系数低,均在5.0以下,但丛生芽芽苗粗壮;6-BA浓度为2.00mg/L时,丛生芽增殖系数最高,但丛生芽芽苗细弱,大量玻璃化,而且植株节间很短,苗高1.0~1.5cm,不利于生根培养;6-BA浓度为1.50mg/L时,丛生芽增殖系数为7.62~10.62,虽然增殖系数低于6-BA浓度2.00mg/L,但丛生芽芽苗壮,平均株高1.5cm,利于生根,说明较低和较高浓度的6-BA对丛生芽的增殖效果均不理想。

表3 不同激素组合裸花紫珠单节茎段芽的增殖情况Table 3 Bud multiplication of C.nudiflora plantlets with different hormone combinations
对影响因子6-BA、NAA各处理的增殖系数进行方差分析得到,6-BA和NAA对丛生芽增殖的影响均达极显著水平,其中:6-BA对丛生芽的诱导影响作用大于NAA,6-BA和NAA的相互作用对丛生芽的增殖存在极显著影响,两者适宜的配比,丛生芽的增殖效果最好。6-BA和NAA的多重比较表明,6-BA 1.50mg/L 与0.50mg/L、1.00mg/L、3.00mg/L差 异 极 显 著,NAA 0.05mg/L 与0mg/L、0.10mg/L、0.20mg/L的差异也达极显著,6-BA 1.50mg/L与 NAA 0.10mg/L 两 者 配合,丛生芽的增殖系数最大,而且丛生芽的生长状况也较好。
2.4 IBA对生根的影响
从表4看出,在5种不同处理中,试管苗的株高无显著性差异,生根天数、根条数、根长和根诱导率均存在显著差异。未添加IBA的生根效果最差,根诱导最慢,20d后才开始生根,且根少、短,生根率仅有12.0%;低浓度的IBA,生根效果不理想,高浓度的IBA对生根也不利;只有IBA 1.0mg/L时,苗发根早、根多、粗壮,且有须根,利于炼苗移栽(图示D、E)。
2.5 基质对组培苗生长的影响
裸花紫珠组培苗在不同的移栽基质中成活率和株高均有不同(表5),基质组合①、②和③、④之间差异显著,基质组合③和④之间差异不显著,且组培苗的移栽成活率高,生长健壮(图示F)。因此,选用河沙∶椰糠∶红土=(1~2)∶1∶1基质配方移栽裸花紫珠组培苗较好。

表4 不同IBA浓度裸花紫珠组培苗的根分化情况Table 4 Root differentiation of C.nudiflora plantlets with different IBA concentration

表5 不同移栽基质裸花紫珠组培苗的生长情况Table 5 Growth plantlets of C.nudiflora with different transplanting substrate
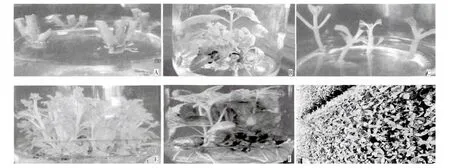
图示 组织培养快繁裸花紫珠的植株性状Fig. Character of C.nudiflora plantlets from rapid propagation
3 结论与讨论
本研究建立的裸花紫珠组培快繁技术体系:于晴天午后,剪取野生裸花紫珠茎段为外植体,流水冲洗后,用0.1%升汞溶液消毒10min,接种于培养基MS+6-BA 0.5mg/L+ 白 糖 30g/L+ 卡 拉 胶6.0g/L(pH 5.8)中诱导,当诱导出的丛生芽长4cm左右时,将其切割成单节茎段置于培养基MS+6-BA1.50mg/L+NAA0.01mg/L+30g/L白糖+6.0g/L卡拉胶(pH 5.8)中继代增殖,当增殖长出的无根试管苗长1.5cm左右时,即从基部切下转接到生根培养基1/2MS+IBA1.0mg/L+白糖20g/L+卡拉胶6.0g/L(pH 5.8)中,当苗高4~6cm、生根4条以上时炼苗、移栽于基质V河沙∶V椰糠∶V红土=(1~2)∶1∶1中,外植体芽诱导率为87.5%,继代增殖繁殖周期为30d,增殖系数为10,生根率100%,移栽成活率超过95%。
6-BA作为外源生长调节物质具有快速、非极性运输特性,在植物体各个部位均有分布,以茎尖和根部浓度较高[8]。在培养基中加入6-BA,是为促进细胞分裂和由愈伤组织或器官上分化不定芽[9],在本研究的外植体芽诱导试验中,添加0.5mg/L 6-BA的芽诱导率是未添加的7倍,表明6-BA是裸花紫珠外植体芽诱导的关键激素。
不同植物生长调节剂配合有叠加作用,比单一生长调节剂更能促进丛生芽或不定芽的形成与增殖[10]。在本研究中,6-BA 1.50mg/L 单独使用时增殖系数为7.62,与NAA 0.10mg/L配合使增殖系数达10.62,差异达极显著水平,且丛生芽的生长状况良好。本研究与潘梅等[7]研究适用于裸花紫珠增 殖 的 激 素 组 合 6-BA 2.00mg/L+ NAA 0.05mg/L不同,可能与外植体的取材不同、基本培养基的组分差别有关。潘梅等[7]采用的是种子接种培养无菌苗作外植体,而本研究是取用野生裸花紫珠茎段作外植体;潘梅等[7]是用蒸馏水和蔗糖配制培养基,而本研究是用自来水和市场白砂糖配制培养基,自来水的成分会影响培养基组分。
[1] 广东植物研究所.海南植物志[M].北京:科学出版社,1970:10.
[2] 蔡金平,董 琳,关薇薇,等.裸花紫珠的研究进展[J].现代药物与临床,2012,27(1):1.
[3] 黄秋银,蓝祖栽,潘春柳,等.裸花紫珠种子萌发影响因素研究[J].安徽农业科学,2009,37(25):12006-12007.
[4] 聂 垚,吴永忠,余宝平,等.裸花紫珠种苗繁育与栽培技术[J].现代园艺,2010(12):23-24.
[5] 谷陟欣,刘宇婧,颜冬兰,等.裸花紫珠、大叶紫珠和广东紫珠的研究进展[J].中国医药导报,2011,29(8):11-12.
[6] 姚 宏,刘南祥,吴华芬,等.大叶紫珠的组织培养与快速繁殖[J].植物生理学通讯,2008,44(1):135.
[7] 潘 梅,黄 赛,王景飞,等.药用植物裸花紫珠的组织培养与快速繁殖研究[J].中国农学通报,2013,29(7):127-132.
[8] 张 平,黄卫东.6-BA在葡萄植株体内的运转和分配[J].果树学报,2002,19(3):153-157.
[9] 李浚明,朱登云.植物组织培养教程[M].北京:中国农业大学出版社,2005:31.
[10] 曹孜义,刘国民.实用植物组织培养技术教程[M].甘肃:甘肃科学技术出版社,2003:53.
