复方抗焦虑胶囊对急性应激大鼠的抗焦虑作用及对大鼠脑内ERK/CREB信号通路和BDNF表达的影响
2015-02-26吕跃玮史淑宁郭建友石晋丽
吕跃玮,刘 洁,史淑宁,郭建友,刘 勇,石晋丽
(1.北京中医药大学中药学院,北京 100102;2.中国科学院心理研究所心理健康重点实验室,北京 100101)
复方抗焦虑胶囊对急性应激大鼠的抗焦虑作用及对大鼠脑内ERK/CREB信号通路和BDNF表达的影响
吕跃玮1,刘 洁1,史淑宁1,郭建友2,刘 勇1,石晋丽1
(1.北京中医药大学中药学院,北京 100102;2.中国科学院心理研究所心理健康重点实验室,北京 100101)
中国图书分类号:R-332;R282.71;R322.81;R749.72;R977.6
摘要:目的 研究复方抗焦虑胶囊对急性应激大鼠的药效及其对大鼠脑皮层及海马ERK/CREB信号通路、脑源性神经营养因子(BDNF)的影响。方法 采用高架十字迷宫实验,观察了复方抗焦虑胶囊低、中、高剂量(0.75、1.5、3 g· kg-1)给药7 d对急性应激大鼠行为的影响,采用Western blot免疫印迹法研究复方抗焦虑胶囊对ERK/CREB信号通路的影响,对急性应激大鼠脑皮层及海马BDNF表达的影响。结果 高架十字迷宫实验显示,复方抗焦虑胶囊高剂量组可明显增加大鼠进入开臂时间的百分数(OT%)(P<0.05)和进入开臂次数的百分数(OE%)(P<0.05)。West-ern blot实验显示,复方抗焦虑胶囊中剂量组明显减少了海马中p-ERK1/2的表达(P<0.05);高剂量组明显减少了大鼠皮层和海马中p-ERK1/2和p-CREB的表达(P<0.05)。高剂量组明显增加了大鼠皮层及海马中BDNF的表达水平(P<0.05,P<0.01)。结论 复方抗焦虑胶囊在高架十字迷宫模型中具有抗焦虑作用,且其抗焦虑机制可能与影响ERK/CREB信号通路,增加BDNF表达有关系。
关键词:复方抗焦虑胶囊;急性应激;高架十字迷宫;ERK/CREB信号通路;脑源性神经营养因子(BDNF);Western blot免疫印迹法
网络出版时间:2015-10-16 9:52 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20151016.0952.052.html
焦虑症是中枢神经系统常见的精神疾病,成为日益增长的全球健康问题。焦虑症以急性焦虑反复发作为特征,临床表现为广泛性焦虑和发作性惊恐状态2种形式。临床上以恐惧、紧张不安等精神障碍为主要表现,并伴有心悸、多汗、胸闷、呼吸窘迫以及睡眠障碍等[1]。在精神障碍中,焦虑症的终生患病率最高,影响到30%人口的寿命[2-3]。在我国,焦虑症已成为现代常见病和多发病,严重影响了人们的生活质量。因此,焦虑症的有效治疗成为亟待解决的问题。
苯二氮卓类药物已被证明是有效的抗焦虑药,如地西泮[4]等,但这些化合物存在明显的副作用,如镇静、肌肉松弛、遗忘和依赖性[5-7]。并且抗焦虑药物的服药时程长,易导致戒断反应、反跳和依赖。临床证实,中药治疗焦虑症不仅安全有效、副作用小,还具有改善其它相关症状的作用[8]。因此,研究开发疗效好、副作用小的中药抗焦虑新药成为近些年来研究的热点。
复方抗焦虑胶囊(antianxietic compound pre-scription capsule,ACPC)来源于临床经验方,由蜘蛛香、合欢皮、炒酸枣仁、灯心草组成,功能理气解郁、养血安神,主要治疗肝郁气滞、心神不宁型焦虑症。前期研究表明,该复方具有稳定的抗焦虑作用,且不影响动物的自主行为活动,其作用机制与调节
GABAA受体[9-10]、Cdk5/p35通路的表达,抑制脑中单胺类神经递质的释放以及调节免疫功能紊乱相关[11]。为了更加深入地对复方抗焦虑胶囊的药效进行评价,明确其作用特点,为其安全有效的应用提供实验和理论依据,本实验探讨了复方抗焦虑胶囊对急性应激大鼠的作用及其机制。
1 材料
1.1动物 SPF级SD♂大鼠,体质量150~170 g,购自北京维通利华实验动物技术有限公司,动物许可证号:SCXK(京)(2012-0001)。
1.2药品与试剂 ①蜘蛛香药材购自云南省师宗县,炒酸枣仁、合欢皮和灯心草购于河北省安国市蔺氏有限责任公司,经北京中医药大学石晋丽教授鉴定,蜘蛛香为败酱科缬草属植物蜘蛛香Valeriana jatamansi Jones的干燥根茎及根;酸枣仁为鼠李科枣属植物酸枣Ziziphus jujuba Mill.var.spinosa (Bunge)Hu ex H.F.Chou的干燥种子;合欢皮为豆科植物合欢Albizzia julibrissin Durazz.的树皮;灯心草为灯心草科植物灯心草Juncus effuses L.的干燥茎髓。蜘蛛香、炒酸枣仁、合欢皮、灯心草(均为干浸膏)按照12∶9∶9∶1的质量比混合,再加入0.5倍干膏量的糊精混匀,制成颗粒,干燥,分装,即得复方抗焦虑胶囊(含橙皮苷1.05 mg·g-1、酸枣仁皂苷A 7.50 mg·g-1),实验前用氯化钠注射液将其制成溶液备用。②地西泮(diazepam,DZP),2.5 mg ×20片,国药准字H11020898,北京益民药业有限公司,批号20120305。③氯化钠注射液,国药准字H37020764,山东齐都药业有限公司,批号1012081004。④RIPA裂解液、Bradford蛋白浓度测定试剂盒、30%丙烯酰胺-双丙烯酰胺、膜再生液、封闭用脱脂奶粉均购自北京普利莱生物科技有限公司;过硫酸铵(ammonium persulphate,AP)为美国Amersco公司产品;甲叉双丙稀酰胺、四甲基乙二胺(TEMED)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)为美国Sigma公司产品;三氨基甲烷(Tris)、甘氨酸购自美国Novon公司;p-ERK1/2、ERK1/2、p-CREB和CREB抗体为Cell Signaling公司产品;β-actin单克隆抗体为Santa Cruz公司产品;HRP标记山羊抗兔及兔抗山羊二抗均为中杉金桥公司产品;ECL发光检测试剂盒及光谱彩虹预染蛋白Marker均为康为公司产品;PVDF膜为美国Millipore公司产品;其它试剂为国产分析纯。
1.3仪器
1.3.1高架十字迷宫 大鼠高架十字迷宫(ANIL-AB)包括两个闭臂(50.9 cm,宽10.4 cm,高40.9 cm)与两个开臂(50.9 cm,宽10.4 cm),距地面74.3 cm。
1.3.2束缚管 聚乙烯材料束缚管自制(规格:长22.6 cm,直径7.9 cm)。
1.3.3Western blot免疫印迹实验仪器 超声匀浆机(USA Sonic公司)、高速冷冻离心机(Beckman Al-legra 64R)、移液器(1 000、200、100、20 μL)(德国Eppendorf公司)、UNIC7200型分光光度仪(上海UNIC公司)、-80℃低温冰箱(Forma,美国)、垂直板电泳转移装置(美国Bio-Rad公司)、恒温水浴摇床(上海比朗仪器有限公司)、多用脱色摇床、多功能酶标仪(美国Multiskan EX PRIMA-RY EIA V.2.3)。
2 方法
2.1造模与分组 大鼠单笼饲养,将大鼠随机分为空白组、模型组、胶囊低剂量组、中剂量组、高剂量组和阳性药物组,共6组,每组8只。其中低、中、高剂量组分别按0.75、1.5、3 g·kg-1·d-1给予灌胃,DZP组给予1.0 mg·kg-1·d-1灌胃,空白组和模型组灌服等容积的生理盐水,连续7 d灌胃给药,d 5、6、7除空白组外,其他各组在给予药物后进行急性应激造模。于d 5各组灌胃后,参照文献[12]造模方法并对其进行相应改进,除空白对照组外的其余各组动物放进束缚装置,束缚管只限制大鼠的活动范围,对其呼吸并无抑制。束缚期间禁食禁水,束缚结束后恢复自由。每次刺激30 min,每日1次,连续3 d。d 7给药束缚后,进行高架十字迷宫测试。
2.2对急性应激大鼠高架十字迷宫行为的影响迷宫测试前,将每只大鼠放入一个45 cm×30 cm× 15 cm塑料盒中,任其自由探究5 min后迅速置于EPM的中央平台处,使其头部正对其中一个开放臂,采用红外线技术记录5 min内大鼠的活动情况。每次测试完成后,用纸巾清除粪便,随后湿布蘸取酒精擦拭迷宫,继而用干布擦净后再进行下一只大鼠的测试。记录5 min内动物进入开臂次数(open arm entry,OE)、闭臂次数(close arm entry,CE)及迷宫中央区内的次数及在开臂与闭臂内的运动时间。以进入开臂次数与总入臂次数的百分比(the percentage of entries to the open arms,OE%)及在开臂内运动时间与开臂闭臂内的总时间的百分比(the percentage of time spent in the open arms,OT%)代表抗焦虑作用指标。
2.3Western blot检测急性应激大鼠脑皮层及海马ERK/CREB信号通路和BDNF的表达
2.3.1取材 大鼠急性应激EPM实验结束后,立即断头处死,迅速取出大脑,于冰盘上快速分离出海
马及皮层,随后于-80℃低温冰箱中冻存待用。
2.3.2组织裂解 取约200 mg海马或皮层组织,加入预冷的RIPA裂解缓冲液冰浴超声3×4 s,4℃下12 000 r·min-1离心10 min后吸取上清,采用Bradford法测定蛋白浓度后分装,立即95℃煮10 min使蛋白变性,防止蛋白降解,煮后的蛋白可-20℃保存备用。
2.3.3Western blot测定 按Western blot方法测定p-ERK1/2、ERK1/2、p-CREB和CREB蛋白与内参蛋白β-actin的表达,目的蛋白表达量与内参蛋白表达量的比值作为组织内蛋白的相对表达水平。
Western blot具体操作步骤如下:灌胶与上样:配制12%分离胶,加水封胶。分离胶凝固后将水尽量倒干净,用滤纸吸干分离胶残留的水,配制5%的浓缩胶,灌入制胶板,插入样品梳。待到浓缩胶凝固后,取出样品梳。加入50 μg蛋白的上样样品至1.5 mL离心管中,加入5×loading buffer上样缓冲液至终浓度为1×,加足量的running buffer后上样。
电泳:110 V电压恒压电泳2 h,电泳至溴酚兰即将跑出,即可终止电泳,停止电泳,拆开胶板,弃去浓缩胶,取出分离胶。
转膜操作:将PVDF膜在无水甲醇中浸泡至膜变成灰色透明,马上取出,放入去离子水中浸泡2 min,随即放入预冷的1×转膜Buffer中浸泡,浸泡凝胶30 min,滤纸、海绵20 min,以1×转膜Buffer注满电转膜槽,接通电泳仪,以0.23 mA电流恒流转膜1 h。
免疫反应:将膜用TBST从下向上浸湿后,移至含有封闭液的保鲜盒中,室温下脱色摇床上摇动封闭1 h后,4℃冰箱封闭过夜。将p-ERK1/2、ERK1/2、p-CREB、CREB与β-actin蛋白抗体以1×TBST稀释(1∶1 000),将膜蛋白面朝下放于抗体液面上,4℃冰箱中孵育过夜。然后用TBST在室温下脱色摇床上洗3次,每次10 min。同上方法二抗结合(1 ∶8 000),室温下孵育1 h后,用TBST在室温下脱色摇床上洗3次,每次10 min,随后进行化学发光反应。
化学发光、显影、定影:取ECL发光工作液A和B两种试剂各500 μL混合后,将膜蛋白面朝下与此混合液充分接触1 min,将膜用保鲜膜包好后移至X光压片夹后,进入暗室曝光X片。曝光结束后,放入显影液中显影并定影,自来水冲去残留的定影液后,室温下晾干。
凝胶图像分析:将胶片进行扫描拍照,用凝胶图像处理系统分析目标带的分子量和净光密度值。
2.4统计学处理 使用SPSS 16.0软件对数据进行统计,计量数据使用±s表示。多组间比较采用(One-way ANOVA)单因素方差分析,两两比较方差齐时采用LSD检验法,方差不齐时采用Dunnett’s T3进行两两比较。
3 结果
3.1复方抗焦虑胶囊对急性应激大鼠高架十字迷宫行为的影响 与空白组相比,模型组大鼠进入开臂时间的百分数(OT%)和进入开臂次数的百分数(OE%)明显降低(P<0.05);与模型组相比,DZP组、复方抗焦虑胶囊高剂量组均可明显增加大鼠进入开臂时间的百分数(P<0.05)和进入开臂次数的百分数(P<0.01,P<0.05)。结果见Tab 1。
Tab 1 Effect of ACPC on EPM behavior of acute stress in rats(±s,n=8)
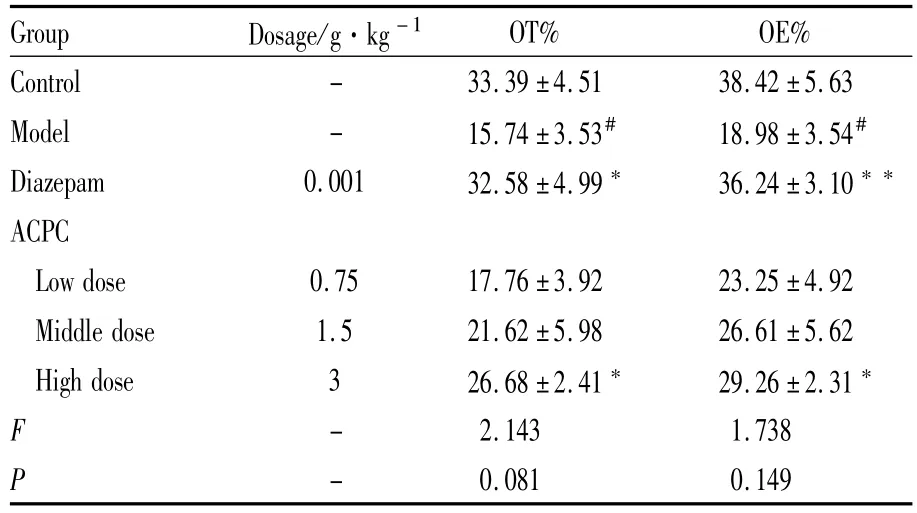
Tab 1 Effect of ACPC on EPM behavior of acute stress in rats(±s,n=8)
#P<0.05 vs control;*P<0.05,**P<0.01 vs model.
Group Dosage/g·kg-1OT% OE% Control - 33.39±4.51 38.42±5.63 Model - 15.74±3.53# 18.98±3.54#Diazepam 0.001 32.58±4.99 36.24±3.10**ACPC Low dose 0.75 17.76±3.92 23.25±4.92 Middle dose 1.5 21.62±5.98 26.61±5.62 High dose 3 26.68±2.41 29.26±2.31*F -2.143 1.738 P -0.081 0.149
3.2复方抗焦虑胶囊对ERK/CREB通路的影响与空白组相比,各组大鼠皮层与海马的总ERK表达水平差异无显著性,模型组大鼠的p-ERK1/2的表达量明显增加(P<0.01);与模型组相比,地西泮组明显减少p-ERK1/2在海马和皮层中的表达量(P <0.05);复方抗焦虑胶囊中剂量组明显减少海马中p-ERK1/2的表达(P<0.05);复方抗焦虑胶囊高剂量组明显减少了大鼠皮层和海马中p-ERK1/2的表达(P<0.05)。与空白组相比,模型组大鼠的p-CREB的表达量明显增加(P<0.01);与模型组相比,地西泮组明显减少p-CREB在海马和皮层中的表达量(P<0.05);复方抗焦虑胶囊高剂量组明显减少大鼠皮层和海马中p-CREB的表达(P<0.05)。结果见Tab 2~5及Fig 1。
3.3复方抗焦虑胶囊对急性应激大鼠脑皮层及海马BDNF表达的影响 与空白组相比,模型大鼠的海马和皮层中BDNF的表达水平明显降低(P<0.01);与模型组相比,地西泮组明显增加了大鼠皮层与海马中BDNF的表达水平(P<0.01,P<0.05);复方抗焦虑胶囊高剂量组明显增加了大鼠
皮层及海马中BDNF的表达水平(P<0.05,P<0.01)。结果见Tab 6和Fig 2。
4 讨论
束缚应激是一种有效的焦虑应激模型,通过数次强度、时间一致的束缚之后,可诱发动物出现排尿排便增多、修饰行为明显增多等行为指标,同时,还会影响体内激素及内分泌系统的变化,这些生理反应正是焦虑患者体内的生理变化。
Tab 2 The p-ERK1/2,ERK1/2 protein levels in cerebral cortex of rats(±s,n=8)

Tab 2 The p-ERK1/2,ERK1/2 protein levels in cerebral cortex of rats(±s,n=8)
##P<0.01 vs control;*P<0.05 vs model.
Group Dosage/g·kg-1 p-ERK1/2/β-actin ERK1/2/β-actin Control - 0.247±0.020 1.352±0.036 Model - 0.448±0.026## 1.441±0.050 Diazepam 0.001 0.324±0.040 1.306±0.040 ACPC Low dose 0.75 0.423±0.036 1.275±0.030 Middle dose 1.5 0.369±0.028 1.378±0.034 High dose 3 0.326±0.020 1.297±0.045 F- 9.003 2.805 P - 0.000 0.028
Tab 3 The p-ERK1/2,ERK1/2 protein levels in hippocampus of rats(±s,n=8)

Tab 3 The p-ERK1/2,ERK1/2 protein levels in hippocampus of rats(±s,n=8)
##P<0.01 vs control;*P<0.05 vs model.
Group Dosage/g·kg-1 p-ERK1/2/β-actin ERK1/2/β-actin Control - 0.289±0.035 1.231±0.044 Model - 0.408±0.029## 1.268±0.029 Diazepam 0.001 0.334±0.026 1.193±0.056 ACPC Low dose 0.75 0.391±0.020 1.124±0.041 Middle dose 1.5 0.353±0.022 1.302±0.032 High dose 3 0.358±0.017 1.201±0.037 F- 4.418 2.704 P - 0.003 0.033
Tab 4 The p-CREB,CREB protein levels in cerebral cortex of rats(±s,n=8)

Tab 4 The p-CREB,CREB protein levels in cerebral cortex of rats(±s,n=8)
##P<0.01 vs control;*P<0.05 vs model.
Group Dosage/g·kg-1 p-CREB/β-actin CREB/β-actin Control - 0.384±0.030 0.889±0.019 Model - 0.543±0.034## 0.912±0.017 Diazepam 0.001 0.417±0.027 0.944±0.021 ACPC Low dose 0.75 0.500±0.036 0.862±0.024 Middle dose 1.5 0.469±0.028 0.933±0.018 High dose 3 0.448±0.029 0.819±0.022 F- 9.861 16.026 P - 0.000 0.000
Tab 5 The p-CREB,CREB protein levels in hippocampus of rats(±s,n=8)

Tab 5 The p-CREB,CREB protein levels in hippocampus of rats(±s,n=8)
##P<0.01 vs control;*P<0.05 vs model.
Group Dosage/g·kg-1 p-CREB/β-actin CREB/β-actin Control - 0.452±0.038 0.783±0.024 Model - 0.606±0.023## 0.817±0.029 Diazepam 0.001 0.511±0.025 0.788±0.016 ACPC Low dose 0.75 0.579±0.031 0.832±0.020 Middle dose 1.5 0.523±0.029 0.761±0.022 High dose 3 0.478±0.037 0.796±0.019 F- 43.561 6.699 P - 0.000 0.000

Fig 1 Protein expression by Western blot in all groups
Tab 6 The BDNF protein level in cerebral cortex and hippocampus of rats(±s,n=8)

Tab 6 The BDNF protein level in cerebral cortex and hippocampus of rats(±s,n=8)
##P<0.01 vs control;*P<0.05,**P<0.01 vs model.
Group Dosage/g·kg-1BDNF/β-actin (cerebral cortex)BDNF/β-actin (hippocampus)Control - 0.63±0.07 0.58±0.05 Model - 0.37±0.03## 0.34±0.04##Diazepam 0.001 0.57±0.05 0.53±0.06*ACPC Low dose 0.75 0.40±0.05 0.38±0.05 Middle dose 1.5 0.42±0.04 0.38±0.04 High dose 3 0.54±0.06 0.55±0.05**F- 18.315 55.110 P - 0.000 0.000
生物学研究认为,调节正常和病理性焦虑状态的神经生物学通路异常是导致焦虑障碍的原因。而海马和皮层中ERK-CERB信号通路被认为可能与焦虑有关[13]。研究表明,焦虑大鼠脑内p-ERK1/2含量明显增加,且PD98059阻断其磷酸化后,可产
生明显抗焦虑的作用[14]。Meller等[15]发现,急慢性束缚应激可引起大鼠海马中p-ERK1/2的不同变化,大鼠急性束缚30 min后,海马中p-ERK1/2含量明显增加,慢性束缚应激11 d后,海马中p-ERK1/2含量明显减少。CREB转录因子的基因表达和对紧张、焦虑的潜在作用也被广泛研究,Lu等[16]研究表明,28 d慢性应激大鼠海马中p-ERK1/2与p-CREB的含量均明显减少。然而,也有研究表明14 d压力诱导大鼠海马中的p-ERK1/2与p-CREB的含量均升高[17]。通过以上结果可以发现,不同时间应激对p-ERK1/2与p-CREB的含量调控是双向的。本实验对大鼠采用3 d急性束缚应激,束缚大鼠表现为易受惊吓、易激惹、被毛竖立;束缚组大鼠在高架十字迷宫模型中表现为排尿、排便次数增多,呈现焦虑状,且与空白组相比,开臂时间与次数百分比明显减少,提示3 d造模可使大鼠产生焦虑。

Fig 2 BDNF expression by Western blot in all groups
因此,本实验对大鼠海马和皮层中p-ERK1/2 与p-CREB的含量进行测定,以明确复方抗焦虑胶囊对3 d急性束缚应激模型大鼠ERK-CERB信号通路的调节方式。实验结果表明,束缚应激会增强ERK-CREB通路的活化,导致磷酸化ERK和磷酸化CREB含量的增加,而地西泮和复方抗焦虑胶囊会抑制ERK-CREB过度的磷酸化,提示复方抗焦虑胶囊可能通过影响ERK-CREB信号通路产生抗焦虑作用。
BDNF是最早发现的神经营养因子,自1989年其cDNA结构被阐明以来,对BDNF的分布及功能有了广泛的深入研究。研究发现,BDNF可以调节神经元和突触的可塑性,对中枢神经元的增殖和修护有巨大的意义,而焦虑症的治疗也与神经元和突触的形成有密切关系。本实验结果表明,应激模型导致大鼠皮层及海马中BDNF明显减少,而复方抗焦虑胶囊可以明显抵消这种减少,从而对皮层和海马产生保护作用。
ERK-CREB通路与BDNF蛋白的表达关系密切,ERK-CREB通路的变化可以影响BDNF蛋白的表达。BDNF蛋白参与急性焦虑信号。实验结果表明,复方抗焦虑胶囊对ERK-CREB通路和BDNF蛋白的表达都有明显的影响,表现为抑制ERK-CREB通路的磷酸化与增加BDNF的表达,因此提示胶囊可能通过调节它们的相互反应而发挥其抗焦虑作用。
综上所述,本实验结果表明复方抗焦虑胶囊对急性应激模型大鼠具有一定的抗焦虑作用,并且其作用机制可能与影响ERK-CREB信号通路及BDNF的表达有关系,但它们之间深层次的相互影响有待于进一步研究。
参考文献:
[1] 周吉银,周世文,汤建林.中药复方制剂抗焦虑作用研究进展[J].中国药房,2010,21(11):1044-7.
[1] Zhou J Y,Zhou S W,Tang J L.Research progress on the anti-anxiety effect of traditional Chinese medicinal herbs prescriptions [J].China Pharm,2010,21(11):1044-7.
[2] Demyttenaere K,Bruffaerts R,Posada-Villa J,et al.Prevalence,severity,and unmet need for treatment of mental disorders in the World Health Organization World Mental Health Surveys[J].JA-MA,2004,291(21):2581-90.
[3] Kessler R C,Berglund P,Demler O,et al.Lifetime prevalence and age-of-onset distributions of DSM-IV disorders in the National Comorbidity Survey Replication[J].Arch Gen Psychiatry,2005,62(6):593-602.
[4] 谢 云,唐月月,魏晶晶,等.地西泮对焦虑、抑郁小鼠体重、痛阈和自主活动的影响[J].中国药理学通报,2010,26 (11):1529-30.
[4] Xie Y,Tang Y Y,Wei J J,et al.The effect of diazepam on the weight,pain threshold and independent activity of anxious mice and depressive mice[J].Chin Pharmacol Bull,2010,26(11):1529-30.
[5] Gardner C R,Tully W R,Hedgecock C J.The rapidly expanding range of neuronal benzodiazepine receptor ligands[J].Prog Neu-robiol,1993,40(1):1-61.
[6] Rickels K,Garcia-Espana F,Mandos L A,et al.Physician with-drawal checklist(PWC-20)[J].J Clin Psychopharmacol,2008,28(4):447-51.
[7] Youssef N A,Rich C L.Does acute treatment with sedatives/hyp-notics for anxiety in depressed patients affect suicide risk?A litera-ture review[J].Ann Clin Psychiatry,2008,20(3):157-69.
[8] 杨 阳.中药治疗焦虑障碍显优势[N].健康报,2013-1-8 (007).
[8] Yang Y.Traditional Chinese medicine treatment of anxiety disor-der[N].Health Report,2013-1-8(007).
[9] Wang Y L,Shi J L,Liu Y,et al.Anxiolytic-like effects of com-pound zhi zhu xiang in rat[J].Evid Based Complement Alternat Med,2012,2012:701289.
[10]彭 敏,石晋丽,郑虎占,等.蜘蛛香抗焦虑复方的抗焦虑作用及其机制[J].中草药,2011,42(11):2283-6.
[10]Peng M,Shi J L,Zheng H Z,et al.Anxiolytic-like effects of anti-anxietic compound prescription with valerianae jatamansi rhizoma et radix[J].Chin Tradit Herb Drugs,2011,42(11):2283-6.
[11]王延丽.复方马蹄香抗焦虑胶囊药效学研究及机制探讨[D].北京:北京中医药大学,2011.
[11]Wang Y L.Pharmacodynamic study of the anxiolytic effect on Compound Ma Ti Xiang Capsule[D].Beijing:Beijing University of Chinese Medicine,2011.
[12]Ortiz J,Fitzgerald L W,Lane S,et al.Biochemical adaptations in the mesolimbic dopamine system in response to repeated stress [J].Neuropsychopharmacology,1996,14(6):443-52
[13]Paul S,Olausson P,Venkitaramani D V,et al.The striatal-en-riched protein tyrosine phosphatase gates longterm potentiation and fear memory in the lateral amygdala[J].Biol Psychiatry,2007,61(9):1049-61.
[14]Fu A L,Liu F,Sui L,et al.Role of extracellular signal-regulated kinase signal transduction pathway in anxiety[J].J Psychiatr Res,2008,43(1):55-63.
◇实验方法学◇
[15]Meller E,Shen C,Nikolao T A,et al.Region-specific effects of acute and repeated restraint stress on the phosphorylation of mito-gen-activated protein kinases[J].Brain Res,2003,979(1-2):57-64.
[16]Lu J,Liang J,Wang J R,et al.Acupuncture activates ERK-CREB pathway in rats exposed to chronic unpredictable mild stress[J].Evid Based Complement Alterna Med,2013,2013:469765.
[17]Bravo J A,Diaz-Veliz G,Mora S,et al.Desipramine prevents stress-induced changes in depressive-like behavior and hippocam-pal markers of neuroprotection[J].Behav Pharmacol,2009,20 (3):273-85.
Anxiolytic effect of antianxietic compound prescription capsule on acute stress in rats and influence upon expression of ERK/CREB signaling pathway and BDNF in the brain of rats
LYU Yue-wei1,LIU Jie1,SHI Shu-ning1,GUO Jian-you2,LIU Yong1,SHI Jin-li1
(1.Beijing University of Chinese Medicine,Beijing 100102,China;2.Key Laboratory of Mental Health,Institute of Psychology,Chinese Academy of Sciences,Beijing 100101,China)
Abstract:Aim To study the pharmacodynamics of antianxietic compound prescription capsule(ACPC)on acute stress in rats and the influence upon the ex-pression of ERK/CREB signal pathway and brain-de-rived neurotrophic factor(BDNF)in the cerebral cor-tex and hippocampus of rats.Methods The elevated plus maze(EPM)test was applied to observe the effects of ACPC on acute stress rats administered 7 d low-,medium-and high-dose(0.75,1.5,3 g· kg-1).The expression of ERK/CREB signal pathway and BDNF in the cerebral cortex and hippocampus of rats were studied by using Western blot method.Re-sults In EPM,high-dose of ACPC increased signifi-cantly the rat open arm time(OT%)(P<0.05)and the percentage of open arm entries(OE%)(P< 0.05).In Western blot,the medium-dose of ACPC reduced significantly p-ERK1/2 expression in hippo-campus(P<0.05),and high-dose group decreased significantly the expression of p-ERK1/2 and p-CREB in the cortex and hippocampus of rats(P<0.05).High-dose group increased significantly the expression of BDNF in the cortex and hippocampus of rats(P<0.05,P<0.01).Conclusion ACPC has anti-anxie-ty effect in the model of EPM,and its mechanism may be related to the ERK/CREB signal pathway and in-creased BDNF expression.
Key words:antianxietic compound prescription cap-sule(ACPC);acute stress;elevated plus maze (EPM)test;ERK/CREB signal pathway;brain de-rived neurotrophic factor(BDNF);Western blot
作者简介:吕跃玮(1990-),男,硕士生,研究方向:中药创新药物,E-mail:lvyuewei100@126.com;石晋丽(1967-),女,博士,教授,研究方向:中药创新药物,通讯作者,Tel:010-84738623,E-mail:shijl@vip.sina.com
基金项目:国家科技部“重大新药创制”科技重大专项(No 2012ZX09102-201-018)
收稿日期:2015-07-28,修回日期:2015-09-01
文献标志码:A
文章编号:1001-1978(2015)11-1614-06
doi:10.3969/j.issn.1001-1978.2015.11.026
