血管内成栓脑梗死模型的制备及评价
2015-02-26马寅仲杜冠华
马寅仲,杜冠华
(中国医学科学院北京协和医学院药物研究所,药物靶点研究和新药筛选北京市重点实验室,北京 100050)
血管内成栓脑梗死模型的制备及评价
马寅仲,杜冠华
(中国医学科学院北京协和医学院药物研究所,药物靶点研究和新药筛选北京市重点实验室,北京 100050)
中国图书分类号:R-332;R363-332;R743.330.22;R743.330.53
摘要:目的 建立大鼠血管内成栓脑梗死模型并对其病理特征进行评价。方法 使用直流电刺激颈总动脉制造血栓,通过血流引导碎栓堵塞中动脉,制造脑栓塞模型。通过测定脑血流、脑梗死体积、动物行为学等指标,评价模型特点,并观察了组织型纤维蛋白酶原激活剂(tissue plasminogen activa-tor,t-PA)的溶栓作用。结果 脑梗死大鼠的病灶区血流量降低至基准值的30%左右,并在造模24 h后表现出明显的神经功能与运动功能失调,脑组织出现明显的梗死灶。使用t-PA进行溶栓治疗后可以明显改善上述病理特征。结论
大鼠血管内成栓脑梗死模型适用于进行血栓性脑梗死病理研究与药物溶栓作用评价。
关键词:缺血性脑卒中;中风;脑缺血;脑梗死;血栓模型;卒中模型
网络出版时间:2015-10-16 9:52 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20151016.0952.054.html
脑梗死是指血液中的各种栓子(如心脏内的附壁血栓、动脉粥样硬化的斑块等)随血流进入脑动脉而阻塞血管,引起该动脉供血区脑组织缺血性坏死,进而出现局灶性的神经功能缺损。制备符合临床实际的动物模型是研究脑栓塞病理过程、治疗效果和药物作用的关键条件。
本实验室根据脑栓塞发生的病理特点和临床表现,建立了一种新颖的大鼠血管内成栓脑梗死模型。通过使用直流电刺激触发凝血机制并形成初始血栓,再通过血流引导血栓阻塞中动脉供血,进而实现脑栓塞。本方法能够稳定造成大鼠中动脉供血区脑组织的梗死,并可以通过使用tPA溶解血栓,观察溶栓治疗效果。
1 材料与方法
1.1实验动物 ♂SPF级大鼠,体质量250~300 g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001。饲养于中国医学科学院药物研究所动物房,光照12 h/d,温度20℃~23℃,相对湿度40%~60%。
1.2药物和试剂 t-PA(50mg)购自勃林格殷格翰。批号305265。溶解于厂家提供的50 mL注射用水,使用前根据分组需要,使用医用生理盐水进行稀释。2,3,5-氯化三苯基四氮唑(2,3,5-triphenyl tetrazolium chloride,TTC)购自西格玛奥德里奇,货号17779。TTC用生理盐水配制成质量浓度为每mL 0.5 g的溶液备用。
1.3主要仪器 YLS-14B小动物血栓生成仪(济南益延科技发展有限公司);激光多普勒血流仪(Laser Doppler Flowm-etry,LDF)系统,包括PeriFlux 5001 Main Unit、PF5010 LDPM Unit(激光多普勒微血流灌注量检测单元)和LD Probe 407-1 (Perimed Co.,Jarfalla,Sweden);ALC-HTP小动物恒温系统(上海奥尔科特生物科技有限公司);DXP-3大小鼠转棒仪(中国医学科学院药物研究所)。
1.4模型制备 按350 mg·kg-1剂量腹腔注射水合氯醛麻醉大鼠,并将其俯卧位固定于鼠板上。沿矢状缝纵向剪开头部皮肤并清理手术视野,以前囟为坐标原点,选取前囟后2 mm、右侧5 mm为测定点,清理周围直径约2-3 mm区域毛细血管与筋膜,粘接固定好激光多普勒血流仪检测探头并记录5 min的术前血流值作为基准值。
纵向剪开2 cm左右颈部皮肤,分离颈外静脉、颈总动脉与颈外动脉,使用动脉夹夹闭颈外动脉。剥离动脉鞘及神经,将劲总动脉放入血管电击夹的沟槽内,调整好高度和方向,使用1.00 mA电流强度,持续电刺激225 s。
电刺激结束后动脉失去搏动,并可见血管内长度约1 cm的黑色血栓。取下电击夹,用动脉夹夹闭颈总动脉的远心端,使用长度为1 cm的软质镊子(头部为1 mm左右锯齿)夹动血栓10次,此时血管变为均匀的灰色,同时可见动脉恢复搏动并冲击碎栓。放开动脉夹,见到血栓进入颈内动脉后立即夹闭颈总动脉近心端10-15 min。到时间后打开全部动脉夹,若血流值下降至基准值的40%以下时,视为形成目的栓塞模型。造模过程如Fig 1所示。造模成功率87.2%(327只大鼠中,42只出现自发血管再通或血流变化小于基准值的60%)。
1.5动物分组及给药 大鼠随机分为3组(每组10只),分别为:假手术组(sham)、溶剂对照组(vehicle)、tPA给药组。手术后10 min给药组于颈外静脉缓慢推注给药两次,两次给药间隔30 min。假手术组及模型溶剂对照组静脉注射给予生理盐水。
1.6观察指标及检测方法
1.6.1中动脉供血区脑血流量(cerebral blood flow,CBF)监
测 按照前述方法固定激光多普勒血流仪探头,持续监测大鼠中动脉供血区的血流值。血流变化以第二次给药后30 min血流值与基准值的百分比变化表示。
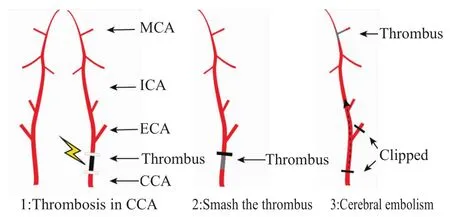
Fig 1 Schematic illustration of thrombosis in cerebral embolism model in rats
1.6.2行为学评分 手术后24 h进行4项行为学检测:神经行为学评分,检测参照Bederson等[1]和Belvyev等[2]的观察方法并稍加改进:提起鼠尾离地30 cm,正常大鼠两前肢对称向前伸开。如有肩部内旋、前肢内收,根据其严重程度,正常评分为0分,严重程度最高评为4分。
1.6.2.1转棒实验 检测大鼠的四肢协调性。0分:转动过程中,鼠可在棒上行走;1分:鼠可以在转动的棒上行走至少1 min;2分:转动开始后,鼠在1 min以内从棒上掉下来;3分:转动开始前,鼠从棒上掉落。
1.6.2.2悬挂实验 观察大鼠前爪抓握能力。将大鼠前爪同时挂于直径5 mm的绳上。1分:两爪均能挂住;2分:一爪能挂住;3分:两爪均不能挂住。
1.6.2.3斜板实验 观察大鼠后肢力量与四肢协调性。将大鼠头向上放置于85°倾斜木板的塑料颗粒面上。记录大鼠在斜板上的停留时间,肢体完全脱离塑料颗粒面时视为掉落,停留时间大于120 s时按120 s计算。大鼠攀爬至板顶端、四肢中仅部分离开塑料颗粒面均不作为有效结果。
1.6.3脑梗死体积测定 行为学检测后,大鼠麻醉后脱颈处死,取全脑迅速于-40℃冷冻并切片。每片厚度2 mm。脑组织切片使用TTC溶液于37℃孵育15 min后,换以4%多聚甲醛孵育20 min。最后按顺序摆放切片并拍摄照片。数据处理时,应用图像分析软件Image J处理并计算每张脑片的梗死面积,梗死体积以所占大脑半球的百分率来表示,按下述公式计算以消除脑水肿的影响。
脑梗死体积/%=(手术对侧半球的体积-手术侧半球未梗死部分的体积)/2×手术对侧半球的体积×100%
1.7统计学处理 采用SPSS 17.0统计软件,进行正态性检验。所有数据以±s表示,如正态分布数据用单因素方差分析(One-Way ANOVA),若方差齐,两两比较采用最小显著性差异法(least significant difference,LSD)。方差不齐则采用Dunnett’s T3检验。不符合正态分布的数据采用非参数检验进行统计。死亡率显著性检验采用χ2检验。
2 结果
2.1血管内成栓脑梗死模型大鼠缺血区血流检测 如Fig 2A-2B所示,当血栓进入中动脉供血区实现梗死后,CBF立即降低至基准值的(35.74±8.07)%。模型组在栓塞后的60 min内CBF值能够保持稳定。于颈外静脉注射t-PA后,CBF明显回升至基准值的(69.64±7.38)%。造模24 h后,t-PA组15只大鼠存活14只,明显高于模型组,P<0.05(3/15)。

Fig 2 Cerebral blood flow in thromboembolic stroke model measured after the thrombolytic therapy
2.2大鼠脑梗死体积检测 造模24 h后对大鼠脑组织进行TTC染色。如Fig 3A所示,模型大鼠脑组织出现典型的梗死灶与水肿。模型大鼠的脑梗死体积为(23.66± 4.31)%。而t-PA溶栓治疗可以明显降低脑梗死体积至(12.32±1.13)%(Fig 3B)。
2.3大鼠行为学检测 造模24 h后,大鼠表现出明显的神经功能障碍。模型组大鼠四肢协调能力与肢体力量均明显降低。如Fig 4A-4D所示,t-PA给药组的各项行为学检测评分均得到明显改善,提示t-PA对模型大鼠的治疗作用。
3 讨论
脑缺血动物模型是进行脑缺血病理与治疗药物研究的基础,目前局灶性脑缺血模型主要有线栓法、栓子栓塞法和局部凝血法[3-4]。
线栓法是目前最常用的脑缺血模型。该模型通常使用适宜直径的尼龙线由颈外动脉经颈总动脉插入脑中动脉阻
塞血流,形成栓塞模型[4]。该方法可以完全阻断中动脉供血,造成稳定的脑梗死体积,而且可以通过拔出线栓制备缺血/再灌注损伤模型。然而该方法并不涉及血栓栓塞过程,与临床血栓形成的实际过程不一致,也不适用于溶栓药物的研究。
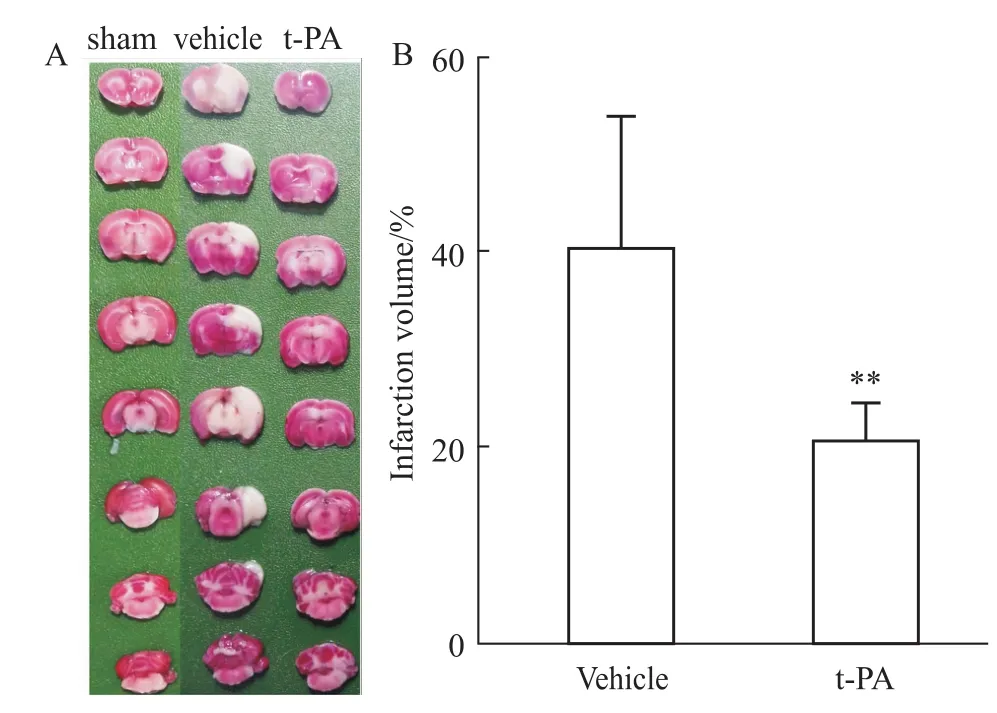
Fig 3 Brain lesion measured by TTC-staining

Fig 4 Four behavior tests carried out at 24 h after the t-PA treatment in thromboembolic stroke model
栓子栓塞造模法通常通过颈总动脉向大脑注入一定体积的栓子,导致脑血管堵塞。目前动物实验使用的栓子主要有两种,一是塑料栓子,大小均匀,可以形成比较稳定的脑缺血模型[5];二是使用大鼠自身血液,在体外凝固干燥后研磨成颗粒,再通过导管导入大鼠中动脉实现血栓栓塞[6]。该方法由于血栓在体外形成,无法模拟临床上血栓形成与老化过程。干燥的血栓导入血管内不易黏附在血管壁上,易造成梗死体积与梗死区域的变化,因此不适用于进行药物溶栓能力与时间窗的研究。
局部凝血法是通过感光染料[7]、凝血酶[8]或三氯化铁等方式激活中动脉凝血酶系统,进而形成血栓的造模方式。此类方法虽然属于体内成栓,然而临床上栓子的多是由内皮脱落斑块形成的混合型血栓,并非单一的血凝块,且血栓基本是由于非脑源的栓子(分为心源或非心源)通过血流进入脑内微动脉造成的栓塞。此外,此类模型基本都需要开颅手术,因而释放了模型动物的颅内压,减轻了水肿对脑组织的损伤。因此这类模型仍然难以胜任溶栓药物的临床前研究。
本文介绍了一种新颖的大鼠血管内成栓脑梗死模型。本模型尽可能的模拟了临床上非脑源性脑梗死的发病过程,因而非常适合进行药物溶栓作用的评价。当血栓堵塞中动脉供血区后,该区域的CBF值能够稳定下降至基准值的30%左右,与其它造模方法产生的血流阻断效果一致[9]。
造模24 h后,与前述模型类似[10],大鼠表现出均一的神经功能失调,如身体向一侧倾斜,病灶脑区对侧前肢内收,肢体自发性转圈等。TTC染色证明造模大鼠出现脑梗死与水肿现象,且梗死体积较为均一。在使用t-PA进行溶栓治疗后,病灶区血流量明显升高,各项行为学指标均明显改善,脑梗死体积也明显缩小。提示使用t-PA进行溶栓治疗能够有效溶解血栓,改善脑梗死造成的损伤。
综上所述,本模型通过血管内造栓,不需开颅。造模成功率高(87.2%)、脑梗死体积稳定(23.66±4.31)%、造模后能够表现出相应神经与运动功能障碍。血栓的形成、栓塞与老化过程十分接近心源性卒中的病理过程,适用于评价药物的溶栓治疗效果和副作用。
参考文献:
[1] Bederson J B,Pitts L H,Tsuji M,et al.Rat middle cerebral ar-tery occlusion:evaluation of the model and development of a neu-rologic examination[J].Stroke,1986,17:472-6.
[2] Belayev L,Alonso O F,Busto R,et al.Middle cerebral artery oc-clusion in the rat by intraluminal suture.Neurological and patho-logical evaluation of an improved model[J].Stroke,1996,27:1616-22.
[3] Macrae I M.Preclinical stroke research-advantages and disadvan-tages of the most common rodent models of focal ischaemia[J].British J Pharmacol,2011,164:1062-78.
[4] 范晓迪,刘建勋,林成仁,等.动脉粥样硬化脑缺血/再灌注动物模型的研究进展[J].中国药理学通报,2014,30(3):300-5.
[4] Fan X D,Liu J X,Lin C R,et al.Research progress in the athero-sclerotic animal models with induced cerebral ischemia/reperfusion [J].Chin Pharmacol Bull,2014,30(3):300-5.
[5] Longa E Z,Weinstein P R,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20:84-91.
[6] Durukan A,Tatlisumak T.Acute ischemic stroke:overview of major experimental rodent models,pathophysiology,and therapy of focal cerebral ischemia[J].Pharmacol Biochem Behav,2007,87:179-97.
[7] Dinapoli V A,Rosen C L,Nagamine T,et al.Selective MCA oc-clusion:a precise embolic stroke model[J].J Neurosci Methods,2006,154:233-8.
[8] Sugimori H,Yao H,Ooboshi H,et al.Krypton laser-induced photothrombotic distal middle cerebral artery occlusion without
craniectomy in mice[J].Brain Res Brain Res Protoc,2004,13:189-96.
◇研究简报◇
[9] Tajiri N,Dailey T,Metcalf C,et al.In vivo animal stroke mod-els:a rationale for rodent and non-human primate models[J].Transl Stroke Res,2013,4:308-21.
[10]Dirnagl U,Kaplan B,Jacewicz M,et al.Continuous measurement of cerebral cortical blood flow by laser-Doppler flowmetry in a rat stroke model[J].J Cerebral Blood Flow Metab,1989,9:589-96.
[11]Tabassum R,Vaibhav K,Shrivastava P,et al.Centella asiatica attenuates the neurobehavioral,neurochemical and histological changes in transient focal middle cerebral artery occlusion rats[J].Neurol Sci,2013,34:925-33.
Establishment and evaluation of intravascular thrombosis used for cerebral embolism model
MA Yin-zhong,DU Guan-hua
(Beijing Key Laboratory of Drugs Target and Screening Research,Institute of Materia Medica,Chinese Academy of Medical Sciences and Peking Union Medical College,Beijing 100050,China)
Abstract:Aim To produce cerebral embolism rat model via in-travascularly formed thrombus.Methods Thrombus was formed in common carotid artery(CCA)by constant galvanic stimulation,then it was shattered and MCA was occluded.To i-dentify the feature of the model,focal cerebral blood flow (CBF),cerebral infarction volume and behavior tests were measured.Thrombolysis with tissue plasminogen activator(tPA)were observed.Results This model developed a reduction of blood flow(30%of baselines)within the MCA territory.Signifi- cant infarction and neurological disorder were observed 24 h after the embolism onset.Thrombolysis with tPA ameliorated the path-ological process which was mentioned above.Conclusion Cer-ebral embolism model induced by intravascular formed thrombus in rat is suitable for the research of pathology and thrombolytics for embolic stroke.
Key words:ischemic stroke;stroke;cerebral ischemia;cere-bral embolism;thrombus model;stroke model
作者简介:马寅仲(1986-),男,博士生,研究方向:神经药理学,E-mail:mayinzhong@imm.ac.cn;杜冠华(1956-),男,博士,研究员,博士生导师,通讯作者,E-mail:dugh@imm.ac.cn
基金项目:国家科技部“重大新药创制”科技重大专项(No 2009ZX09102-034);国家自然科学基金资助项目(No 81073120)
收稿日期:2015-07-01,修回日期:2015-07-30
文献标志码:A
文章编号:1001-1978(2015)11-1620-04
doi:10.3969/j.issn.1001-1978.2015.11.027