HPLC-MS-MS正负离子切换测定豆芽中4种植物生长调节剂残留量
2015-02-25魏一婷
魏一婷
(厦门出入境检验检疫局检验检疫技术中心, 福建 厦门 361100)
HPLC-MS-MS正负离子切换测定豆芽中4种植物生长调节剂残留量
魏一婷
(厦门出入境检验检疫局检验检疫技术中心, 福建 厦门 361100)
摘要:建立了高效液相色谱-串联质谱法(HPLC-MS-MS)同时测定豆芽中4种植物生长调节剂(6-苄基腺嘌呤、赤霉酸、对氯苯氧乙酸、咪酰胺)残留的方法。样品加入少量无水硫酸钠后采用含1%(V/V)乙酸的乙腈溶液提取,QuEChERS(PSA+C18)净化。在ESI源下进行正负离子切换扫描检测,以保留时间和特征离子对定性,外标法定量。结果表明4种待测物质在1.0-200 μg/L范围内线性关系良好,定量离子对的相关系数大于0.9990。方法定量限(S/N=10)赤霉酸为20 μg /kg,其余三种均为2.5-5.0 μg/kg,方法回收率为81.3%-102.5%。本文提供了质谱中正负离子切换同时检测多个植物生长调节剂残留的方法,可满足一针进样同时测定,前处理方法简便,回收率高,可应用于豆芽中4种植物生长调节剂残留的日常检测。
关键词:豆芽;高效液相色谱-串联质谱法(HPLC-MS-MS);植物生长调节剂
豆芽是深受人们喜爱的蔬菜,其富含Vc、氨基酸、视黄醇、膳食纤维等对人体有益的成分,而且脂肪、胆固醇含量很低,适合“三高”人群食用,有利于调节不健康的膳食结构。但是近年来,随着毒豆芽事件频频曝光,民众对豆芽的安全食用性表现出越来越多的担忧和不信任。所谓毒豆芽,外表看似新鲜,但是至少含4种违法添加剂,包括植物生长调节剂、杀菌剂、激素添加剂等。这些添加剂使豆芽个头均匀,颜色白净,且绝大多数没有根须,看起来很漂亮,但这些添加剂残留在人体内积累所产生的有害作用却是不容忽视的(唐莉娟等,2009)。
目前国内外有关豆芽中植物生长调节剂残留量的检测方法报道较少,以气相色谱法(常宇文等,2007)、液相色谱法(夏慧等,2011)、气相色谱-质谱法(陈卫军等,2012)、液相色谱-质谱法 (刘春生等,2014;黄何何等,2014;林黛琴等,2013;柳菡等,2013;Maetal.,2013;Zhangetal.,2012) 为主。这些方法有其特定的优点,亦有各自的缺点。比如气相色谱及气相色谱-质谱法存在前处理需进行衍生反应,操作繁琐等问题,而液相色谱选择性较差,灵敏度低且难以确证。因此液相色谱-质谱法以其前处理操作简单,选择性高及灵敏度佳等优势,成为广泛使用的检测方法。
为了保障公众食品安全,满足准确快捷检测出毒豆芽中植物生长调节剂残留量的要求,本文通过优化质谱参数和色谱条件,考察流动相、提取方法和基质效应等因素,整合建立了HPLC-MS-MS 同时测定豆芽中6-苄基腺嘌呤、赤霉酸、对氯苯氧乙酸,咪酰胺等4种植物生长调节剂残留量的分析方法。
1 材料与方法
1.1试剂与仪器
ABI/SCIEX的4000Q TRAP质谱,配Agilent 1200高效液相色谱仪(美国Agilent),电喷雾离子源( ESI);IKA T25 Basic均质器(德国IKA);离心机(上海安亭科学仪器厂);固相萃取装置(美国Supelco);氮吹仪(美国Caliper);涡旋混匀器(IKA 3 Basic,德国IKA);Milli Q超纯水系统(美国Millipore)。
乙腈和甲醇(色谱纯,德国Merck);甲酸(色谱纯,德国Merck),乙酸铵(色谱纯,Fluka),乙酸、无水硫酸钠和氢氧化钠为分析纯;乙二胺-N-丙基硅烷(PSA)和C18填料(40 μm),实验用水符合GB/T 6682规定要求。
标准品:6-苄基腺嘌呤(0.1 g 99.0%, Dr.Ehrenstorfer)、赤霉酸(0.1 g 98.0%, Dr.Ehrenstorfer)、对氯苯氧乙酸(0.25 g 99.5%,Dr.Ehrenstorfer)、咪酰胺(0.25 g 98.5%,Dr.Ehrenstorfer)。
称取适量标准品,分别用甲醇配制成100 mg/L的储备液并储存在-4 ℃ 冰箱中。根据实验需要,用乙腈稀释标准储备液,配成适当浓度的标准工作溶液。
1.2样品前处理
称取10 g(精确至0.01 g)样品于50 mL离心管中,加入10 mL 1%乙酸乙腈溶液,匀浆2 min后,加入脱水试剂(2 g无水硫酸钠),涡旋振荡1 min,以4 000 r/min离心3 min,取2.0 mL上清液于分散固相萃取管(50 mgPSA+100 mgC18)中,涡旋混匀1 min,后于16 000 r/min速率下离心5 min,所得上清液经0.2 μm有机滤膜过滤后,待测定。
1.3色谱条件
T3色谱柱(waters Atlantis®T3 3 μm;2.1 mm×150 mm);流动相A为0.1%甲酸水,B为乙腈;洗脱程序:0-2.0 min,5%B-20%B;2.0-6.0 min,20%B;6.0-6.1 min,20%B -65%B;6.1-9.5 min,65%B;9.5-9.6 min,65%B -70%B;9.6-12.0 min,70%B;12-12.1 min,70%B -5%B;12.1-17.0 min,5%B。进样量为0.5μL,流速400 mL/min,柱温箱温度:30 ℃。
1.4质谱条件
ESI正负离子分段采集,4种待测物的监测离子及锥孔电压、碰撞室入口电压、碰撞能量、碰撞室出口电压等参数如表1所示。

表1 4种植物生长调节剂质谱分析条件
注:其中*表示定量离子
2结果与分析
2.1质谱条件优化
使用针泵进样分析目标化合物的标准溶液,优化4种植物生长调节剂的质谱条件。化合物进入一级质谱后,可产生稳定的[M+H]+离子或[M-H]-离子。其中6-苄基腺嘌呤可产生[M+H]+离子,也可以形成稳定的[M-H]-离子,但[M+H]+离子的灵敏度明显更高。在综合考虑灵敏度与分段扫描等因素后,最终选用对氯苯氧乙酸、赤霉酸的[M-H]-离子为母离子,咪酰胺、6-苄基腺嘌呤的[M+H]+离子为母离子;确定了化合物母离子后,在Product Ion模式下,母离子进入二级质谱,对化合物母离子施加一定量的碰撞能量(CE),母离子发生断裂或重排等反应产生不同的子离子碎片。最后在MRM模式下,优化目标物离子碎片的最佳条件。6-苄基腺嘌呤,赤霉酸,对氯苯氧乙酸,咪酰胺4种植物生长调节剂的MRM色谱图见图1。
2.2色谱条件优化
液相色谱-质谱分析中,水相使用最多的有甲酸水溶液、乙酸铵水溶液等,有机相通常使用乙腈,0.5%甲酸乙腈、乙酸铵乙腈溶液。通过实验结果对比,发现采用0.1%甲酸水和乙腈作为流动相时,目标物的分离度和峰型较好,对于负离子两个物质,特别是赤霉酸的影响也较小,信号响应值大约下降30%。若使用乙腈-水作为流动相,则在ESI正模式下检测的化合物响应值下降50%,故本实验采用0.1%甲酸水和乙腈作为流动相。
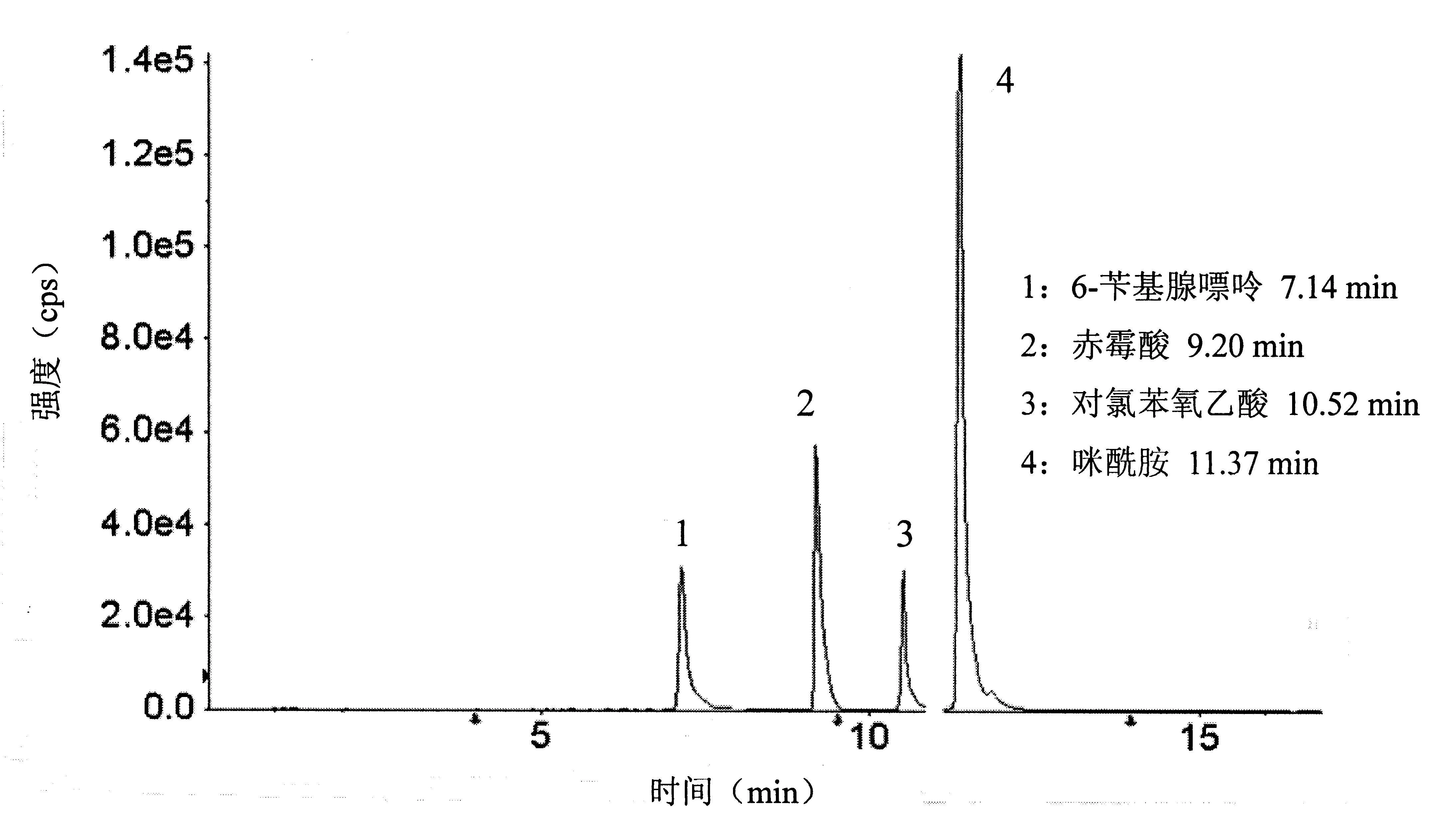
图1 4种植物生长调节剂的MRM总离子流图
2.3提取溶剂的选择
根据四种目标化合物的化学性质,本实验对比了甲醇、1%乙酸甲醇、乙腈、1%乙酸乙腈、含1% 1 mol/L NaOH的乙腈五种溶剂的提取效率,结果如图2所示。研究结果表明,1%乙酸乙腈的提取效率总体较高,对赤霉酸和对氯苯氧乙酸来说,由于结构中含有羧基,酸性条件能抑制羧基在溶液中电离成离子形态,从而提高回收率。因此本实验采用1%乙酸乙腈作为提取溶剂。

图2 不同溶剂提取效率对比
2.4净化条件的优化
固相萃取(SPE)是最常用的前处理净化方法之一,虽然SPE 技术对微量或痕量目标化合物的提取、分离能力较强,但其操作比较繁琐、耗时,且成本较高,不适于大批量样品的快速筛查(陈卫军等,2012)。本实验采用QuEChERS的提取方法,考察了PSA,C18,GCB这三种常用的吸附剂材料对4种目标化合物的吸附作用。实验表明,PSA对于对氯苯氧乙酸具有一定的吸附作用,该作用随着PSA使用量的增大而增大;C18对6-苄基腺嘌呤、赤霉酸有轻微的吸附作用;GCB对4种目标化合物均有较强的吸附作用。由于PSA主要作用力是极性相互作用及弱离子交换作用,可以有效去除样品中有机酸、脂肪酸等干扰物,C18具有强非极性作用,对极性较弱的脂肪酸、烯烃类、色素等大分子基质干扰物有较好的吸附效果。所以本实验在综合考量下,选用PSA+C18作为吸附剂并做了进一步的考察。实验表明,当PSA使用量为50 mg,C18使用量为100 mg时,4种植物生长调节剂回收率均大于80%,故本实验最终选定50 mgPSA+100 mgC18为净化吸附剂。
2.5线性关系、检出限和定量限
为了降低待测物的基质效应,提高定量的准确性,本实验采用空白基质添加不同浓度的目标化合物配成标准溶液,线性范围、曲线方程见表2,由表2可以看出,这4种目标化合物的线性关系良好,相关系数基本在0.9990以上,保证了定量的可靠性。4种目标化合物的方法检出限(LOD)和定量限(LOQ)依照S/N=3,S/N=10的原则结合样品前处理的稀释倍数推算。

表2 目标化合物的线性范围、线性方程、相关系数、方法检出限和定量限
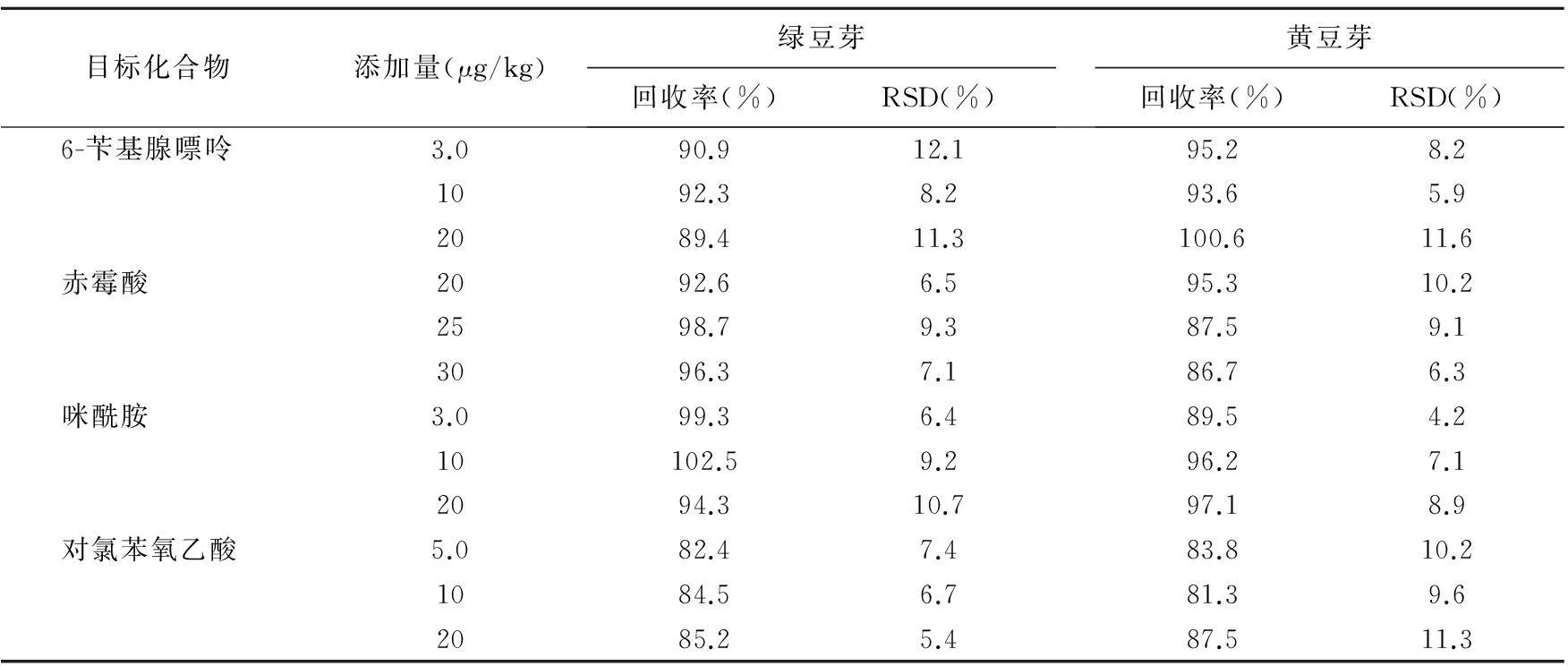
表3 回收率和精密度测定结果(n=6)
2.6方法回收率与精密度
本实验分别选用了绿豆芽、黄豆芽进行了3个水平浓度的添加回收实验,6次平行实验的结果如表3。4种目标化合物的回收率范围为81.3%-102.5%,RSD范围在4.2%-12.1%之间,根据标准GB/T 27404-2008附表规定,当待测组分含量小于0.1 mg/kg时,回收率的参考范围为60%-120%,故本方法的准确性和精密度均符合标准要求。
3小结与讨论
现有资料表明,国内外关于豆芽中生长调节剂残留量的测定项目比较单一,方法集中在气相色谱法、液相色谱法、气相色谱-质谱法、液相色谱-质谱法等。其中,气相色谱法、气相-质谱法灵敏度高,但前处理通常需衍生反应,操作繁琐费时,不适用于大批样品的检测;液相色谱法灵敏度较低,选择性较差,易出现假阳性(陈卫军等,2012)。这些不足大大降低了豆芽中植物生长调节剂的检测效率,给市场监管带来种种不便。而液相色谱-质谱法前处理无需衍生,一针进样,可同时检测豆芽中4种植物生长调节剂,周期较短,选择性好,精密度高,在豆芽中植物生长调节剂残留检测上的优势显而易见。
QuEChERS提取方法是今年来国际上最新发展起来的一种快速样品前处理技术,本实验将其运用于豆芽中4种植物生长调节剂残留检测的前处理,与传统的溶剂提取-SPE净化方法相比,该方法大大降低了检测成本且减少了有机溶剂的使用,更加经济快捷安全。
本实验建立了以PSA和C18进行QuEChERS净化,4000Q在ESI正负模式切换下同时测定豆芽中4种植物生长调节剂残留的方法。优化了样品的提取和净化等前处理步骤以及色谱质谱条件,考察了方法检出限、回收率、精密度等方法学指标。结果表明,该方法操作简单,效率快捷,灵敏度高,选择性强、回收率良好,完全满足检测豆芽中6-苄基腺嘌呤,赤霉酸,对氯苯氧乙酸,咪酰胺残留的要求。
致谢:
本研究得到徐敦明研究员的大力支持和指导,特此致谢!
参考文献
陈卫军,张耀海,李云成,赵其阳,焦必宁.2012.果蔬中常用植物生长调节剂分析方法研究进展.食品科学,33(11):283-289.
常宇文,吴晓宗,李伟,郝莉花.2007.凝胶渗透色谱-气相色谱法测定豆芽中2,4-二氯苯氧乙酸残留量.食品工业科技,28(12):203-205.
黄何何,张缙,徐敦明,周昱,罗佳,吕美玲,陈树宾,王连珠.2014.QuEChERS-高效液相色谱-串联质谱法同时测定水果中21种植物生长调节剂的残留量.色谱,32(7):707-716.
孔志强,董丰收,刘新刚,徐军,龚勇,单炜力,郑永权.2012.超高效液相色谱-串联质谱法测定柑橘及柑橘精油中4种农药残留.分析化学,40(3):474-477.
刘春生,罗海英,冼燕萍,王斌,王莉,罗东辉,郭新东.2014.超高效液相色谱-串联质谱法测定豆芽中7种药物残留.质谱学报,35(4):302-310.
林黛琴,万承波,王婷婷.2013.高效液相色谱-串联质谱测定豆芽中6-苄基腺嘌呤方法的研究.江西化工,(3):99-103.
柳菡,吴斌,殷耀,许蔚,桂茜雯,余可垚,龚玉霞,赵增运,林宏,沈伟健,沈崇钰,张睿.2013.高效液相色谱-串联质谱法测定芽苗类蔬菜及其来源豆类中4种非法添加物的残留量.色谱,31(1):22-26.
唐莉娟,万益群.2009.植物激素的分析研究进展.食品科学,30(21):393-398.
王璐,吴倩,段春凤,吴大朋,关亚风.2011.基质固相分散萃取-高效液相色谱-串联质谱法分析拟南芥中的赤霉素.色谱,29(9):923-926.
夏慧,陆自强,杨益众.2011.高效液相色谱法测定豆芽中2,4-二氯苯氧乙酸残留.扬州大学学报:农业与生命科学版,32(4):86-89.
Ma LY,Zhang HY,Xu WT,He XY.2013.Simultaneous determination of 15 plant growth regulators in bean sprout and tomato with liquid chromatography-triple quadrupole tandem mass spectrometry.Food Analytical Methods,6(3):941-951.
Zhang FZ,Zhao PY,Shan WL,Gong L,Jian Q,Pang CP.2012.Development of a method for the analysis of our plant growth regulators (PGRs) residues in soybean sprouts and mung bean sprouts by liquid chromatography-tandem mass spectrometry.Bulletin of Environmental Contamination and Toxicology,89(3):674-679.
(责任编辑:陈晓雯)
魏一婷.2015.HPLC-MS-MS正负离子切换测定豆芽中4种植物生长调节剂残留量.武夷科学,31:190-196.
Determination of 4 kinds of plant growth regulator residues in bean sprouts by
positive and negative ion switch of HPLC-MS-MS
Yi-Ting WEI
(InspectionandQuarantineTechnologyCenter,XiamenEntry-ExitInspection
andQuarantineBureau,Xiamen,Fujian361100,China)
Abstract:A method was developed for the simultaneous detection of 4 plant growth regulator residues in bean sprouts by positive and negative ion of HPLC-MS-MS. The samples added by a small amount of Sodium sulfate were extracted with Acetonitrile containing 1% Acetic acid (V/V), and purified with QuEChERS (PSA+C18). By the ion source of ESI, the positive and negative ion switch was detected, the retention time and the characteristic ion pair were qualitative, and the external standard method was quantitative. The results showed that the calibration curves of 4 kinds of materials tested were good linearity in the range of 10-200 μg/L, and the correlation coefficients of quantitative ion pair were more than 0.9990. The method quantitative limit (S/N=10) of Gibberellin was 20 μg/kg, the other three were 2.5-5.0 μg/kg, and the average recoveries were 81.3%-102.5%. In this paper, a method for simultaneous detection of 4 plant growth regulator residues by positive and negative ion switch in the Liquid tandem mass spectrometer can be used for the simultaneous determination of a needle into the samples. The method is simple and effective,which can meet the requirements for the determination of 4 plant growth regulator residues in bean sprouts.
Key words:bean sprout; high performance liquid chromatography-tandem mass spectrometry (HPLC-MS-MS); plant growth regulators
中图分类号:O657.63;TS255.7
文献标识码:A
文章编号:1001-4276-(2015)01-0190-07
作者简介:魏一婷(1986-),女,学士。研究方向:食品安全检测。Email:270607045@qq.com。
收稿日期:2015-09-09; 发表日期:2015-10-31
