预防性应用抗菌药物后肠道菌群失调及其危险因素分析
2015-02-23佘勇
佘 勇
预防性应用抗菌药物后肠道菌群失调及其危险因素分析
佘 勇
目的 探讨预防性应用抗菌药物后肠道菌群失调及其危险因素,为临床合理使用抗菌药物提供依据。方法 连续收集我院2012年2月至2014年2月收治的112例预防性应用抗菌药物患者的资料,根据是否出现肠道菌群失调分为肠道菌群失调组(58例)和非失调组(54例),对预防性应用抗菌药物患者发生肠道菌群失调的危险因素进行筛选。结果 非失调组患者术前应用抗菌药物时间和术中、术后抗菌药物持续应用时间均显著短于失调组,差异均有统计学意义(P<0.05);应用抗菌药物种类两组比较,差异有统计学意义(P<0.05),非失调组联合应用2种或3种抗菌药物的例数显著少于失调组,非失调组应用青霉素类和氨基糖苷类的比例显著高于失调组。非失调组患者营养不良、肠功能障碍比例和肠外营养天数均显著低于失调组,差异均有统计学意义(P<0.05)。两组患者肠道菌群失调情况的比较,差异无统计学意义(P>0.05),两组均以大肠埃希菌、肠球菌和金黄色葡萄球菌失调比例为多。结论 影响预防性应用抗菌药物后肠道菌群失调的可能危险因素有术前应用抗菌药物时间和术中、术后抗菌药物持续应用时间、应用抗菌药物种类、营养不良、肠功能障碍比例和肠外营养天数。
预防性;抗菌药物;肠道菌群;失调;危险因素
0 引言
随着医学技术的不断发展,各类手术指征越来越宽松,手术治疗在临床上的应用范围越来越广。为了预防手术部位感染,临床通常使用抗菌药物进行预防性治疗,以保证手术切口暴露时,局部组织中可达到杀灭术中入侵细菌的药物浓度[1]。预防性应用抗菌药物是在患者具备明确指征下,选择合适的抗菌药物,给予适当的剂量和疗程,达到消灭体内致病微生物及控制感染的作用,有利于患者免疫力的增强,且可预防各种不良反应[2]。如未能控制抗菌药物的使用剂量及疗程,可导致患者出现肠道菌群失调,诱发产生腹泻,对患者预后产生严重不良影响。本研究中,为探讨预防性应用抗菌药物后肠道菌群失调及其危险因素,对我院2012-2014年收治的112例患者的临床资料进行分析,现将结果报道如下。
1 资料与方法
1.1 一般资料 连续收集我院2012年2月至2014年2月收治的112例预防性应用抗菌药物患者的资料,根据是否出现肠道菌群失调分为肠道菌群失调组(58例)和非失调组(54例),肠道菌群失调的标准:出现明显的肠道菌群失调表现,如腹痛、腹泻、腹部不适等;粪便镜检球/杆菌比倒置;粪便菌群涂片,细菌总数减少。排除标准:发热、合并急慢性肠炎、结肠炎等消化道疾病患者;治疗前出现肠道菌群失调患者;对青霉素、磺胺类等抗菌药物过敏、合并肝肾等器官严重损害患者。该研究取得我院伦理委员会通过及患者、家属的知情同意权。
1.2 方法 分析两组患者的临床资料,观察患者出现肠道菌群失调的具体情况,筛选诱发肠道菌群失调的相关危险因素。
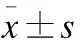
2 结果
2.1 两组患者基线资料的比较 两组患者的性别、年龄、手术类型(微创手术和开放手术)、手术时间、切口感染、合并疾病(糖尿病和慢性胃肠疾病)的比例比较,差异均无统计学意义(P>0.05)。见表1。

表1 两组患者基线资料比较(例,%)
2.2 两组患者抗菌药物应用情况的比较 非失调组患者术前应用抗菌药物时间和术中、术后抗菌药物持续应用时间均显著短于失调组,差异均有统计学意义(P<0.05);两组应用抗菌药物种类比较,差异有统计学意义(P<0.05),非失调组联合应用2种或3种抗菌药物的例数少于失调组,非失调组应用青霉素类和氨基糖苷类的比例显著高于失调组。非失调组患者营养不良、肠功能障碍比例和肠外营养天数均显著低于失调组,差异均有统计学意义(P<0.05)。见表2。

表2 两组患者抗菌药物应用情况的比较(例,%)
2.3 两组患者肠道菌群失调情况的比较 两组患者肠道菌群失调情况的比较,差异无统计学意义(P>0.05),两组均以大肠埃希菌、肠球菌和金黄色葡萄球菌失调比例为多。见表3。

表3 两组患者肠道菌群失调情况的比较(例,%)
3 讨论
预防性应用抗菌药物可以有效抑制病原菌入侵体内引起感染,但长期预防用药可能无法达到治疗目的,且引起机体菌群失调[2-3]。相关研究结果表明,长期、大量应用广谱抗菌药物,可有效杀灭敏感致病菌,同时也消灭了部分肠道常驻菌,且机体潜在的耐药性使得病菌繁殖迅速,引起肠道菌群失调[3-5]。本研究中,通过对预防性应用抗菌药物患者临床资料的分析得出,患者出现肠道菌群失调的危险因素主要为术前应用抗菌药物时间和术中、术后抗菌药物持续应用时间、应用抗菌药物种类、营养不良、肠功能障碍比例和肠外营养天数。
患者营养状态与疾病的预后具有密切联系,营养不良患者在进行手术治疗时感染率、输血量、住院时间及围术期病死率及恢复时间显著增加,且营养不良可造成肠道黏膜萎缩,使其分泌的免疫球蛋白A数量减少,导致肠道菌群失调的发生率上升明显[6-8]。肠功能障碍主要包括腹泻、腹胀、麻痹性肠梗阻、中毒性鼓肠等,肠功能障碍与患者出现肠道菌群失调具有密切相关性,是引起肠道菌群失调的独立危险因素,但是目前学界对这一因素的研究尚不完全,有待更深层次的探讨[9-11]。抗菌药物使用时间的增长可导致患者肠道菌群失调的风险逐渐上升,对有潜在感染风险或已经感染的患者,在使用抗菌药物时,需考虑抗菌药物的使用种类及致病菌的耐药性等情况,同时需考虑使用时间,切忌滥用抗菌药物,在使用时,需严格控制范围、用量及时间。经锁骨静脉、颈内静脉等进行的肠外营养支持可保证患者营养的摄入,但是患者可能出现置管错位,导致并发感染,使得肠内菌群出现失调[12-13]。
由于抗菌药物直接作用于微生物,对肠道平衡产生突出影响,所以,其长期、大量应用可诱发急性腹泻。大量临床实践表明,抗菌药物在肠道内的浓度虽然较低,但是其对肠道厌氧菌及需氧菌的抑制作用较强;部分头孢类抗菌药物在肠道中的浓度较高,其对肠道菌的抑制作用也较强[14]。抗菌药物在临床中的广泛使用,可引起肠道敏感菌株受到致命的伤害,加上患者因免疫力低下等因素造成乳酸杆菌、双歧杆菌等生理性细菌出现不同程度的减少,肠道菌群的稳定性下降,这些因素使得预防性应用抗菌药物患者出现腹泻等肠道菌群失调的现象更为突出[15]。本研究中,两组患者肠道菌群失调情况比较,差异无统计学意义,两组均以大肠埃希菌、肠球菌和金黄色葡萄球菌失调比例为多。提示肠道菌群失调患者体内致病菌显著增多,有益于身体健康的菌群显著减少。因此,在临床长期使用抗菌药物时,需对患者进行肠道菌群的监测。 综上所述,术前应用抗菌药物时间和术中、术后抗菌药物持续应用时间、应用抗菌药物种类、营养不良及肠功能障碍比例和肠外营养天数可能是造成预防性应用抗菌药物患者肠道菌群失调的重要危险因素,因此,在临床预见性应用抗菌药物的过程中,需对患者营养状态及肠道功能进行评估,尽量减少抗菌药物及肠外营养支持的时间,以降低患者出现肠道菌群失调的概率。
[1]孙辉.老年患者脑膜瘤术后应用头孢曲松他唑巴坦钠不同时间的效果对比[J].中国老年学杂志,2013,33(17):4162-4163.
[2]童荔,杨志勤,易小猛,等.肝移植术后肠道菌群失调及其危险因素分析[J].中华临床医师杂志(电子版),2014,6(5):868-872.
[3]李扬扬,李艳艳,陈彩琴,等.微生态肠内营养在胃大部切除术后的应用观察[J].中华实验外科杂志,2014,31(2):449.
[4]刘璐,吴媛媛,李满祥.生命早期肠道菌群失调与支气管哮喘[J].中华肺部疾病杂志(电子版),2014,7(2):77-79.
[5]武娜,刘玉兰,朱元民.结直肠癌患者肠道微生物多样性的研究进展[J].中华临床医师杂志(电子版),2014,5(22):4069-4072.
[6]《中华消化杂志》编委会.肠道菌群失调诊断治疗建议[J].中华消化杂志,2009,29(5):335-337.
[7]Zhdanov KV,Gusev DA,Zakharenko SM,et al.Intestinal dysbiosis in liver cirrhosis[J].Eksp Klin Gastroenterol,2011(6):38-44.
[8]杨兵,付雪琼,彭颂兴,等.益生菌预防抗生素相关性菌群失调的临床研究[J].临床医药实践,2014,23(9):658-660.
[9]伍颖君.不同术前肠道准备对结直肠癌术后肠道菌群变化的影响[D].广东:南方医科大学,2012.
[10]刘绍泽.广谱抗生素压力下脓毒症大鼠肠道菌群变化及耐药基因播散的实验研究[D].上海:第二军医大学,2010.
[11]袁芝琼.两种常用抗生素对小鼠肠道微生态影响的研究[D].云南:大理学院,2013.
[12]李凯,谭永刚,李午生,等.双歧杆菌预防化疗后肠道菌群失调症的临床研究[J].微生物学杂志,2011,31(1):82-84.
[13]闫瑶,金美兰,周磊,等.砂仁对抗生素所致肠道菌群失调小鼠调节作用的探讨[J].中国微生态学杂志,2013,25(9):1040-1043.
[14]李丹,任爱民,王红,等.中药复方通腑颗粒对抗生素相关性肠炎大鼠肠黏膜微生态屏障损伤的保护作用[J].首都医科大学学报,2012,33(3):315-521.
[15]Aryayev M,Kukushkin V,Kozhevin R,et al.Antibiotic-associated diarrhea in children: clinical and epidemiological features[J].Acta Paediat,2009,98(46):172-173.
Analysis of intestinal flora imbalance after prophylactic antibiotics use and the risk factors
SHE Yong
(Department of General Surgery,Renhuai People′s Hospital of Guizhou Province,Guizhou 564500,China)
Objective To study the intestinal flora imbalance after prophylactic antibiotics use and the related risk factors,provide reference for clinical rational use of antibiotics.Methods A total of 112 patients with prophylactic antibiotics application from February 2012 to February 2014 were divided into the intestinal flora imbalance group (group I,n=58) and non-imbalance group (group N,n=54),then the differences of the related risk factors were compared.Results The time of antibiotics use before operation and the duration of antibiotics during and after operation in group N was less than that of group I (P<0.05).There were significant differences in the types of antibiotics between the two groups (P<0.05). The number of patients with combination use of two or three types of antibiotics in group N was less than that of group I,and the incidents of penicillins and aminoglycosides in group N were higher. The incidences of poor nutrition,intestinal dysfunction proportion and the time of parenteral nutrition in group N were lower than that of group I (P<0.05). there was no significant difference in intestinal flora imbalance between the two groups (P>0.05). Conclusion The probable risk factors to intestinal flora imbalance were time of antibiotics before operation and duration of antibiotics during and after operation,antibiotics types,proporton of poor nutrition and intestinal dysfunction and the time of parenteral nutrition.
Prophylactic; Antibiotic; Intestinal flora; Imbalance; Risk factors
2015-01-04
贵州省仁怀市人民医院外一科,贵州 仁怀 564500
湖北省自然科学基金(2012FFBO1905)
10.14053/j.cnki.ppcr.201507014
