氯诺昔康与盐酸昂丹司琼在静脉镇痛泵中的配伍相容性研究
2015-02-23陆连英陈富超徐传念杨兴明时晓亚
陆连英,陈富超,徐传念,杨兴明,时晓亚
氯诺昔康与盐酸昂丹司琼在静脉镇痛泵中的配伍相容性研究
陆连英,陈富超,徐传念,杨兴明,时晓亚*
目的 考察氯诺昔康与盐酸昂丹司琼在0.9%氯化钠注射液中的配伍相容性。方法 采用HPLC法测定配伍液中氯诺昔康与盐酸昂丹司琼的含量,分别于0、2、4、8、24、48、72 h时间点观察配伍液是否出现沉淀、浑浊及颜色变化,同时测定配伍液pH值变化。结果 配伍液中氯诺昔康含量未见明显变化,盐酸昂丹司琼含量随时间延长逐渐降低,在2 h时含量低于90%,且出现少量絮状沉淀。结论 在室温条件下,氯诺昔康与盐酸昂丹司琼在0.9%氯化钠注射液中不稳定,临床不宜混合用于术后镇痛。
氯诺昔康;盐酸昂丹司琼;配伍;稳定性;高效液相色谱法
0 引言
氯诺昔康为非甾体抗炎镇痛药,通过选择性抑制环氧化酶-2活性而达到抗炎、镇痛作用[1]。目前,氯诺昔康通过肌注、静脉滴注或患者自控镇痛用于术后疼痛的治疗,临床应用广泛,其不良反应主要是胃肠道反应、凝血及肾毒性[2-4]。盐酸昂丹司琼是高度选择性的5-羟色胺3(5-HT3)受体拮抗剂,具有强镇吐作用,研究证实,盐酸昂丹司琼对预防化疗、放疗、术后的恶心呕吐(PONV)与防治阿片类镇痛药物引起的恶心呕吐有良好效果。有报道,将氯诺昔康与盐酸昂丹司琼联合应用于术后静脉自控镇痛(PCA),镇痛效果良好,且术后恶心呕吐的发生减少[5]。但将氯诺昔康与盐酸昂丹司琼联合用于术后自控镇痛24~48 h,两药在镇痛泵中是否稳定,未见相关文献报道。因此,本文采用HPLC法对氯诺昔康与盐酸昂丹司琼在自控镇痛泵中的配伍相容性进行了考察,报道如下。
1 仪器与试剂
1.1 仪器 美国戴安Ultimate 3000高效液相色谱仪,包括四元低压梯度泵、二极管阵列检测器、变色龙色谱工作站;上海雷磁PHSJ-4A型酸度计;梅特勒MS105DU电子分析天平。
1.2 药品与试剂 氯诺昔康对照品(中国药品生物制品检定所,批号:100663-200501,纯度:99.5%);盐酸昂丹司琼对照品(中国药品生物制品检定所,批号:100559-200301,纯度:99.3%);注射用氯诺昔康(8 mg/瓶,浙江震元制药有限公司,批号:14062626);盐酸昂丹司琼注射液(8 mg/4 mL,齐鲁制药有限公司,批号:30300916H);氯化钠注射液(0.9 g/100 mL,湖南科伦制药有限公司,批号:F140123D);乙腈为色谱纯;磷酸二氢钾(南京化学试剂有限公司);水为已滤纯化水;其他试剂均为分析纯。
2 方法
2.1 氯诺昔康与盐酸昂丹司琼静脉镇痛液的配制 依据文献[5]中氯诺昔康与盐酸昂丹司琼静脉自控镇痛用药方案,取注射用氯诺昔康8支(64 mg),分别用2 mL注射用水稀释溶解,另取盐酸昂丹司琼注射液1支(8 mg),用一次性注射器吸取上述溶液于一次性镇痛泵输液袋内,以0.9%氯化钠注射液为溶媒稀释至刻度,摇匀,在室温[(25±1)℃]下避光放置,即可。
2.2 氯诺昔康与盐酸昂丹司琼镇痛配伍液的稳定性考察 在0、2、4、8、24、48、72 h时间点,取氯诺昔康与盐酸昂丹司琼镇痛配伍液适量,以0.9%氯化钠注射液作对照,观察是否有颜色变化、沉淀、浑浊、气体产生,并测定配伍液的pH值,同时应用HPLC法测定配伍液中药物的含量,以配制即刻氯诺昔康与盐酸昂丹司琼的含量为100%,计算其他各时间点的相对百分含量。
2.3 含量测定
2.3.1 标准储备液的制备 分别取氯诺昔康与盐酸昂丹司琼对照品适量,精密称定,加流动相(乙腈-0.05 mol/L磷酸二氢钾水溶液)溶解并稀释制成1.2 mg/mL的氯诺昔康与0.2 mg/mL盐酸昂丹司琼对照品储备液,置冰箱中冷藏备用。
2.3.2 供试品溶液的制备 分别在“2.2”项下各时间点,取配伍液10 mL,用0.45 μm微孔滤膜过滤,弃去初滤液,取续滤液2.0 mL,置10 mL棕色量瓶中,用流动相稀释至刻度,摇匀,即为含量测定的供试品溶液。
2.3.3 色谱条件与系统适用性试验 采用phenomenex Luna C18(250 mm×4.6 mm,5 μm)色谱柱,以乙腈-0.05 mol/L磷酸二氢钾水溶液(33∶67)为流动相,流速:0.8 mL/min;柱温:30 ℃,进样体积:20 μL,紫外检测波长:380 nm (氯诺昔康)、306 nm(盐酸昂丹司琼)。
2.3.4 标准曲线的建立 精密吸取氯诺昔康(1.2 mg/mL)与盐酸昂丹司琼(0.2 mg/mL)对照品储备液0.2、0.5、1.0、1.5、2.0、2.5 mL置10 mL棕色量瓶中,并加流动相至刻度,摇匀,在上述色谱条件下分别进样测定,记录色谱峰面积,以浓度(C)对色谱峰面积(Y)进行线性回归。
2.3.5 精密度试验 取“2.3.4项”下氯诺昔康(120.0 μg/mL)与盐酸昂丹司琼(20.0 μg/mL)对照品溶液各20 μL,在上述色谱条件下分别进样测定,记录峰面积,重复测定6次,计算相对标准偏差(RSD),考察仪器精密度。
2.3.6 供试品溶液稳定性试验 按照“2.3.2”项下溶液制备方法,配制含氯诺昔康与盐酸昂丹司琼供试品的溶液,在室温条件下,分别在0、2、4、8、24、48、72 h时间点进样测定,记录色谱峰面积,计算药物含量,考察供试品溶液在72 h内的稳定性。
2.3.7 回收率试验 分别精密称取氯诺昔康与盐酸昂丹司琼对照品适量,以氯化钠注射液为溶媒,配制高、中、低不同浓度的氯诺昔康与盐酸昂丹司琼配伍溶液,按供试品溶液制备方法配制样品溶液,进样20 μL测定,记录色谱峰面积,采用外标法计算药物含量,考察氯诺昔康与盐酸昂丹司琼的回收率。
3 结果
3.1 系统适应性试验结果 在上述色谱条件下,氯诺昔康与盐酸昂丹司琼色谱峰理论塔板数均>3 000,保留时间分别为7.6、10.2 min,未见明显杂质峰出现,分离度>1.5,色谱图见图1。

图1 HPLC色谱图
3.2 标准曲线与方法的精密度 氯诺昔康的线性回归方程:Y=0.701 0 C+0.510 4,r=0.999 1,线性范围:24.0~750.0 μg/mL;盐酸昂丹司琼的线性回归方程:Y=2.170 4 C-6.575 0,r=0.999 4,线性范围:2.0~50.0 μg/mL。精密度试验结果,氯诺昔康与盐酸昂丹司琼峰面积的RSD分别为1.46%、1.25%。
3.3 样品稳定性及回收率试验结果 样品稳定性结果表明,配制的样品溶液在72.0 h内保持稳定。加样回收率试验结果见表1。
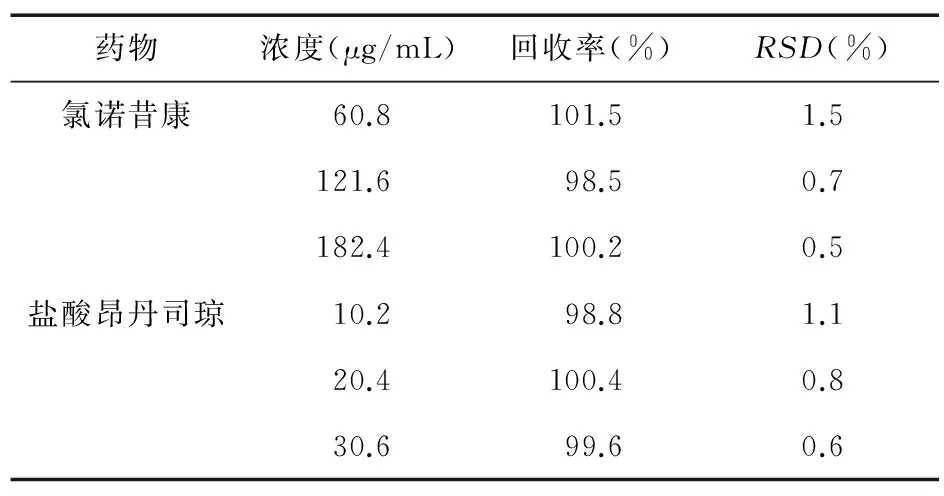
表1 氯诺昔康与盐酸昂丹司琼的回收率结果
3.4 配伍稳定性试验结果 配伍液在测定初期为淡黄色液体,未见变色、沉淀、浑浊,无气泡产生。但随着时间延长,溶液即出现少量絮状沉淀,且随时间变化逐渐增多;经含量测定,配伍液中氯诺昔康含量未见明显变化,而盐酸昂丹司琼含量逐渐降低,配伍液在不同时间点相对百分含量、pH值及外观结果见表2。

表2 氯诺昔康与盐酸昂丹司琼配伍液稳定性试验结果
4 讨论
PONV是手术麻醉及术后的常见并发症,患者的年龄、性别、麻醉方法与药物、手术部位和手术方法等均可引发PONV。目前广泛应用的PCA是导致PONV的主要原因,术后PCA镇痛药物可加重PONV的发生。目前,临床上将昂丹司琼、氟哌利多、甲氧氯普胺等药物与镇痛药同时经PCA给药用于术后镇痛及预防术后PONV的发生[6]。但是,将不同药物联合使用,由于药物性质不同,会出现水解、氧化还原、沉淀、气体产生等一系列物理化学反应。因此,需要对配伍液在输液中的稳定性进行研究,这是医院药学的重要研究内容,也是保障临床配伍用药安全的重要途径。
目前,课题组对氯诺昔康PCA配伍液的稳定性进行了研究,已发现氯诺昔康与芬太尼[7]、氟哌利多[8]、盐酸氯胺酮[9]、甲磺酸罗哌卡因[10]、酒石酸布托啡诺[11]等在镇痛泵中均不稳定。为保障临床用药安全,本文采用HPLC法对氯诺昔康与盐酸昂丹司琼在PCA泵中的稳定性进行研究,本研究结果显示:在室温条件下,配伍液中氯诺昔康含量与pH值在72 h内无明显变化,而盐酸昂丹司琼的含量随时间变化逐渐降低,且配伍液在2 h即出现少量絮状沉淀,沉淀随时间变化逐渐增多。据文献与说明书资料,盐酸昂丹司琼注射液在酸性溶液中(pH 4.0~5.5)中较稳定,而氯诺昔康与盐酸昂丹司琼镇痛配伍液的pH值为碱性,配伍液析出絮状沉淀可能为盐酸昂丹司琼的溶解度降低所致。
综合配伍试验各项结果,氯诺昔康与盐酸昂丹司琼镇痛配伍液在0.9%氯化钠注射液中不稳定,临床应避免将其配伍用于术后自控镇痛。
[1]方宝霞,陈富超,李鹏,等.氯诺昔康静脉联合用药在术后镇痛中的应用及评价[J].中国医院用药评价与分析杂志,2011,11(8):684-686.
[2]朱军,陈富超,方宝霞,等.注射用头孢噻肟钠与注射用氯诺昔康的配伍稳定性研究[J].中国医药,2012,7 (10):1319-1320.
[3]方宝霞,陈富超,时晓亚,等.高效液相色谱法考察注射用头孢呋辛钠与注射用氯诺昔康的配伍稳定性[J].中国医药,2012,7(2):175-176.
[4]方宝霞,丁洁,陈富超,等.注射用氯诺昔康在不同pH 值氯化钠注射液中的稳定性考察[J].实用药物与临床,2011,14(6):494-495.
[5]刘艳.氯诺昔康和芬太尼用于胸外科患者术后镇痛的效果比较[J].中国医师进修杂志,2012,35(30):66-67.
[6]吴新民,罗爱伦,田玉科,等.术后恶心呕吐防治专家意见(2012)[J].临床麻醉学杂志,2012,28(4):41-43.
[7]陈富超,张滔,方宝霞,等.注射用氯诺昔康与芬太尼注射液配伍稳定性考察[J].医药导报,2011,30(9):335-336.
[8]陈富超,李鹏,方宝霞,等.注射用氯诺昔康与氟哌利多注射液配伍稳定性研究[J].中国医药,2011,6(3):335-336.
[9]方宝霞,陈富超,时晓亚,等.注射用氯诺昔康与盐酸氯胺酮注射液在0.9%氯化钠注射液中的稳定性研究[J].中国药师,2011,14(6):539-540.
[10]方宝霞,陈富超,李鹏,等.注射用氯诺昔康与甲磺酸罗哌卡因注射液配伍相容性研究[J].中南药学,2012,10(10):749-752.
[11]方宝霞,朱军,陈富超,等.酒石酸布托啡诺与氯诺昔康在静脉镇痛泵中的配伍稳定性研究[J].中南药学,2013,11(10):732-735.
Physico-chemical stability of lornoxicam with ondansetron hydrochloride in patient controlled analgesia solution
LU Lian-ying,CHEN Fu-chao,XU Chuan-nian,YANG Xing-ming,SHI Xiao-ya*
(Department of Pharmacy,Dongfeng Hospital,Hubei University of Medicine,Shiyan 442008,China)
Objective To study the physico-chemical stability of lornoxicam with ondansetron hydrochloride in 0.9% sodium chloride injection.Methods The contents of lornoxicam and ondansetron hydrochloride in mixture solution were determined by HPLC.Solutions were visually inspected for precipitation,cloudiness,and discoloration at 0,2,4,8,24,48 and 72 h after compatibility.The changes in pH value of the mixture were recorded.Results No significant difference was found in the pH value and contents of lornoxicam,but the contents of ondansetron hydrochloride declined (<90%) with appearance of precipitation at the time point of 2 h.Conclusion The mixture of lornoxicam with ondansetron hydrochloride in 0.9% sodium chloride injection is unstable,and the clinical application for patient controlled analgesia should be avoided.
Lornoxicam; Ondansetron hydrochloride; Compatibility; Stability; HPLC
2014-10-14
湖北医药学院附属东风医院药学部,湖北 十堰 442008
十堰市科学技术研究与开发计划项目(2010st45)
10.14053/j.cnki.ppcr.201507019
*通信作者
