远程缺血预处理对大鼠脊髓缺血再灌注损伤后脑源性神经营养因子表达的影响
2015-02-22仝淞铭于德水王岩松魏子健
仝淞铭,曹 阳,于德水,王岩松,魏子健
·论著·
远程缺血预处理对大鼠脊髓缺血再灌注损伤后脑源性神经营养因子表达的影响
仝淞铭,曹 阳,于德水,王岩松,魏子健
目的 研究远程缺血预处理(RIPC)对大鼠脊髓缺血再灌注损伤(SCII)后脑源性神经营养因子(BDNF)表达的影响。方法 2014年5—11月,将88只雄性SD大鼠按照随机数字表法分为假手术组(Sham组,n=8)、缺血再灌注组(I/R组,n=40)和RIPC组(n=40)。I/R组及RIPC组分别设再灌注0、6、12、24、72 h 5个观察时间点(分别记为1a组~1e组、2a组~2e组),每个时间点8只大鼠。Sham组大鼠只分离肾动脉下腹主动脉,但不阻断;I/R组大鼠采用Zivin法建立SCII模型;RIPC组大鼠双下肢用驱血带短暂缺血10 min,放开10 min,重复2次,30 min后用Zivin法建立SCII模型。取材,苏木素-伊红(HE)染色观察脊髓病理变化,免疫组化法检测BDNF阳性表达细胞数,原位细胞凋亡(TUNEL)法检测细胞凋亡情况,Western blotting法检测BDNF表达水平,并进行大鼠后肢运动功能(BBB)评分。结果 Sham组脊髓未见明显病理学改变,I/R组脊髓病理学改变明显,RIPC组各时间点脊髓病理学改变均较I/R组轻。1a组~1e组、2a组~2e组BDNF阳性表达细胞数、BDNF表达水平均高于Sham组(P<0.05);1a组~1e组、2a组~2e组BBB评分均低于Sham组(P<0.05);1a组~1e组、2b组~2e组TUNEL阳性表达细胞数均高于Sham组(P<0.05);2b组~2e组BDNF阳性表达细胞数分别高于1b组~1e组(P<0.05);2a组~2e组BDNF表达水平、BBB评分分别高于1a组~1e组(P<0.05);2a组~2e组TUNEL阳性表达细胞数分别低于1a组~1e组(P<0.05);1b组~1e组BDNF阳性表达细胞数、TUNEL阳性表达细胞数、BDNF表达水平、BBB评分均高于1a组(P<0.05);2b组~2e组BDNF阳性表达细胞数、TUNEL阳性表达细胞数、BDNF表达水平、BBB评分均高于2a组(P<0.05)。结论 RIPC可增加大鼠SCII后BDNF的表达水平,并可能通过增加BDNF的表达水平来达到脊髓保护作用。
再灌注损伤;缺血预处理;脑源性神经营养因子;细胞凋亡
仝淞铭,曹阳,于德水,等.远程缺血预处理对大鼠脊髓缺血再灌注损伤后脑源性神经营养因子表达的影响[J].中国全科医学,2015,18(21):2548-2554.[www.chinagp.net]
Tong SM,Cao Y,Yu DS,et al.Effect of remote ischemic preconditioning on the expression of brain-derived neurotrophic factor in rats with spinal cord ischemia-reperfusion injury[J].Chinese General Practice,2015,18(21):2548-2554.
Przyklenk等[1]最先提出远程缺血预处理(remote ischemic preconditioning,RIPC)的概念,这种预处理方法被证实可有效减轻脑、脊髓、肝脏及肾脏的缺血再灌注损伤,但RIPC减轻脊髓损伤的具体机制尚不十分明确。大量研究表明,RIPC主要通过维持和改善能量代谢、改善微循环、减少自由基产生、抑制炎性因子的激活、抑制细胞凋亡、增强自噬、诱导内源性保护物质的释放等对远隔器官起保护作用[2-5]。脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)作为神经营养因子家族成员的一种,广泛分布于中枢神经系统,在中枢神经系统发育过程中对神经元的生长、分化和维持其正常的生理功能起关键作用[6]。本实验通过观察RIPC对大鼠脊髓缺血再灌注损伤(spinal cord ischemia-reperfusion injury,SCII)后BDNF表达水平的影响,研究其脊髓保护的可能机制。
1 材料与方法
1.1 实验材料 健康成年雄性SD大鼠88只,体质量(250±20)g,由辽宁医学院动物实验中心提供。兔抗鼠BDNF抗体购自Santa Cruze公司(美国),山羊抗兔IgG二抗、PV9001通用型Polymer Kit试剂盒、二氨基联苯胺(DAB)试剂盒购自北京中杉金桥生物技术有限公司,原位细胞凋亡(TUNEL)试剂盒购自Roche公司(美国),电子显微镜购自Olympus(日本),切片机购自Leica(德国)。
1.2 实验方法
1.2.1 实验动物与分组 2014年5—11月,将雄性SD大鼠按照随机数字表法分为假手术组(Sham组,n=8)、缺血再灌注组(I/R组,n=40)和RIPC组(n=40)。I/R组及RIPC组分别设再灌注0、6、12、24、72 h 5个
本研究创新点:
目前关于脑源性神经营养因子(BDNF)的研究主要着重于脑组织,但其在脊髓组织内也有表达。本文通过脊髓缺血再灌注损伤模型来观察BDNF的变化,同时研究在远程缺血预处理情况下BDNF的表达情况。关于远程缺血预处理的保护作用机制的研究很多,但其保护作用的具体机制尚不十分明确,本文通过将BDNF表达及细胞凋亡情况联系起来来研究其可能的具体机制。
观察时间点(分别记为1a组~1e组、2a组~2e组),每个时间点8只大鼠。本研究由辽宁医学院附属第一医院伦理委员会审核通过。
1.2.2 模型制备 所有大鼠术前12 h禁食水,10%水合氯醛(40 mg/kg)腹腔注射麻醉,仰卧,腹部皮肤剪毛后消毒。I/R组大鼠采用Zivin法[7]建立SCII模型:大鼠无菌条件下行腹部旁正中切口,暴露腹主动脉,于左肾动脉分叉下方约0.5 cm处放置动脉夹夹闭腹主动脉,夹闭30 min后取出动脉夹,腹腔脏器复位,逐层缝合,分笼饲养。Sham组只开腹并暴露腹主动脉,不夹闭,30 min后关腹,待大鼠清醒后处死。RIPC组大鼠用宽10 mm的橡皮驱血带在大腿根部拉紧,采用多普勒血流探测仪监测下肢动脉血流中段,阻断下肢血流10 min,恢复血流10 min,重复2次,30 min后用Zivin法[7]制作大鼠SCII模型。
1.2.3 取材 分别随机取出各组大鼠4只,麻醉满意后固定于手术台上,开胸暴露心脏,经左心室插管至升主动脉,剪开右心耳,用灌注泵灌入4 ℃ 0.9%氯化钠溶液250 ml,待流出液清亮后,再灌入4 ℃ 4%多聚甲醛300 ml。取出L2~L5节段脊髓组织,剥去脊髓神经及大部脊膜,于4%多聚甲醛中固定,后进行石蜡包埋,切片机切片,厚度5 μm。
1.2.4 苏木素-伊红(HE)染色 60 ℃烤片0.5 h,二甲苯、梯度乙醇脱蜡,蒸馏水冲洗,苏木素染色5 min,流水稍洗去苏木素后1%盐酸乙醇浸泡3 s,流水冲洗30 min,伊红液染色1 min,蒸馏水稍洗后梯度乙醇、二甲苯脱水,中性树胶封固。电子显微镜下观察脊髓组织学形态,并在高倍镜下(×400)随机选取4个节段脊髓前角不同部位进行拍摄。
1.2.5 免疫组化法检测BDNF阳性表达细胞数 按照PV9001通用型Polymer Kit试剂盒说明书进行免疫组化染色,兔抗鼠BDNF抗体工作浓度1∶50,DAB显色,复染、脱水、透明、封固。采用电子显微镜观察切片并在高倍镜下(×400)随机选取4个节段脊髓前角不同部位6个视野进行拍摄,记录BDNF阳性表达细胞数。
1.2.6 TUNEL法检测细胞凋亡情况 石蜡切片常规脱蜡,3%过氧化氢去离子水孵育,磷酸盐缓冲液(PBS)冲洗5 min,洗涤3次,蛋白酶K消化,PBS冲洗,加50 μl TUNEL反应混合液(Sham组仅加50 μl 荧光素标记的脱氧尿嘧啶核苷三磷酸液)于标本上,在4 ℃湿盒中反应24 h。PBS冲洗,加50 μl转化剂过氧化物酶(POD)于标本上,于37 ℃恒温箱中反应30 min;PBS冲洗,在组织处加DAB,室温反应10 min;PBS冲洗,苏木素染色、梯度乙醇脱水、二甲苯透明、中性树胶封固。在高倍镜下(×400)随机选取4个不同节段脊髓不同部位6个视野,用Image Pro Plus 6.0软件记录TUNEL阳性表达细胞数。
1.2.7 Western blotting法检测BDNF表达水平 分别取出各组剩余的4只大鼠,麻醉满意后,用同样方法迅速取出L2~L5节段脊髓组织,-80 ℃冻存。取长约5 mm的脊髓节段,冰上裂解、匀浆,紫外分光光度仪测定BDNF表达水平,调节各组蛋白水平一致,沸水煮5 min。取等量BDNF样品,10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,采用半干法将蛋白条带转移至聚偏二氟乙烯(PVDF)膜上,1% 牛血清清蛋白(BSA)封闭1 h,兔抗鼠BDNF抗体(1∶1 000)摇床上4 ℃孵育过夜,三羟甲基氨基甲烷缓冲溶液(TBST)漂洗5 min,洗涤3次,山羊抗兔IgG二抗(1∶1 000),室温摇床上孵育1 h,TBST漂洗,化学发光试剂(ECL)发光,显影。以β-actin条带为内参照,用BDNF吸光度值(optical density,OD值)与β-actin OD值的比值表示相对蛋白表达水平。
1.2.8 大鼠后肢运动功能(BBB)评分 由2名不了解实验分组的观察者采用Basso等[8]提出的BBB评分体系分别于再灌注0、6、12、24、72 h对所有大鼠进行神经功能评分,包括0~21级,神经功能完全缺失为0分,神经功能完全正常为21分。

2 结果
2.1 HE染色结果 Sham组脊髓可见形态正常的神经元,核仁居中、清晰,可见尼氏体。1a组神经元及神经胶质细胞轻微增大,神经元间隙稍增宽,脊髓呈病理学改变。1b组神经元轻微增大,神经元间隙增宽,部分神经元胞核固缩。1c组神经元及神经胶质细胞增大,神经元间隙增宽,神经元胞核固缩,部分裂解。1d组正常神经元数量减少,神经元及胶质细胞肿大,核固缩、偏位,部分核裂解,偶可见空泡样变性。1e组正常神经元数量明显减少,神经元及胶质细胞肿大,核固缩、偏位,部分核裂解,神经元间隙增大,周围有空泡形成,脊髓病理学改变加重。2b组~2e组脊髓病理改变较1b组~1e组稍轻,正常神经元较多,偶可见神经元胞质空泡样变性(见图1)。
2.2 BDNF阳性表达细胞数比较 BDNF阳性表达神经元胞质呈棕褐色,细胞为圆形、椭圆形或三角形,分布于脊髓灰质,阳性小胶质细胞散在分布于脊髓灰质和白质。Sham组仅在脊髓前角见BDNF阳性表达细胞散在分布,稀疏且胞质染色较浅。I/R组、RIPC组BDNF阳性表达细胞主要分布于脊髓前角和中央带(见图2)。各组间BDNF阳性表达细胞数比较,差异有统计学意义(F=968.456,P<0.05)。1a组~1e组、2a组~2e组BDNF阳性表达细胞数均高于Sham组,差异有统计学意义(P<0.05);2b组~2e组BDNF阳性表达细胞数分别高于1b组~1e组,差异有统计学意义(P<0.05);1b组~1e组BDNF阳性表达细胞数均高于1a组,差异有统计学意义(P<0.05);2b组~2e组BDNF阳性表达细胞数均高于2a组,差异有统计学意义(P<0.05,见表1)。
2.3 细胞凋亡情况比较 TUNEL阳性表达细胞胞核呈深染棕褐色。Sham组脊髓前角偶见凋亡神经元,脊髓灰质、白质散在分布凋亡神经胶质细胞。I/R组、RIPC组TUNEL阳性表达细胞主要分布于脊髓前角及中央带(见图3)。各组间TUNEL阳性表达细胞数比较,差异有统计学意义(P<0.05)。1a组~1e组、2b组~2e组TUNEL阳性表达细胞数均高于Sham组,差异有统计学意义(P<0.05);2a组~2e组TUNEL阳性表达细胞数分别低于1a组~1e组,差异有统计学意义(P<0.05);1b组~1e组TUNEL阳性表达细胞数均高于1a组,差异有统计学意义(P<0.05);2b组~2e组TUNEL阳性表达细胞数均高于2a组,差异有统计学意义(P<0.05,见表2)。
2.4 BDNF表达水平比较 在25 KDa、43 KDa分子量处分别可见BDNF、β-actin特异性条带(见图4)。各组间BDNF表达水平比较,差异有统计学意义(F=968.456,P<0.05)。1a组~1e组、2a组~2e组BDNF表达水平均高于Sham组,差异有统计学意义(P<0.05);2a组~2e组BDNF表达水平分别高于1a组~1e组,差异有统计学意义(P<0.05);1b组~1e组BDNF表达水平均高于1a组,差异有统计学意义(P<0.05);2b组~2e组BDNF表达水平均高于2a组,差异有统计学意义(P<0.05,见图5)。
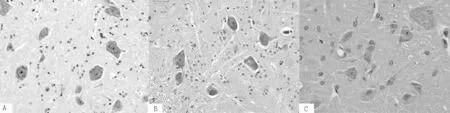
注:A为Sham组脊髓神经元核仁居中、清晰,可见尼氏体;B为1e组脊髓神经元肿大,核固缩、偏位,部分核裂解;C为2e组正常脊髓神经元增多,偶可见脊髓神经元胞质空泡样变性
图1 各组大鼠脊髓切片光镜下表现(HE染色,×100)
Figure 1 Manifestation of the spinal cord slice of each group under light microscope

注:箭头为脑源性神经营养因子(BDNF)阳性表达细胞;A为Sham组部分神经元胞质呈浅棕褐色;B为1a组出现BDNF阳性表达细胞增多;C为1e组 BDNF阳性表达细胞显著增多,胞质着色深;D为2e组 BDNF阳性表达细胞较1e组多,且胞质着色更深
图2 各组大鼠脊髓组织BDNF阳性表达细胞(免疫组化法,×400)
Figure 2 BDNF positive cells of rat spinal cord of each group

注:A为Sham组偶可见原位细胞凋亡(TUNEL)阳性表达细胞;B为1e组细胞核固缩、深染,呈棕褐色,TUNEL阳性表达细胞显著增多,达高峰;C为2e组TUNEL阳性表达细胞较1e组少
图3 各组大鼠脊髓组织TUNEL阳性表达细胞(TUNEL染色,×400)
Figure 3 TUNEL positive cells of rat spinal cord of each groups
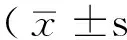
Table 1 Comparison of the number of BDNF positive cells among all the groups
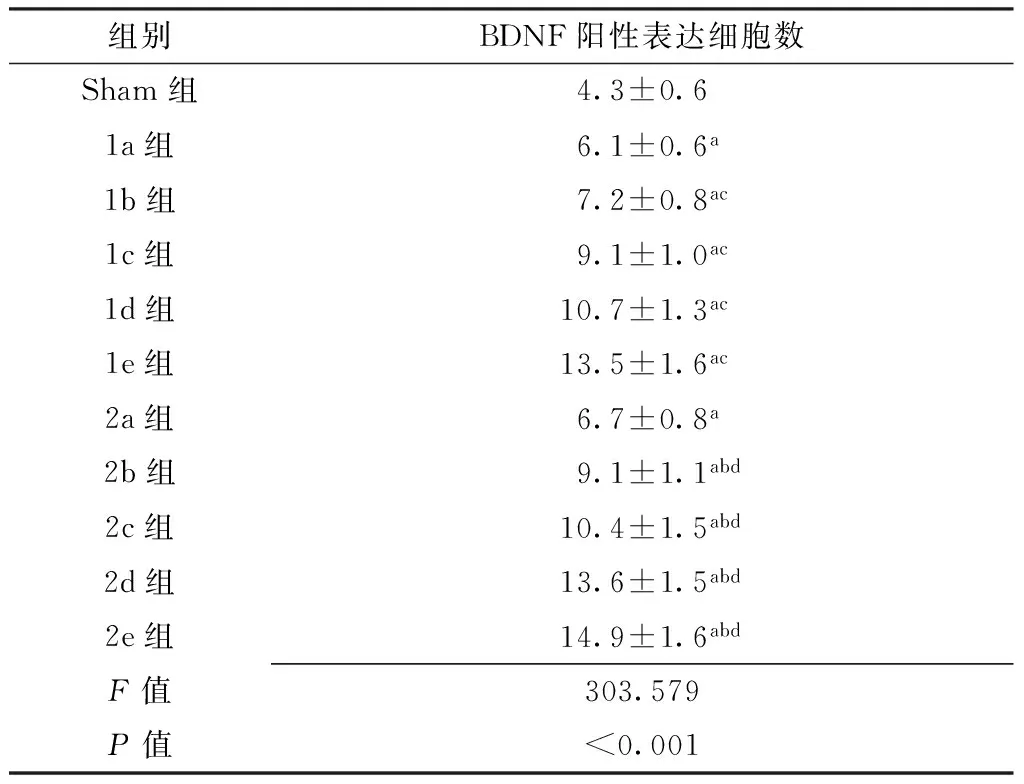
组别BDNF阳性表达细胞数Sham组4.3±0.61a组6.1±0.6a1b组7.2±0.8ac1c组9.1±1.0ac1d组10.7±1.3ac1e组13.5±1.6ac2a组6.7±0.8a2b组9.1±1.1abd2c组10.4±1.5abd2d组13.6±1.5abd2e组14.9±1.6abdF值303.579P值<0.001
注:Sham组=假手术组,1a组~1e组=缺血再灌注组再灌注0、6、12、24、72 h 5个观察时间点,2a组~2e组=远程缺血预处理组再灌注0、6、12、24、72 h 5个观察时间点,BDNF=脑源性神经营养因子;与Sham组比较,aP<0.05;与同一时间点I/R组比较,bP<0.05;与1a组比较,cP<0.05;与2a组比较,dP<0.05
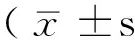
Table 2 Comparison of the number of TUNEL positive cells among all the groups
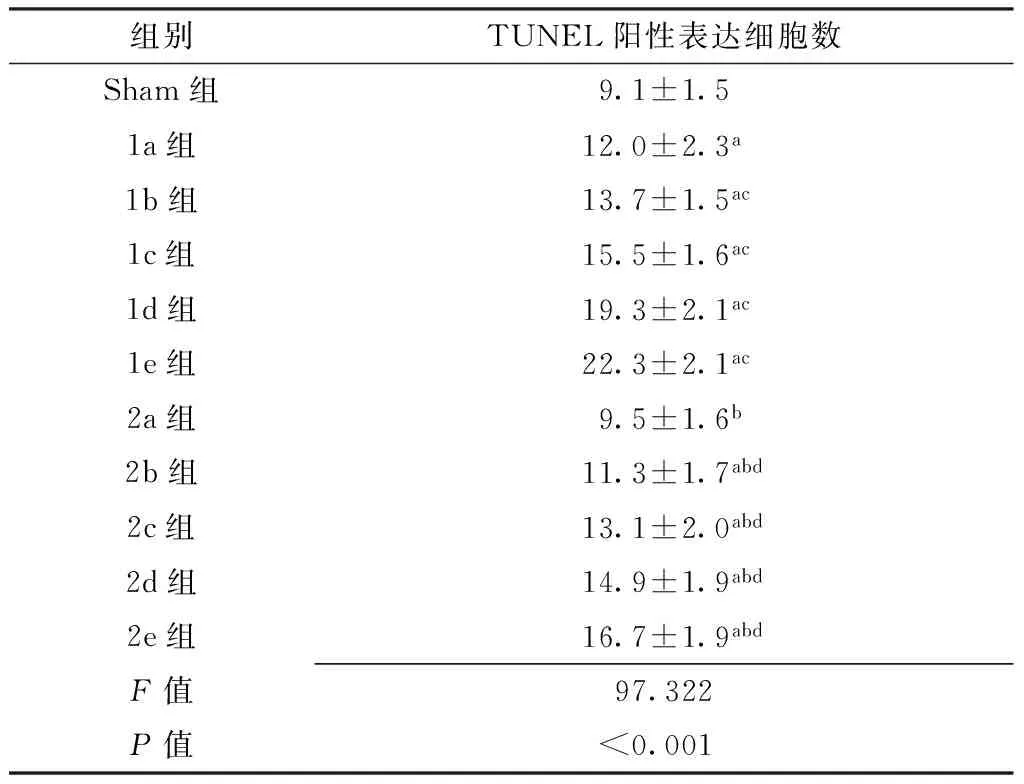
组别TUNEL阳性表达细胞数Sham组9.1±1.51a组12.0±2.3a1b组13.7±1.5ac1c组15.5±1.6ac1d组19.3±2.1ac1e组22.3±2.1ac2a组9.5±1.6b2b组11.3±1.7abd2c组13.1±2.0abd2d组14.9±1.9abd2e组16.7±1.9abdF值97.322P值<0.001
注:TUNEL=原位细胞凋亡;与Sham组比较,aP<0.05;与同一时间点I/R组比较,bP<0.05;与1a组比较,cP<0.05;2a组比较,dP<0.05
2.5 各组BBB评分比较 各组间BBB评分比较,差异有统计学意义(F=1 978.093,P<0.001)。1a组~1e组、2a组~2e组BBB评分均低于Sham组,差异有统计学意义(P<0.05);2a组~2e组BBB评分分别高于1a组~1e组,差异有统计学意义(P<0.05);1b组~
1e组BBB评分均高于1a组,差异有统计学意义(P<0.05);2b组~2e组BBB评分均高于2a组,差异有统计学意义(P<0.05,见图6)。

注:BDNF=脑源性神经营养因子
图4 Western blotting法检测BDNF表达水平
Figure 4 BDNF expression level detected by Western blotting method
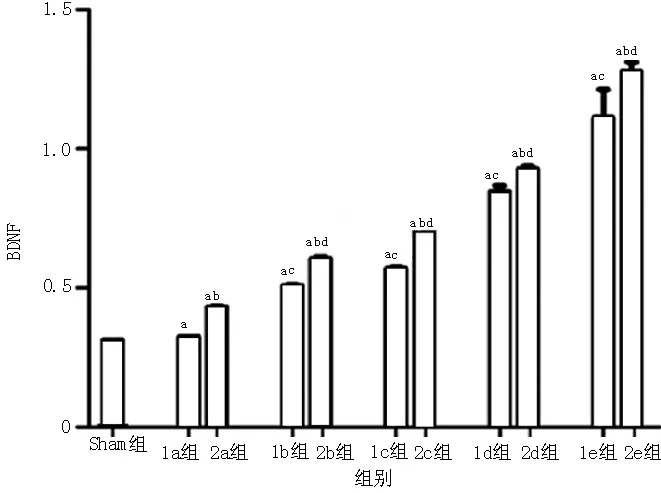
注:与Sham组比较,aP<0.05;与同一时间点I/R组比较,bP<0.05;与1a组比较,cP<0.05;2a组比较,dP<0.05
图5 各组大鼠BDNF表达水平比较
Figure 5 Comparison of BDNF expression level among all the groups
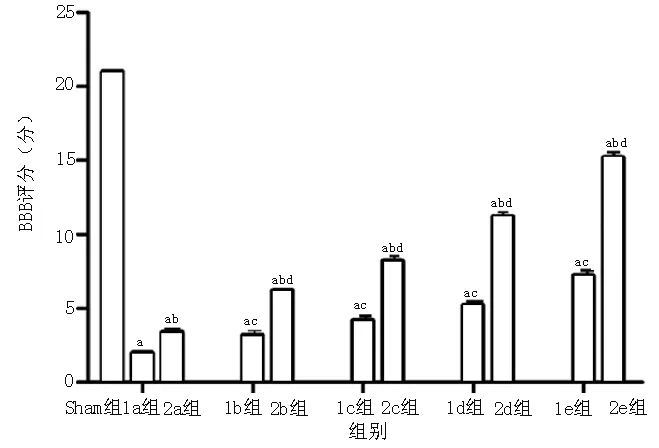
注:BBB=后肢运动功能;与Sham组比较,aP<0.05;与同一时间点I/R组比较,bP<0.05;与1a组比较,cP<0.05;与2a组比较,dP<0.05
图6 各组大鼠BBB评分比较
Figure 6 Comparison of BBB score among all the groups
3 讨论
SCII是指损伤脊髓在恢复血流供应后,原有损伤进行性加重,造成神经元损伤、脊髓神经功能丧失的现象。提高脊髓缺血耐受能力的方法主要有:体外转流或分流术、脑脊液引流术、药物治疗及亚低温处理等[9-12],RIPC同样对SCII有保护作用[13]。有文献指出,RIPC时间小于5 min或者超过15 min均不能对远隔器官起保护作用[14-15],本实验在RIPC组选用文献中较常用的方法[16],双下肢用驱血带扎紧,采用多普勒血流探测仪监测下肢动脉血流中段,阻断下肢血流10 min,恢复血流10 min,重复操作2次,30 min后再行缺血再灌注实验。本实验采用HE染色方法观察脊髓病理学变化情况,结果显示,RIPC组脊髓损伤程度较I/R组轻,说明RIPC可减轻SCII后脊髓的病理变化过程。
BDNF广泛分布于中枢神经系统,是脊髓运动神经元一个重要的生存因子[17-18]。在脑缺血中,其通过稳定细胞内Ca2+浓度、减轻自由基损伤、抗细胞凋亡、增强蛋白激酶活性等作用延缓神经元坏死和凋亡,从而对神经元起保护作用[19]。Ziemlińska等[20]在脊髓横断大鼠中发现,BDNF的过表达可通过增加谷氨酸能和氨基丁酸能的神经传递而增强早期运动功能的恢复。Ikeda等[21]发现,鞘内注射BDNF可通过提高脊髓损伤后铜/锌超氧化物歧化酶和髓鞘碱性蛋白在神经元和神经胶质细胞中的活性从而对神经功能恢复起积极作用。本研究免疫组化结果显示,Sham组仅在脊髓前角见BDNF阳性表达细胞散在分布,稀疏且胞质染色较浅;I/R组、RIPC组BDNF阳性表达细胞主要分布于脊髓前角和中央带;1a组~1e组、2a组~2e组BDNF阳性表达细胞数均高于Sham组;2b组~2e组BDNF阳性表达细胞数分别高于1b组~1e组;1b组~1e组BDNF阳性表达细胞数均高于1a组;2b组~2e组BDNF阳性表达细胞数均高于2a组。说明RIPC可诱导神经元释放内源性BDNF。有文献报道,BDNF主要通过与受体酪氨酸激酶B(TrkB)结合,激活Ras蛋白-有丝分裂原激活蛋白激酶(Ras-MAPK)通路,增加BDNF基因及抗凋亡蛋白基因B淋巴细胞瘤2(BCL-2)基因的表达,促进神经元存活及神经生长,增加突触可塑性[22]。杨成伟等[23]认为,RIPC可抑制兔SCII过程中凋亡信号调节激酶1(ASK1)介导的脊髓神经元凋亡。本研究结果显示,1a组~1e组、2b组~2e组TUNEL阳性表达细胞数均高于Sham组;2a组~2e组TUNEL阳性表达细胞数分别低于1a组~1e组;1b组~1e组TUNEL阳性表达细胞数均高于1a组;2b组~2e组TUNEL阳性表达细胞数均高于2a组。表明细胞凋亡在SCII后神经元丢失过程中发挥重要作用,RIPC可减轻SCII后神经元凋亡,从而起到一定程度的保护作用。本研究采用Western blotting法检测BDNF表达情况,结果显示,在25 KDa分子量处见BDNF特异性条带,1a组~1e组、2a组~2e组BDNF表达水平均高于Sham组;2a组~2e组BDNF表达水平分别高于1a组~1e组;1b组~1e组BDNF表达水平均高于1a组;2b组~2e组BDNF表达水平均高于2a组,提示RIPC可诱导SCII后BDNF表达水平增高。本研究结果显示,1a组~1e组、2a组~2e组BBB评分均低于Sham组,2a组~2e组BBB评分分别高于1a组~1e组,说明大鼠SCII后发生了比较明显的神经功能障碍,而且RIPC可减轻SCII后神经功能障碍,有利于运动功能恢复。
总之,RIPC可使SCII后BDNF表达水平升高,且RIPC对SCII具有保护作用,其可能通过激活内源性BDNF表达水平增加从而抑制神经元凋亡来发挥保护作用。本研究主要在动物模型上对BDNF进行研究,BDNF基因的表达变化有待进一步研究,同时本实验可为SCII的治疗提供新的治疗思路,然而BDNF在其中发挥作用的具体靶点及作用通路尚不十分明确,还需要进一步深入研究。
[1]Przyklenk K,Bauer B,Ovize M,et al.Regional ischemic 'preconditioning' protects remote virgin myocardium from subsequent sustained coronary occlusion[J].Circulation,1993,87(3):893-899.
[2]Fang B,Li XM,Sun XJ,et al.Ischemic preconditioning protects against spinal cord ischemia-reperfusion injury in rabbits by attenuating blood spinal cord barrier disruption[J].Int J Mol Sci,2013,14(5):10343-10354.
[3]Fan J,Zhang Z,Chao X,et al.Ischemic preconditioning enhances autophagy but suppresses autophagic cell death in rat spinal neurons following ischemia-reperfusion[J].Brain Res,2014,1562:76-86.
[4]Cai FG,Xiao JS,Ye QF.Effects of ischemic preconditioning on cyclinD1 expression during early ischemic reperfusion in rats[J].World J Gastroenterol,2006,12(18):2936-2940.
[5]Kyrou IE,Papakostas JC,Ioachim E,et al.Spinal cord early ischemic preconditioning activates the stabilized fraction of β-catenin after thoracoabdominal aortic occlusion in pigs[J].Ann Vasc Surg,2013,27(4):480-486.
[6]Wenjin W,Wenchao L,Hao Z,et al.Electrical stimulation promotes BDNF expression in spinal cord neurons through Ca(2+)-and Erk-dependent signaling pathways[J].Cell Mol Neurobiol,2011,31(3):459-467.
[7]Zivin JA,De GU.Spinal cord infarction:a highly reproducible stroke model[J].Stroke,1980,11(2):200-202.
[8]Basso DM,Beattie MS,Bresnahan JC,et al.MASCIS evaluation of open field locomotor scores:effects of experience and teamwork on reliability.Multicenter Animal Spinal Cord Injury Study[J].J Neurotrauma,1996,13(7):343-359.
[9]Conrad MF,Ergul EA,Patel VI,et al.Evolution of operative strategies in open thoracoabdominal aneurysm repair[J].J Vasc Surg,2011,53(5):1195-1201.
[10]Bisdas T,Redwan A,Wilhelmi M,et al.Less-invasive perfusion techniques may improve outcome in thoracoabdominal aortic surgery[J].J Thorac Cardiovasc Surg,2010,140(6):1319-1324.
[11]Matsuda H,Ogino H,Fukuda T,et al.Multidisciplinary approach to prevent spinal cord ischemia after thoracic endovascular aneurysm repair for distal descending aorta[J].Ann Thorac Surg,2010,90(2):561-565.
[12]阎平建,王峥,刘建光,等.法舒地尔对家兔脊髓缺血再灌注损伤的保护作用[J]. 神经损伤与功能重建, 2012, 7(1):32-34.
[13]Gurcun U,Disciqil B,Boqa M,et al.Is remote preconditioning as effective as direct ischemic preconditioning in preventing spinal cord ischemic injury?[J].J Surg Res,2006,135(2):385-393.
[14]Carini R,De Cesaris MG,Splendore R,et a1.Ischemic preconditioning reduces Na(+) accumulation and cell killing in isolated rat hepmocytes exposed to hypoxia[J].Hepatology,2000,31(1):166-172.
[15]Teoh N,Dela Pena A,Farrell G.Hepatic ischemic preconditioning in mice is associated with activation of NF-kappa B,p38 kinase,and cell cycle entry[J].Hepatology,2002,36(1):94-102.
[16]Zeng JF,Luo ZZ.The protection of remote ischemic preconditioning after spinal cord ischemic reperfusion injury[J].Chinese Journal of Spine and Spinal Cord,2013,23(2):181-184.(in Chinese) 曾金芳,罗振中.远程缺血预处理对脊髓缺血再灌注损伤保护作用的研究进展[J].中国脊柱脊髓杂志,2013,23(2):181-184.
[17]Sendtner M,Pei G,Beck M,et al.Development motoneurons cell death and neurotrophic factors[J].Cell Tissue Res,2000,301(1):71-84.
[18]赵秀秀,韩肖华,郭风,等.高频重复经颅磁刺激对脑缺血后海马BDNF、VEGF和Nestin表达的影响及机制研究[J].神经损伤与功能重建,2013,8(6):431-434.
[19]Zhang M,Wu HQ,Wang HQ.The role of BDNF in nervous system disease[J].Stroke and Nervous Diseases,2013,20(6):384-387.(in Chinese) 张萌,吴海琴,王虎清.BDNF在神经系统疾病中的作用机制[J].卒中与神经疾病,2013,20(6):384-387.
[20]Ziemlińska E,Kügler S,Schachner M,et al.Overexpression of BDNF increases excitability of the lumbar spinal network and leads to robust early locomotor recovery in completely spinalized rats[J].PLoS One,2014,9(2):e88833.
[21]Ikeda O,Murakami M,Ino H,et al.Effects of brain-derived neurotrophic factor(BDNF) on compression-induced spinal cord injury:BDNF attenuates down-regulation of superoxide dismutase expression and promotes up-regulation of myelin basic protein expression[J].J Neuropathol Exp Neurol,2002,61(2):142-153.
[22]Ji Y,Pang PT,Feng L,et al.Cyclic AMP controls BDNF-induced TrkB phosphorylation and dendritic spine formation in mature hippocampal neurons[J].Nat Neurosci,2005,8(2):164-172.
[23]Yang CW,Li D,Yin GY,et al.Ischemic preconditioning protects the rabbit spinal cord by inhibition of apoptosis induced through the ASK1-dependent pathway during ischemia/reperfusion injury[J].Chinese Journal of Orthopaedic Trauma,2009,11(1):56-60.(in Chinese) 杨成伟,李丁,殷国勇,等.缺血预处理对再灌注脊髓神经细胞凋亡及细胞凋亡信号调节激酶-1蛋白活化的影响[J].中华创伤骨科杂志,2009,11(1):56-60.
(本文编辑:崔丽红)
Effect of Remote Ischemic Preconditioning on the Expression of Brain-derived Neurotrophic Factor in Rats With Spinal Cord Ischemia-reperfusion Injury
TONGSong-ming,CAOYang,YUDe-shui,etal.
DepartmentofOrthopedics,theFirstAffiliatedHospitalofLiaoningMedicalUniversity,Jinzhou121001,China
Objective To investigate the effect of remote ischemic preconditioning(RIPC) on the expression of brain-derived neurotrophic factor(BDNF) in rats with spinal cord ischemia-reperfusion injury(SCII).Methods From May to November in 2014,using random number table,88 male Sprague Dawleys rats were randomly divided into three groups:the Sham group(n=8),the ischemia-reperfusion group(I/R group,n=40) and the remote ischemic preconditioning group(RIPC group,n=40).For I/R group and RIPC group,5 observation time points were set,including 0,6,12,24 and 72 hours after reperfusion(designated as group 1a -1e for I/R group and group 2a-2e for RIPC group),8 rats at each time point.For the rats in Sham group,only abdominal aorta below renal artery was isolated but without blocking;SCII model was built for the rats in I/R group by using Zivin method;for the rats in RIPC group,the lower limb blood flow was blocked with a tourniquet for 10 min and then was loosen for 10 min for reperfusion,which was done twice,and then SCII model was built using Zivin method 30 minutes later.Spinal cord was sampled from the rats.HE staining was used to observe pathological changes,the number of BDNF positive cells were detected by immunohistochemistry test,the cell apoptosis were assessed by TUNEL staining,Western blotting method was employed to detect the protein expression level of BDNF,and the BBB scores of the rats were evaluated.Results No evident pathological changes were noted in Sham group,while pathological changes were evident in I/R group,and the pathological changes in RIPC group were slighter than I/R group at five time points.Group 1a-1e and group 2a-2e were higher(P<0.05) than Sham group in the number of BDNF positive cells,the protein expression level of BDNF;group 1a-1e and group 2a-2e were lower(P<0.05) than Sham group in BBB score;group 1a-1e and group 2b-2e were higher(P<0.05) than Sham group in the number of TUNEL positive cells;group 2b-2e were higher(P<0.05) than group 1b-1e in the number of BDNF positive cells;group 2a-2e were higher(P<0.05) than group 1a-1e in the protein expression level of BDNF and BBB score;group 2a-2e were lower(P<0.05) than group 1a-1e in the number of TUNEL positive cells,group 1b-1e were higher(P<0.05) than group 1a in the number of BDNF positive cells,the number of TUNEL positive cells,the protein expression level of BDNF and BBB score;group 2b-2e were higher(P<0.05) than group 2a in the number of BDNF positive cells,the number of TUNEL positive cells,the protein expression level of BDNF and BBB score.Conclusion Remote ischemic preconditioning can increase the expression of BDNF in rats with spinal cord ischemia-reperfusion injury,and it may play a protective role through increasing the expression of BDNF.
Reperfusion injury;Ischemic preconditioning;Brain-derived neurotrophic factor;Apoptosis
国家自然科学基金资助项目(81471853);辽宁省博士启动基金资助项目(20121096);辽宁医学院校长基金-奥鸿博泽研究生科研创新基金资助项目(AH2014019)
121001 辽宁省锦州市,辽宁医学院附属第一医院骨科
曹阳,121001 辽宁省锦州市,辽宁医学院附属第一医院骨科;E-mail:cyangfsyy@163.com
于德水,121001 辽宁省锦州市,辽宁医学院附属第一医院骨科;E-mail:ydsfsyy@163.com
R 651.21
A
10.3969/j.issn.1007-9572.2015.21.012
2015-04-13;
2015-05-12)
